Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Flores - Yadira Milagro - Mapa Conceptual - IP
Cargado por
Milagro FloresTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Flores - Yadira Milagro - Mapa Conceptual - IP
Cargado por
Milagro FloresCopyright:
Formatos disponibles
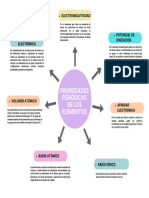
En los grupos, de arriba hacia abajo, aumenta el
tamaño atómico y disminuyen la energía de
ionización, la afinidad electrónica y la
electronegatividad. En los períodos, de izquierda
a derecha, el tamaño atómico disminuye y la
energía de ionización, la afinidad electrónica y la
electronegatividad aumentan, aunque la afinidad
electrónica lo hace de forma irregular.
RESUMEN
PROPIEDADES PERIÓDICAS
DE LOS ELEMENTOS
ENERGÍA DE IONIZACIÓN AFINIDAD ELECTRÓNICA
RADIO ATÓMICO TAMAÑO DEL ÁTOMO ELECTRONEGATIVIDAD
Es la distancia del centro del
El átomo no puede tener limites Es la energía liberada cuando un Es la capacidad de un átomo en una
átomo hasta la ultima capa del Es la energía necesaria para
bien definidos, para medir el electrón se adiciona a la capa de molécula para atraer los electrones
elemento. extraer un electrón de un átomo
tamaño es necesario definir las valencia de otro elemento. Es un hacia si en una unión covalente. La
aislado en su fase gaseosa, a
circunstancia en las cuales el proceso exotérmico pero contradice la electronegatividad no es una propiedad
medida es llamado potencial de
átomo existe. convencion termodinámica universal y de un átomo aislado, sino es una
PERIODOS ionización.
GRUPOS se le asigna valor positivo. propiedad de un átomo en una
PERIODOS Y GRUPOS molécula, en el ambiente y bajo la
influencia de los átomos que la rodean.
PERIODOS
En un mismo periodo a medida que En los grupos el radio atómico GRUPOS
se avanza de izquierda a derecha aumenta con el numero atómico , En la tabla periódica, el tamaño atómico varía de la
el radio atómico disminuye ya que esto se debe a que los electrones se siguiente manera: En un grupo aumenta de arriba PERIODOS Y GRUPOS
la carga nuclear efectiva aumenta localizan en niveles energéticos hacia abajo pues en ese sentido aumenta el Al aumentar el número atómico de los Al aumentar el número atómico de los
ósea hay mayor atracción del mayores, aumentando la distancia del número de niveles ocupados con electrones y elementos de un mismo período, se elementos de un mismo grupo, disminuye
incrementa la atracción nuclear sobre el la atracción nuclear sobre el electrón más En general, en los períodos, la
núcleo sobre los electrones de la núcleo con el electrón de valencia. aumenta el efecto pantalla por lo cual los electrones electronegatividad se incrementa de Esta magnitud es muy útil cuando se
ultima capa. externos pueden alejarse del núcleo; en un período electrón más externo, ya que disminuye el externo, ya que aumenta el radio atómico, trata de predecir el tipo de enlace
izquierda a derecha al aumentar el
disminuye de izquierda a derecha pues en este radio atómico y aumenta la carga nuclear mientras que no varía la carga nuclear número atómico, mientras que, en los que formarán dos átomos: si la
sentido aumenta el número atómico aumentando la efectiva sobre él.Por ello en un período, al efectiva sobre él. En un grupo, al grupos, aumenta al ir de abajo hacia diferencia de electronegatividades es
carga nuclear mientras que el efecto pantalla y el aumentar el número atómico, se hace aumentar el número atómico, disminuye arriba, es decir, al disminuir el número muy grande, el enlace será iónico,
mayor la energía de ionizacion. atómico. Debes notar que los gases mientras que, si es pequeño, será
Esto se debe a gran medida a que a número de niveles permanecen constantes. la energía de ionización.
nobles carecen de valor de la covalente, más o menos polarizado,
medida se avanza en los periodos los electronegatividad, lo que es lógico si con arreglo a la diferencia de
electrones de valencia se van consideramos que estos elementos se electronegatividad entre los átomos.
localizando en orbitales P,d y f que EJEMPLO caracterizan por su mínima tendencia a
son menos penetrables son menos formar enlaces con los demás elementos.
penetrables y estos ejercen menor
efecto de pantalla. Los elementos halógenos son los Los elementos alcalinotérreos y EJEMPLO
que forman aniones X- con mayor los del grupo 15 presentan una
facilidad. Todos ellos tienen una mínima tendencia a aceptar un
estructura electrónica de valencia electrón. Esto es debido a que
ns2 np5 y, por lo tanto, al aceptar el
sus estructuras electrónicas
electrón, alcanzan estructura externas son ns2 y ns2 np3
electrónica externa de gas noble,
EJEMPLO respectivamente, que confieren
ns2 np6 que es especialmente estabilidad adicional al sistema.
estable.
EJEMPLO
2He :
- 1 Energía de ionización=2,372
KJ/mol
- 2 Energía de ionización= 5,250
KJ/mol
Integrantes:
Josué David Nolasco Murillos (20211022808)
Sary Yaritza Espino Varela (20211022281)
Tristan Moisés Oviedo Cáceres (20211022473)
Yadira Milagro Flores Calderón (20211000691)
También podría gustarte
- Mapa Mental Propiedades PeriodicasDocumento1 páginaMapa Mental Propiedades PeriodicasGabriel García BautistaAún no hay calificaciones
- Tabla PeriódicaDocumento1 páginaTabla PeriódicaDaniel Cruz BecerrilAún no hay calificaciones
- Propiedades PeriódicasDocumento1 páginaPropiedades PeriódicasYaineth OrtizAún no hay calificaciones
- La Naturaleza Electrica de La MateriaDocumento7 páginasLa Naturaleza Electrica de La Materiarotkox eterAún no hay calificaciones
- Eduardo Rodríguez QuimicaDocumento1 páginaEduardo Rodríguez QuimicaLalo RodríguezAún no hay calificaciones
- Actividad 2.2 QuimicaDocumento1 páginaActividad 2.2 Quimicacarla ximena hernandezAún no hay calificaciones
- Mapa Conceptual ElectromagnetismoDocumento1 páginaMapa Conceptual ElectromagnetismoElliott Arrieta100% (3)
- Material Periocidad de La TablaDocumento3 páginasMaterial Periocidad de La TablaIMPRESION IMPRESIONAún no hay calificaciones
- Afinidad ElectrónicaDocumento2 páginasAfinidad ElectrónicaKyara CoronadoAún no hay calificaciones
- Propiedades Químicas de Los Elementos Químicos: Carga Nuclear Efectivo Numero de OxidaciónDocumento4 páginasPropiedades Químicas de Los Elementos Químicos: Carga Nuclear Efectivo Numero de OxidaciónJosé Ángel SánchezAún no hay calificaciones
- Fisica Electrica y Magnetica - 202350 - 02631Documento1 páginaFisica Electrica y Magnetica - 202350 - 02631Daniel JimenezAún no hay calificaciones
- Clase 01Documento7 páginasClase 01Mares RomeroAún no hay calificaciones
- Mapa Conceptual Del Magnetismo 2Documento1 páginaMapa Conceptual Del Magnetismo 2Ibc Jose Joaquin Pardo GallardoAún no hay calificaciones
- P8.FC - Elementos Óhmicos y No ÓhmicosDocumento1 páginaP8.FC - Elementos Óhmicos y No ÓhmicosRicky GonzaloAún no hay calificaciones
- Electro-Guia Indv AiiDocumento1 páginaElectro-Guia Indv AiiMateoAún no hay calificaciones
- Propiedades Periódicas de Los ElementosDocumento3 páginasPropiedades Periódicas de Los ElementosFer ÁngelesAún no hay calificaciones
- Electolisis: Carga Del ElectronDocumento1 páginaElectolisis: Carga Del ElectronAdriana PalomeraAún no hay calificaciones
- Tarea 12 - Benítez AdrianaDocumento4 páginasTarea 12 - Benítez AdrianaAdriana BenitezAún no hay calificaciones
- Mapa Conceptual de Electricidad, Magnetismo, Generación de Electricidad y ConclusionesDocumento1 páginaMapa Conceptual de Electricidad, Magnetismo, Generación de Electricidad y ConclusionesAnayeli Alejo50% (20)
- Quimica Mapa ConceptualDocumento2 páginasQuimica Mapa ConceptualALONDRA SANTOS LOPEZAún no hay calificaciones
- Propiedades FísicasDocumento1 páginaPropiedades FísicasagregorioestebanAún no hay calificaciones
- Cuadro IlustrativoDocumento1 páginaCuadro IlustrativoAlba Dariela Perez CascoAún no hay calificaciones
- Mapa Conceptual de Electricidad Magnetismo Generacion de Electricidad y ConclusionesDocumento1 páginaMapa Conceptual de Electricidad Magnetismo Generacion de Electricidad y Conclusionesmerly80% (5)
- Mapa ConceptualDocumento2 páginasMapa ConceptualjohannaAún no hay calificaciones
- Mapas MentalesDocumento4 páginasMapas MentalesEder BalamAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualMichelle MartínezAún no hay calificaciones
- (La Electricidad Siempre Existe en La Materia) : La Distancia Entre El Núcleo y El Electrón Más Lejos Es 1 AngstromDocumento9 páginas(La Electricidad Siempre Existe en La Materia) : La Distancia Entre El Núcleo y El Electrón Más Lejos Es 1 AngstromJorge Ernesto Beltran CastelblancoAún no hay calificaciones
- Cap 5 Electricidad Magnetismo y ElectromagnetismoDocumento26 páginasCap 5 Electricidad Magnetismo y ElectromagnetismoMario HernandezAún no hay calificaciones
- Repaso Unidad IDocumento3 páginasRepaso Unidad IROBERTO AYALAAún no hay calificaciones
- Propiedades PeriodicasDocumento2 páginasPropiedades PeriodicasADRIANA SOFIA SEBA TIBOCHAAún no hay calificaciones
- Anexo 2 - Tarea 3Documento22 páginasAnexo 2 - Tarea 3andres felipe contrerasAún no hay calificaciones
- Circuitos ElectricosDocumento8 páginasCircuitos ElectricosKevin A Batista SanchezAún no hay calificaciones
- Mapa Conceptual. Física Ii. Unidad 10Documento4 páginasMapa Conceptual. Física Ii. Unidad 10Johandry GraterolAún no hay calificaciones
- Mapa Mental DDocumento6 páginasMapa Mental DDANIELA HUERTA PEREZAún no hay calificaciones
- Afinidad de Electrónica Presentación Muestra 2Documento5 páginasAfinidad de Electrónica Presentación Muestra 2Rosa GomezAún no hay calificaciones
- Mapa ConceptualDocumento4 páginasMapa ConceptualLizeth Berenice Jiménez MorenoAún no hay calificaciones
- Potencial EléctricoDocumento3 páginasPotencial EléctricoCRISTIAN GONZÁLEZAún no hay calificaciones
- Oranizador Marchan AlfonsoDocumento2 páginasOranizador Marchan AlfonsoAlfonso MarchanAún no hay calificaciones
- Cuadro Comparativo PR.2Documento1 páginaCuadro Comparativo PR.2MARIBEL SANCHEZAún no hay calificaciones
- Fundamentos Conceptuales Elementos Ohmicos y No OhmicosDocumento2 páginasFundamentos Conceptuales Elementos Ohmicos y No OhmicosJaela Belen100% (1)
- Taller Resuelto Proceso Fisico QuimicoDocumento4 páginasTaller Resuelto Proceso Fisico QuimicoRONALD QUIROZAún no hay calificaciones
- Consigna7 - Alfredo Azael Barragán CruzDocumento3 páginasConsigna7 - Alfredo Azael Barragán CruzAzael CruzAún no hay calificaciones
- ESPECTROFOTOMETRIADocumento1 páginaESPECTROFOTOMETRIABrayan Steven Cepeda SoraAún no hay calificaciones
- La Tabla Periódica y Propiedades PeriódicasDocumento16 páginasLa Tabla Periódica y Propiedades PeriódicasMARIA LUISA MARTINEZAún no hay calificaciones
- MapasM - Electricidad y MagnetismoDocumento5 páginasMapasM - Electricidad y MagnetismoMiguel RamirezAún no hay calificaciones
- Radio AtomicoDocumento1 páginaRadio AtomicoRUTH ALLYSON QUINTANA CABADAAún no hay calificaciones
- Efectos de La ElectricidadDocumento1 páginaEfectos de La ElectricidadGustavo BravoAún no hay calificaciones
- La Corriente EléctricaDocumento1 páginaLa Corriente EléctricaMario Alexander Acero LealAún no hay calificaciones
- Mentefacto Conceptual 201424 8775874Documento2 páginasMentefacto Conceptual 201424 8775874Olguita NiñoAún no hay calificaciones
- Elemento Eléctricos Óhmicos y No ÓhmicosDocumento3 páginasElemento Eléctricos Óhmicos y No ÓhmicosSebas Pérez100% (1)
- Docsity Fundamentos de Electroquimica 1Documento2 páginasDocsity Fundamentos de Electroquimica 1Gustavo ParreñoAún no hay calificaciones
- ONDAS Y ELECTROMAGNETISMOS - WordDocumento1 páginaONDAS Y ELECTROMAGNETISMOS - WordLizeth CuajiAún no hay calificaciones
- Electricidad Básica - M - DULO 1 - UNIDAD 1Documento10 páginasElectricidad Básica - M - DULO 1 - UNIDAD 1gustavo saucedoAún no hay calificaciones
- Electricidad TrpticoDocumento2 páginasElectricidad Trpticomayely DuertoAún no hay calificaciones
- Grafico Mapa Conceptual Creativo MulticolorDocumento3 páginasGrafico Mapa Conceptual Creativo MulticolorBrayan Gomez CalderonAún no hay calificaciones
- Espectro ElectromagneticoDocumento2 páginasEspectro ElectromagneticoJ García GarcíaAún no hay calificaciones
- U3, Clase 1-2-3-4 FísicaDocumento7 páginasU3, Clase 1-2-3-4 FísicaMICHELLE ACSA MONTANARESAún no hay calificaciones
- Enlaces QuimicosDocumento23 páginasEnlaces QuimicosYuri Natalia CumoAún no hay calificaciones
- UV 2.en - EsDocumento11 páginasUV 2.en - EsMilagro FloresAún no hay calificaciones
- Exposión G2 IIParcial-1Documento20 páginasExposión G2 IIParcial-1Milagro FloresAún no hay calificaciones
- Infografia Pruebas de Cetonas en La OrinaDocumento3 páginasInfografia Pruebas de Cetonas en La OrinaMilagro FloresAún no hay calificaciones
- Extracción Líquido-Líquido - CQ-323 IPAC2023Documento25 páginasExtracción Líquido-Líquido - CQ-323 IPAC2023Milagro FloresAún no hay calificaciones
- Guia de Ejercicios Aldehidos y Cetonas 2Documento5 páginasGuia de Ejercicios Aldehidos y Cetonas 2Milagro FloresAún no hay calificaciones
- Mendoza Tiffany Grupoa GE1Documento15 páginasMendoza Tiffany Grupoa GE1Milagro FloresAún no hay calificaciones
- Fórmulas Unidades Físicas de ConcentraciónDocumento1 páginaFórmulas Unidades Físicas de ConcentraciónMilagro FloresAún no hay calificaciones
- Tarea No.2-Bioestadistica-Flores - Yadira - MM241Documento5 páginasTarea No.2-Bioestadistica-Flores - Yadira - MM241Milagro FloresAún no hay calificaciones
- Flores Milagro GrupoA C1Documento10 páginasFlores Milagro GrupoA C1Milagro FloresAún no hay calificaciones
- Agitación y Mezclado de Sistemas I Al IVDocumento43 páginasAgitación y Mezclado de Sistemas I Al IVMilagro FloresAún no hay calificaciones
- Ejercicios de Practica - TitulacionesDocumento5 páginasEjercicios de Practica - TitulacionesMilagro FloresAún no hay calificaciones
- Flores - Yadira - Tarea No. 5 - Bioestadistica - MM241Documento12 páginasFlores - Yadira - Tarea No. 5 - Bioestadistica - MM241Milagro FloresAún no hay calificaciones
- 2 Plantilla de Práctica # 2 Espectroscopia de EmisionDocumento9 páginas2 Plantilla de Práctica # 2 Espectroscopia de EmisionMilagro FloresAún no hay calificaciones
- Flores - Yadira Milagro - qq218 - Iparciala2Documento1 páginaFlores - Yadira Milagro - qq218 - Iparciala2Milagro FloresAún no hay calificaciones
- Tarea Segunda UnidadDocumento2 páginasTarea Segunda UnidadMilagro FloresAún no hay calificaciones
- Tarea No.1-Bioestadistica-Flores - Yadira - MM241Documento9 páginasTarea No.1-Bioestadistica-Flores - Yadira - MM241Milagro FloresAún no hay calificaciones
- Flores Yadira Ensayo IIIPDocumento5 páginasFlores Yadira Ensayo IIIPMilagro FloresAún no hay calificaciones
- Flores - Yadira Milagro - 3parcial - A1Documento11 páginasFlores - Yadira Milagro - 3parcial - A1Milagro FloresAún no hay calificaciones
- Flores - Yadira Milagro - AA14Documento6 páginasFlores - Yadira Milagro - AA14Milagro FloresAún no hay calificaciones
- Flores Milagro 20211000691 Practica5 Viernes7-9 Grupo2Documento6 páginasFlores Milagro 20211000691 Practica5 Viernes7-9 Grupo2Milagro FloresAún no hay calificaciones
- Flores - Yadira Milagro - AA2Documento1 páginaFlores - Yadira Milagro - AA2Milagro FloresAún no hay calificaciones
- Presentacion No 2. Identificacion de Grupos FuncionalesDocumento21 páginasPresentacion No 2. Identificacion de Grupos FuncionalesMilagro FloresAún no hay calificaciones
- Guia de Ejercicios Practica No. 2 Identificación de Grupos FuncionalesDocumento6 páginasGuia de Ejercicios Practica No. 2 Identificación de Grupos FuncionalesMilagro FloresAún no hay calificaciones
- Guia AnatomiaDocumento8 páginasGuia AnatomiaMilagro FloresAún no hay calificaciones
- 4 Plantilla de Práctica # 4 Metales AlcalinosDocumento6 páginas4 Plantilla de Práctica # 4 Metales AlcalinosMilagro FloresAún no hay calificaciones
- Flores Milagro 20211000691 Practica2 Miercoles1-4 Grupo10Documento8 páginasFlores Milagro 20211000691 Practica2 Miercoles1-4 Grupo10Milagro FloresAún no hay calificaciones
- 1 Plantilla de Práctica # 1 BioseguridadDocumento8 páginas1 Plantilla de Práctica # 1 BioseguridadMilagro FloresAún no hay calificaciones
- Tema 4. Cultura. Páginas 37-46Documento10 páginasTema 4. Cultura. Páginas 37-46Milagro FloresAún no hay calificaciones
- Guia Primer Parcial Virtual 2 TriDocumento3 páginasGuia Primer Parcial Virtual 2 TriMilagro FloresAún no hay calificaciones
- Flores - Yadira - 20211000691 - Práctica1 - Miercoles1-4 - Grupo10Documento6 páginasFlores - Yadira - 20211000691 - Práctica1 - Miercoles1-4 - Grupo10Milagro FloresAún no hay calificaciones
- Ejercicio Pandeo (Madera y Acero)Documento10 páginasEjercicio Pandeo (Madera y Acero)Adrian Lopez RubioAún no hay calificaciones
- Sem1 Sesion2 Presión ViscosidadCDocumento49 páginasSem1 Sesion2 Presión ViscosidadCimprenta movimientos siervosAún no hay calificaciones
- Prueba de Tensión de Una VarillaDocumento9 páginasPrueba de Tensión de Una VarillaHumberto Muñoz100% (1)
- Asfalto MejoradoDocumento50 páginasAsfalto MejoradoDiego Srv100% (1)
- Caracterización Del LatónDocumento8 páginasCaracterización Del LatónVictor AngelAún no hay calificaciones
- SIST - ACT4 - Motor DarlingtonDocumento4 páginasSIST - ACT4 - Motor DarlingtonImelda LeyvaAún no hay calificaciones
- Viscocidad Vs RPMDocumento3 páginasViscocidad Vs RPMCAMILO ANDRES ORTIZ ENCISOAún no hay calificaciones
- Comportamiento de Sistemas Provisionales de Protección de Borde de Polietileno de Alta Densidad Frente A Cargas Estáticas y de ImpactoDocumento15 páginasComportamiento de Sistemas Provisionales de Protección de Borde de Polietileno de Alta Densidad Frente A Cargas Estáticas y de ImpactoJulio Andrés Casal RamosAún no hay calificaciones
- Generadores Mercados - ValanciDocumento16 páginasGeneradores Mercados - ValanciArmando GuillénAún no hay calificaciones
- Problemas FluidosDocumento7 páginasProblemas FluidosAnonymous LwlH9PaSCA100% (3)
- Equipo 1 MP2Documento8 páginasEquipo 1 MP2Soria Valdés Javier SebastianAún no hay calificaciones
- Resistencia de Los Materiales U4 Ep2Documento7 páginasResistencia de Los Materiales U4 Ep2Ivan RobledoAún no hay calificaciones
- Banco de Preguntas Calor ElectricidadDocumento13 páginasBanco de Preguntas Calor ElectricidadJadner Gerardo Meléndez Arista100% (1)
- 3 Capa Límite y Relaciones de Fricción de La CarcasaDocumento21 páginas3 Capa Límite y Relaciones de Fricción de La Carcasafernandoalex16Aún no hay calificaciones
- Principio de Superposicion - Franklin Espinoza - Ing - CivilDocumento27 páginasPrincipio de Superposicion - Franklin Espinoza - Ing - CivilfranklinAún no hay calificaciones
- Practica 7 - Fisica 4 LabDocumento5 páginasPractica 7 - Fisica 4 LabRubén AntonioAún no hay calificaciones
- Syllabus Mecanica de FluidosDocumento5 páginasSyllabus Mecanica de FluidosTati'xMarentesAún no hay calificaciones
- Qué Es El Concreto PoliméricoDocumento3 páginasQué Es El Concreto Poliméricofer100% (1)
- Operaciones de Procesos Unitarios (Syllabus)Documento6 páginasOperaciones de Procesos Unitarios (Syllabus)Fausto Palomino100% (1)
- Óptica 23 - CompletoDocumento17 páginasÓptica 23 - Completolucia valloryAún no hay calificaciones
- Alambre y Fundente Arc. Sum.Documento92 páginasAlambre y Fundente Arc. Sum.Roger RoaAún no hay calificaciones
- Interpretación de Las Características Fundamentales Del Diodo de Potencia, Uso Del DATA SHEET.Documento4 páginasInterpretación de Las Características Fundamentales Del Diodo de Potencia, Uso Del DATA SHEET.SANTIAGO NAJARRO EDINSON HERNANAún no hay calificaciones
- Blast Damage Factor D Hoek - En.esDocumento8 páginasBlast Damage Factor D Hoek - En.esDimitri Wylde YoungAún no hay calificaciones
- Laboratorio N 1 ElectrotecniaDocumento6 páginasLaboratorio N 1 ElectrotecniaPaula PerezAún no hay calificaciones
- Métodos de Prueba Estándar para Propiedades de Flexión de Plásticos No Reforzados y Reforzados y Materiales Aislantes EléctricosDocumento8 páginasMétodos de Prueba Estándar para Propiedades de Flexión de Plásticos No Reforzados y Reforzados y Materiales Aislantes EléctricosJuan Daniel MedinaAún no hay calificaciones
- VA V9 261 S06 Válvula de Mariposa Tipo 22LUG22 Gaer®Documento4 páginasVA V9 261 S06 Válvula de Mariposa Tipo 22LUG22 Gaer®JUAN CARLOS DELGADO MEDINAAún no hay calificaciones
- La Tierra Como Solido ElasticoDocumento12 páginasLa Tierra Como Solido ElasticoRubenCordobaAún no hay calificaciones
- 02P - MODULO Control VoltajeDocumento56 páginas02P - MODULO Control VoltajeAlvaro Julian Fuentes BarreraAún no hay calificaciones
- Deber QuimicaDocumento13 páginasDeber QuimicaRami ParedesAún no hay calificaciones