Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Docsity Fundamentos de Electroquimica 1
Cargado por
Gustavo ParreñoDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Docsity Fundamentos de Electroquimica 1
Cargado por
Gustavo ParreñoCopyright:
Formatos disponibles
fundamentos de
electroquimica
Análisis Elemental
Universidad Autónoma de Baja California (UABC) - Tijuana
1 pag.
Document shared on www.docsity.com
Downloaded by: bryan-a-1 (alexander316pm@gmail.com)
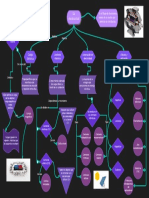
Mapa conceptual de electroquímica
Juan Daniel Burgueño Gonzalez Grupo: 442 |
Rama de la química
que estudia la
Electroquímica
transformación entre la
energía eléáctrica y la
energía química
Principios
Reacciones redox Energía
fisicoquímicos
Celdas
Reacciones de
transferencia
de electrones
Condiciones Potencial de Electríca Química Electrolíticas Galvánicas
pueden ser
estándar celda
Diferencia de
potencial
entre dos
Ecuación de puntos
Nernst Espontáneas No espontáneas
Forma de En las que la energía
Cuando la energía
energía eléctrica procedente que se libera en una
potencial de una fuente reacción redox
1 atm Reductor: Dona contenida en espontánea se puede
externa hace que
Conformadas electrones sustancias usar, para realizar un
tenga lugar una
Nos permite encontrar la por un agente químicas reacción química no trabajo eléctrico.
fem que produce la celda reductor y uno espontánea.
en condiciones no
1M La diferencia de oxidante
estándar en función de la
? E° (potencial estándar
potencial entre los dos Oxidante:
de celda) y de las electrodos de una celda
Recibe
concentraciones de los galvánica proporciona la
reactivos y productos fuerza motriz que electrones Chang, R. C. (2017).Química(12ª ed.).
25°C (expresados en Q) empuja los electrones a D.F, México: Mc Graw Hill.
través del circuito
externo
[1]U. Nacional, L. Maria, I. Vera, L. María,
conocida como and I. Vera, ?G E N E R A L U n i d a d X?: E l
e c t r o q u í m i c a Contenidos temáticos
FEM(Fuerza desarrollados por?:,? no. 03783, 2007.
electromotriz) Formúla
E°celda = ? E° = E°cátodo ? E°ánodo
Document shared on www.docsity.com
Downloaded by: bryan-a-1 (alexander316pm@gmail.com)
También podría gustarte
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Electro Qu Í MicaDocumento3 páginasElectro Qu Í MicaAngieAún no hay calificaciones
- Electroquímica - Página 1Documento1 páginaElectroquímica - Página 1joseagutierrezespinoAún no hay calificaciones
- MapaConceptual Jose RodriguezDocumento1 páginaMapaConceptual Jose RodriguezJose RodriquezAún no hay calificaciones
- Mapa Mental DDocumento6 páginasMapa Mental DDANIELA HUERTA PEREZAún no hay calificaciones
- La Electricidad - Mapa ConceptualDocumento1 páginaLa Electricidad - Mapa ConceptualMoisés LeónAún no hay calificaciones
- Infografía Quimica Juan Guarin Emanuel TarazonaDocumento1 páginaInfografía Quimica Juan Guarin Emanuel Tarazonaandres felipe arias mateusAún no hay calificaciones
- Materiales Dieléctricos y AislamientoDocumento12 páginasMateriales Dieléctricos y AislamientoDaniel GiraldoAún no hay calificaciones
- Mentefacto Conceptual 201424 8775874Documento2 páginasMentefacto Conceptual 201424 8775874Olguita NiñoAún no hay calificaciones
- Mapa ConceptualDocumento4 páginasMapa ConceptualLizeth Berenice Jiménez MorenoAún no hay calificaciones
- Wuolah Free Materiales ElectricosDocumento34 páginasWuolah Free Materiales Electricosmiguelps4codAún no hay calificaciones
- Mapa Conceptual Flechas Naranja Verde RosaDocumento2 páginasMapa Conceptual Flechas Naranja Verde RosaIssac GuillenAún no hay calificaciones
- CuestionarioDocumento3 páginasCuestionarioNicole PorcayoAún no hay calificaciones
- Materiales en La Industria ElectrónicaDocumento7 páginasMateriales en La Industria ElectrónicaMIGUELAún no hay calificaciones
- Metodos Electroquimicos David Lezama ReynaDocumento3 páginasMetodos Electroquimicos David Lezama ReynadavidAún no hay calificaciones
- Mapa Mental Propiedades PeriodicasDocumento1 páginaMapa Mental Propiedades PeriodicasGabriel García BautistaAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualMichelle MartínezAún no hay calificaciones
- Máquinas ElectrostáticasDocumento1 páginaMáquinas ElectrostáticasTheWilloGamerAún no hay calificaciones
- Mapa Conceptual Circuitos ElectricosDocumento2 páginasMapa Conceptual Circuitos ElectricosMoises VazquezAún no hay calificaciones
- S1 TareaDocumento5 páginasS1 Tarearobinson vargasAún no hay calificaciones
- Tema 7 Electricidad y Magnetismo.Documento14 páginasTema 7 Electricidad y Magnetismo.Adrián Garijo TenderoAún no hay calificaciones
- Act 1.6Documento5 páginasAct 1.6Guerrero Murillo Annel Samantha50% (2)
- Leyes De:: Lenz Kirchhoff Faraday Watt OhmDocumento1 páginaLeyes De:: Lenz Kirchhoff Faraday Watt Ohmazzeneth chiAún no hay calificaciones
- Mapas MentalesDocumento4 páginasMapas MentalesEder BalamAún no hay calificaciones
- Almacenamiento de La ElectricidadDocumento1 páginaAlmacenamiento de La ElectricidadpousaniasAún no hay calificaciones
- Unidad 3Documento12 páginasUnidad 3Karla mirell Osorio alcantaraAún no hay calificaciones
- Mapa Conceptual Del Magnetismo 2Documento1 páginaMapa Conceptual Del Magnetismo 2Ibc Jose Joaquin Pardo GallardoAún no hay calificaciones
- EnergiaDocumento16 páginasEnergiamarlenygarcia12Aún no hay calificaciones
- Técnicas ElectroanalíticasDocumento9 páginasTécnicas ElectroanalíticasMaria ColinAún no hay calificaciones
- Mapa Conceptual TermodinamicaDocumento1 páginaMapa Conceptual TermodinamicaDavid Lopez RojasAún no hay calificaciones
- Materiales Piezoeléctricos - KOPDocumento1 páginaMateriales Piezoeléctricos - KOPLeomar Alexis Urcia MostaceroAún no hay calificaciones
- ESPECTROFOTOMETRIADocumento1 páginaESPECTROFOTOMETRIABrayan Steven Cepeda SoraAún no hay calificaciones
- La Naturaleza Electrica de La MateriaDocumento7 páginasLa Naturaleza Electrica de La Materiarotkox eterAún no hay calificaciones
- Propiedades Químicas de Los Elementos Químicos: Carga Nuclear Efectivo Numero de OxidaciónDocumento4 páginasPropiedades Químicas de Los Elementos Químicos: Carga Nuclear Efectivo Numero de OxidaciónJosé Ángel SánchezAún no hay calificaciones
- Mapa CircuitosDocumento4 páginasMapa CircuitosItzel ArandaAún no hay calificaciones
- Mapa ConceptualDocumento2 páginasMapa ConceptualjohannaAún no hay calificaciones
- Semana 5Documento4 páginasSemana 5merlyAún no hay calificaciones
- Infografía Verde Agua Oscuro y Rosa Tipográfica de Las 7 Maravillas de ArgentinaDocumento1 páginaInfografía Verde Agua Oscuro y Rosa Tipográfica de Las 7 Maravillas de ArgentinaVeronica SolarAún no hay calificaciones
- Organizador Visual de La ElectricidadDocumento1 páginaOrganizador Visual de La ElectricidadEricka Emy100% (4)
- Tipos de EnergiaDocumento1 páginaTipos de EnergiaStephanie Cayro prevateAún no hay calificaciones
- ELECTRICIDAD3Documento13 páginasELECTRICIDAD3abuAún no hay calificaciones
- PROPAGACIONDocumento1 páginaPROPAGACIONLuis Angel Martinez EstradaAún no hay calificaciones
- CUESTIONARIO 1 CAPITULO 21 26 de Marzo Del 2021 Revisi N Del Intento PDFDocumento5 páginasCUESTIONARIO 1 CAPITULO 21 26 de Marzo Del 2021 Revisi N Del Intento PDFHijo De la nocheAún no hay calificaciones
- CUESTIONARIO 1 CAPITULO 21 26 de Marzo Del 2021 Revisi N Del Intento PDFDocumento5 páginasCUESTIONARIO 1 CAPITULO 21 26 de Marzo Del 2021 Revisi N Del Intento PDFFabricio FernandezAún no hay calificaciones
- ElectroqumicaDocumento1 páginaElectroqumicaFranklin Teofilo Guillermo MachacuayAún no hay calificaciones
- Electroquimica - Mapa de ConceptosDocumento1 páginaElectroquimica - Mapa de ConceptosedgmundarayAún no hay calificaciones
- Fundamento ConceptualDocumento2 páginasFundamento ConceptualGabriel MontaAún no hay calificaciones
- Definiciones y Mapa ConceptualDocumento3 páginasDefiniciones y Mapa ConceptualMario Castilla RgAún no hay calificaciones
- Sem 7 Ing MatrDocumento34 páginasSem 7 Ing MatrFRANZAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualCampos dominguez Sahara HanaAún no hay calificaciones
- Unidad #5 Sistemas Electroquímicos - Aspectos Termodinámicos 2Documento21 páginasUnidad #5 Sistemas Electroquímicos - Aspectos Termodinámicos 2Mariano SalviAún no hay calificaciones
- Mapa Conceptual de La EnergiaDocumento1 páginaMapa Conceptual de La EnergiaJair GuajalaAún no hay calificaciones
- Propiedades PeriódicasDocumento25 páginasPropiedades PeriódicasGUADALUPE CAROLINA NUÑEZ MAYENAún no hay calificaciones
- QuímicaDocumento1 páginaQuímicaOriana Ramirez100% (2)
- Practica 1 Quino CerdanDocumento11 páginasPractica 1 Quino CerdanAlexis Emiliano Hernandez VazquezAún no hay calificaciones
- Fisica Electrica y Magnetica - 202350 - 02631Documento1 páginaFisica Electrica y Magnetica - 202350 - 02631Daniel JimenezAún no hay calificaciones
- Materiales SemiconductoresDocumento6 páginasMateriales SemiconductoresJohan Francisco Lorenzo GrullonAún no hay calificaciones
- Potencial EspontaneoDocumento2 páginasPotencial EspontaneoSolagne Butron SoriaAún no hay calificaciones
- Mantiene Sistemas de Transmisión de Tipo Mecanico Y EléctricoDocumento3 páginasMantiene Sistemas de Transmisión de Tipo Mecanico Y EléctricoFernando Hernández AnayaAún no hay calificaciones
- Cosechadora Grupo 9Documento46 páginasCosechadora Grupo 9Gustavo ParreñoAún no hay calificaciones
- 9000 Serie Es (c0c)Documento52 páginas9000 Serie Es (c0c)Gustavo ParreñoAún no hay calificaciones
- Trabajo Grupal AvogadroDocumento5 páginasTrabajo Grupal AvogadroGustavo ParreñoAún no hay calificaciones
- Práctica 2 Instalación de Anillos Motor CumminsDocumento6 páginasPráctica 2 Instalación de Anillos Motor CumminsGustavo ParreñoAún no hay calificaciones
- InformeDocumento9 páginasInformeGustavo ParreñoAún no hay calificaciones
- Resumen 2Documento3 páginasResumen 2Gustavo ParreñoAún no hay calificaciones
- Tipos de Sistemas de AlimentaciónDocumento10 páginasTipos de Sistemas de AlimentaciónGustavo ParreñoAún no hay calificaciones
- Fallas de TV Resueltas Por Marca y Modelo Reparacion de TV YoReparo PDFDocumento57 páginasFallas de TV Resueltas Por Marca y Modelo Reparacion de TV YoReparo PDFФранк Моралес100% (1)
- Receptor FMDocumento7 páginasReceptor FMAndrés LeónAún no hay calificaciones
- Evaluacion Riezgos ElectricosDocumento3 páginasEvaluacion Riezgos ElectricosJuan Pablo DuranAún no hay calificaciones
- Problemas Primer Parcial PDFDocumento12 páginasProblemas Primer Parcial PDFberenicezaiAún no hay calificaciones
- Presentación EAC - BFDocumento20 páginasPresentación EAC - BFChristianEstrellaNietoAún no hay calificaciones
- Barras Flexibles y Rigidas de CobreDocumento4 páginasBarras Flexibles y Rigidas de CobreWilliam Steven Morales RodriguezAún no hay calificaciones
- EL SER UNO II - Planeta 333 - Los Guardianes de TeraDocumento248 páginasEL SER UNO II - Planeta 333 - Los Guardianes de Teraronda13100% (4)
- Magnitudes1 090408150350 Phpapp01Documento5 páginasMagnitudes1 090408150350 Phpapp01Sugey Mendoza RivasAún no hay calificaciones
- Boletin Técnico 12 LT Aisladores Parte 1Documento7 páginasBoletin Técnico 12 LT Aisladores Parte 1Rodrigo SegoviaAún no hay calificaciones
- P4 OsciloscopioDocumento55 páginasP4 OsciloscopioAdolfo LopezAún no hay calificaciones
- CIM 6 Short Form Manual SpanishDocumento38 páginasCIM 6 Short Form Manual SpanishCristian Alejandro La Gambino AcevedoAún no hay calificaciones
- Circuitos de Potencia y Transformadores - UnlockedDocumento356 páginasCircuitos de Potencia y Transformadores - UnlockedSabas Laird GonzalezAún no hay calificaciones
- Et 03.359.109.0 - 07.10Documento160 páginasEt 03.359.109.0 - 07.10Gonzalo CNAún no hay calificaciones
- Boletin Potencia 1983 - 2012Documento90 páginasBoletin Potencia 1983 - 2012DiegoGabrielAún no hay calificaciones
- Maquinas ElectricasDocumento403 páginasMaquinas ElectricasAlexander AriasAún no hay calificaciones
- Ciruitos LimitadoresDocumento19 páginasCiruitos LimitadoresIvan Matta DávilaAún no hay calificaciones
- Tarea 4 CE Circuitos de CA Con Diodos - 021635Documento3 páginasTarea 4 CE Circuitos de CA Con Diodos - 021635GUS HdzAún no hay calificaciones
- FotocopiadoraDocumento5 páginasFotocopiadoraKarlitoz MLAún no hay calificaciones
- ProteccionDocumento7 páginasProteccionEdson RaulAún no hay calificaciones
- Is-Syso-01 - Soldadura ElDocumento2 páginasIs-Syso-01 - Soldadura ElIvan PérezAún no hay calificaciones
- Ficha Tecnica Electrodo de TungstenoDocumento1 páginaFicha Tecnica Electrodo de TungstenoRaul SebastiamAún no hay calificaciones
- Pruebas A Transformadores de PotenciaDocumento7 páginasPruebas A Transformadores de PotenciaManuel Jose Nuñez CasangaAún no hay calificaciones
- Informe Final N°3Documento24 páginasInforme Final N°3fieeg4Aún no hay calificaciones
- Horno Eléctrico PDFDocumento23 páginasHorno Eléctrico PDFEster JCAún no hay calificaciones
- Corriente EléctricaDocumento5 páginasCorriente EléctricaWlliansitozaxz CxrxAún no hay calificaciones
- Ficha Técnica Compensador Dinámico FP - V2Documento2 páginasFicha Técnica Compensador Dinámico FP - V2juanetnaAún no hay calificaciones
- Importancia de La Refrigeración en Los AlimentosDocumento5 páginasImportancia de La Refrigeración en Los AlimentosLuis CortezAún no hay calificaciones
- Imforme 02 - 2021 - CHSP - Cic - Supervisi0nDocumento8 páginasImforme 02 - 2021 - CHSP - Cic - Supervisi0nCarlos Humberto Sanchez Palomino0% (1)
- Cuestionario Del Capítulo 1 - Attempt ReviewDocumento7 páginasCuestionario Del Capítulo 1 - Attempt ReviewMaría Jesús Joyanes AlabarceAún no hay calificaciones
- DSE331 Configuration Suite PC Software Manual - En.esDocumento38 páginasDSE331 Configuration Suite PC Software Manual - En.esRichard Chicango100% (3)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- UF0054: APROVISIONAMIENTO DE MATERIAS PRIMAS EN COCINA (HOTR0108)De EverandUF0054: APROVISIONAMIENTO DE MATERIAS PRIMAS EN COCINA (HOTR0108)Aún no hay calificaciones
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- La medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónDe EverandLa medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónCalificación: 3.5 de 5 estrellas3.5/5 (2)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Anatomía del caballo: Guía práctica ilustradaDe EverandAnatomía del caballo: Guía práctica ilustradaCalificación: 4 de 5 estrellas4/5 (9)
- Toma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasDe EverandToma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasAún no hay calificaciones
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Cómo Aprender por tu Cuenta: Los Secretos de los Mejores Autodidáctas para Acelerar tu Aprendizaje sin Depender de los DemásDe EverandCómo Aprender por tu Cuenta: Los Secretos de los Mejores Autodidáctas para Acelerar tu Aprendizaje sin Depender de los DemásCalificación: 4 de 5 estrellas4/5 (10)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Probabilidad y estadística: un enfoque teórico-prácticoDe EverandProbabilidad y estadística: un enfoque teórico-prácticoCalificación: 4 de 5 estrellas4/5 (40)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Las Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónDe EverandLas Enfermedades comienzan y terminan en tu mente: Una guía para la autosanaciónCalificación: 4 de 5 estrellas4/5 (4)