Documentos de Académico
Documentos de Profesional
Documentos de Cultura
CICLO V.química Flexibilizada. Guía 05. César
Cargado por
Cesar Malambo LozanoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
CICLO V.química Flexibilizada. Guía 05. César
Cargado por
Cesar Malambo LozanoCopyright:
Formatos disponibles
MINISTERIO DE EDUCACIÓN NACIONAL
INSTITUCIÓN EDUCATIVA ANTONIO RICAURTE
DANE 118001003152-1 NIT No. 828000298-1
FLORENCIA - CAQUETÁ
TALLER DE HABILITACIÓN GRADO ONCE 2021
Realice los ejercicios de acuerdo a los periodos reprobados. La entrega del taller vale el 50 % de
la Nota y la Evaluación vale el otro 50 %.
PERIODO 1
1. Realice la configuración electrónica del hierro (Z=26) y del cloro (Z=17) y para cada uno de
ellos señale: (a) configuración electrónica general; (b) región o bloque; (c) Periodo; (d)
grupo A o B; (e) configuración electrónica abreviada y (f) dibujo del átomo.
Complete el siguiente cuadro:
Elemento A Z P E N
15P
31
122 51
59 27
200 80
2. Consulte el concepto de las siguientes propiedades periódicas y escriba para cada una de
ellas la ecuación que las identifica:
Afinidad electrónica
Electronegatividad
Radio atómico
Energía o potencial de ionización
Carácter metálico
3. Relacione las dos columnas con diferentes colores:
Grupo funcional Compuesto
Acido hidrácido CaCO3
Oxido básico Ca(OH)2
Acido oxácido CaH2
Oxido ácido CO2
Hidruro CaO
Hidróxido H2CO3
Sal HCl
Carrera 12 entre calle 7° y 8° Barrio Juan XXIII
Teléfono: 435 4050/1369
MINISTERIO DE EDUCACIÓN NACIONAL
INSTITUCIÓN EDUCATIVA ANTONIO RICAURTE
DANE 118001003152-1 NIT No. 828000298-1
FLORENCIA - CAQUETÁ
4. Nombre y forme correctamente las siguientes sales:
Sal Neutra Sal ácida Sal básica
HNO3 + KOH
H2CO3 + Ca(OH)2
H3PO4 + Al(OH)3
5. Balancee las siguientes ecuaciones químicas por el método de tanteo.
a) NH3 + O2 → NO + H2O
b) C4H10 + O2 → CO2 + H2O
6. Balancee las siguientes ecuaciones químicas por el método Redox, mostrando el
procedimiento:
a) K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H2O
b) As2S5 + HNO3 + H2O → H2SO4 + H3AsO4 + NO
SEGUNDO PERIODO
Resuelva los siguientes ejercicios de estequiometria
1. ¿Cuántos gramos de oxigeno gaseoso se necesitan para quemar 10 g de alcohol etílico
C2H5OH?
C2H5OH + O2 → CO2 + H2O
2. Si se colocan 55 g de nitrógeno gaseoso en un recipiente de reacción junto con 55 g de
hidrógeno gaseoso, determina ¿cuál de las dos sustancias es el reactivo limitante y
cuantos gramos de amoniaco se pueden producir en esta reacción?
N2 + H2 → NH3
Resuelva los siguientes ejercicios de gases:
3. Calcula el número de moles de un gas que se encuentran en un recipiente cerrado de 2
litros sometido a una presión de 2,3 atm y a una temperatura de 25°C
4. ¿Cuál es la densidad del nitrógeno gaseoso a 227ºC y 5,00 atm de presión?
Carrera 12 entre calle 7° y 8° Barrio Juan XXIII
Teléfono: 435 4050/1369
MINISTERIO DE EDUCACIÓN NACIONAL
INSTITUCIÓN EDUCATIVA ANTONIO RICAURTE
DANE 118001003152-1 NIT No. 828000298-1
FLORENCIA - CAQUETÁ
TERCER PERIODO
Realice los siguientes ejercicios de Soluciones Químicas:
1. ¿Cuál es la molaridad de una solución que contiene 90 g de glucosa C6H12O6 en 2 litros de
solución?
2. ¿Cuál es la normalidad, N de una solución que contiene 130 g de Al(OH)3 en 5 litros de
solución?
3. Determinar la cantidad en gramos de hidróxido de sodio, NaOH, necesarios para preparar
500 ml de solución 2.75 M.
4.
Realice los siguientes ejercicios de soluciones ácido-base y pH:
5. Complete la siguiente tabla:
[H+] [OH-] pH pOH
1,0X10-3
2,2X10-5
2,3
4,6
8,4
9,3
-8
10,2X10
CUARTO PERIODO
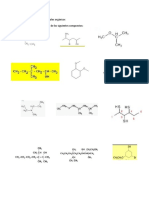
1. Nombre los siguientes compuestos con la nomenclatura IUPAC:
Carrera 12 entre calle 7° y 8° Barrio Juan XXIII
Teléfono: 435 4050/1369
También podría gustarte
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Quimica 2a OportunidadDocumento17 páginasQuimica 2a OportunidadAída de AlonsoAún no hay calificaciones
- Practica 1Documento5 páginasPractica 1juan marconeAún no hay calificaciones
- Boletín SelectividadDocumento41 páginasBoletín Selectividadlunares77775Aún no hay calificaciones
- Química Taller Práctica 2 - Reacciones QuímicasDocumento6 páginasQuímica Taller Práctica 2 - Reacciones QuímicasPedro Rojas PorrasAún no hay calificaciones
- Enumadj 18Documento2 páginasEnumadj 18Juan AAún no hay calificaciones
- Ebau Julio 2018 Solucion para La WebDocumento5 páginasEbau Julio 2018 Solucion para La WebDesireeAún no hay calificaciones
- Química General. Examen Final. Segunda ConvocatoriaDocumento2 páginasQuímica General. Examen Final. Segunda Convocatoriaagustin cabreraAún no hay calificaciones
- Pau Quimica MURCIA 1990-2013Documento59 páginasPau Quimica MURCIA 1990-2013Raul Gonzalez AndreuAún no hay calificaciones
- Pre 2º de Bachillerato: Química: Nombre Del Alumno: Subida de NotaDocumento4 páginasPre 2º de Bachillerato: Química: Nombre Del Alumno: Subida de NotaYaizaAún no hay calificaciones
- Reacciones químicasDocumento3 páginasReacciones químicascalosraAún no hay calificaciones
- Olimpiada Canaria de Química 2022Documento5 páginasOlimpiada Canaria de Química 2022nayara kingsAún no hay calificaciones
- Recuperacion Segundo ExamenDocumento3 páginasRecuperacion Segundo Examenalex sumireAún no hay calificaciones
- Guia de EstudiosDocumento8 páginasGuia de EstudiosCarlos Armando P. ValdezAún no hay calificaciones
- SOLEMNE RECUPERATIVO DQUI 1033 - PautaDocumento7 páginasSOLEMNE RECUPERATIVO DQUI 1033 - PautapedrerojuaquinAún no hay calificaciones
- Examen 2 - EQ2Documento1 páginaExamen 2 - EQ2Axel GonAún no hay calificaciones
- Calculo del calor liberado en la combustión de gas de aguaDocumento3 páginasCalculo del calor liberado en la combustión de gas de aguaxostron33-1Aún no hay calificaciones
- Ad16 019 Port2aOpDocumento14 páginasAd16 019 Port2aOpubaldoAún no hay calificaciones
- Examen Primera Conv 2013-14Documento2 páginasExamen Primera Conv 2013-14NoeliaAún no hay calificaciones
- Seminario de ProblemasDocumento10 páginasSeminario de ProblemasjoseAún no hay calificaciones
- Enumads 11Documento2 páginasEnumads 11JoanCarlesLLopysAún no hay calificaciones
- Modelos de ParcialesDocumento8 páginasModelos de ParcialesLucas SandovarAún no hay calificaciones
- Química 13Documento5 páginasQuímica 13kalaAún no hay calificaciones
- Fundamentos de QuimicaDocumento4 páginasFundamentos de QuimicaAnonymous yBs4pTvcAún no hay calificaciones
- QuimicaDocumento3 páginasQuimicaCristyAún no hay calificaciones
- Taller Refuerzo I Periodo Química - UndéciDocumento4 páginasTaller Refuerzo I Periodo Química - UndéciGloria PuertaAún no hay calificaciones
- Guà - A de Ejercicios 1Documento6 páginasGuà - A de Ejercicios 1MatíasAlexanderArancibiaLagosAún no hay calificaciones
- Taller Guias 4 y 5Documento2 páginasTaller Guias 4 y 5Tian SgAún no hay calificaciones
- Balanceo de reacciones químicasDocumento5 páginasBalanceo de reacciones químicasSharith VanesaAún no hay calificaciones
- Guia TEMA 6 PDFDocumento3 páginasGuia TEMA 6 PDFDiego CubaAún no hay calificaciones
- nivelación quimicaDocumento5 páginasnivelación quimica바퀴햇빛Aún no hay calificaciones
- Prueba de Nivel Academia Osorio Madrid WebDocumento2 páginasPrueba de Nivel Academia Osorio Madrid WebYei X100% (1)
- 2021 3° Parcial Inorg - T2Documento2 páginas2021 3° Parcial Inorg - T2Mirtha CanoAún no hay calificaciones
- sustencaión DecimoDocumento6 páginassustencaión Decimo바퀴햇빛Aún no hay calificaciones
- TEMA 10 ReducidoDocumento10 páginasTEMA 10 ReducidoRodeo CrabAún no hay calificaciones
- Qma-111-U6 Guía de LecturaDocumento4 páginasQma-111-U6 Guía de LecturaiWant PS PludAún no hay calificaciones
- Exercicios 4º Eso FeqDocumento4 páginasExercicios 4º Eso FeqPoluteg XDAún no hay calificaciones
- EXAMEN FINAL QUÍMICA 2Documento1 páginaEXAMEN FINAL QUÍMICA 2Carlos MartinezAún no hay calificaciones
- Exámenes Parciales:: Udb - Química Química GeneralDocumento9 páginasExámenes Parciales:: Udb - Química Química GeneralMati GoldmanAún no hay calificaciones
- Selectivos Universidad de Valencia: Química BachilleratoDocumento94 páginasSelectivos Universidad de Valencia: Química Bachilleratomaord0% (1)
- Taller de Actividades ComplementariasDocumento3 páginasTaller de Actividades ComplementariasDani RAún no hay calificaciones
- Tarea para alumnos (1)Documento21 páginasTarea para alumnos (1)Hania HernándezAún no hay calificaciones
- Prac. Calificada N°4-2022-1Documento3 páginasPrac. Calificada N°4-2022-1StevenAún no hay calificaciones
- Taller Agente R oDocumento6 páginasTaller Agente R oDavid Alexander Gallo PuentesAún no hay calificaciones
- Ejercicos de Practica de Reacciones y ReodxDocumento3 páginasEjercicos de Practica de Reacciones y ReodxMax Blade ErosAún no hay calificaciones
- Señale La Proposición IncorrectaDocumento5 páginasSeñale La Proposición IncorrectaRaul Angel ValdiviaAún no hay calificaciones
- Reacciones QuimicasDocumento5 páginasReacciones QuimicasMalena KesslerAún no hay calificaciones
- Eval SumativaDocumento2 páginasEval SumativaMARGARITA TUÀREZ PÀRRAGAAún no hay calificaciones
- Guía de problemas para ayudantía de Química General y OrgánicaDocumento14 páginasGuía de problemas para ayudantía de Química General y OrgánicaSigrid Amor Anais Muñoz GallegosAún no hay calificaciones
- TAREA N.1 Segundo Período N01Documento3 páginasTAREA N.1 Segundo Período N01Ayala Roberto0% (1)
- Examenes 4Documento19 páginasExamenes 4Juan ReynosoAún no hay calificaciones
- EXAMEN PRENACIONAL XXIV Olimpiada NacionDocumento10 páginasEXAMEN PRENACIONAL XXIV Olimpiada NacionRovelAún no hay calificaciones
- Química EVAU Reserva 2 2011Documento1 páginaQuímica EVAU Reserva 2 2011patriciadfrancoAún no hay calificaciones
- Enumadj 16Documento2 páginasEnumadj 16Juan AAún no hay calificaciones
- Examen FQ 3ESODocumento2 páginasExamen FQ 3ESOFernando Mateo de PablosAún no hay calificaciones
- Q1 Pa3 2021-0 FinalDocumento3 páginasQ1 Pa3 2021-0 FinalLuis Angel Calderon CordovaAún no hay calificaciones
- Química S2 H3Documento5 páginasQuímica S2 H3Lozano Cubas IvancithoAún no hay calificaciones
- 04 Examen FyQ2eso T4 Los Cambios Fisicos y Quimicos 1920 PRÃ CTICADocumento2 páginas04 Examen FyQ2eso T4 Los Cambios Fisicos y Quimicos 1920 PRÃ CTICAÓscar Arranz MancillaAún no hay calificaciones
- Guía de laboratorio de mecánica de fluidosDe EverandGuía de laboratorio de mecánica de fluidosAún no hay calificaciones
- CICLO VI-3.Ciencias Naturales Guía 06 CésarDocumento6 páginasCICLO VI-3.Ciencias Naturales Guía 06 CésarCesar Malambo LozanoAún no hay calificaciones
- CICLO V.química. Guía 02. CésarDocumento5 páginasCICLO V.química. Guía 02. CésarCesar Malambo LozanoAún no hay calificaciones
- CICLO IV - Ciencias Naturales-Ética Guía 02 César y JaimeDocumento5 páginasCICLO IV - Ciencias Naturales-Ética Guía 02 César y JaimeCesar Malambo LozanoAún no hay calificaciones
- CICLO V.química. Guía 04. CésarDocumento6 páginasCICLO V.química. Guía 04. CésarCesar Malambo LozanoAún no hay calificaciones
- CICLO V.química. Guía 03. CésarDocumento5 páginasCICLO V.química. Guía 03. CésarCesar Malambo LozanoAún no hay calificaciones
- CICLO IV - Ciencias Naturales-Ética Guía 03 César-Lilian Carina y VanessaDocumento6 páginasCICLO IV - Ciencias Naturales-Ética Guía 03 César-Lilian Carina y VanessaCesar Malambo LozanoAún no hay calificaciones
- CICLO IV - Ciencias Naturales-Ética Guía 05 César-Ginna y VanessaDocumento10 páginasCICLO IV - Ciencias Naturales-Ética Guía 05 César-Ginna y VanessaCesar Malambo LozanoAún no hay calificaciones
- CICLO III - Ciencias Naturales-Etica Guía de Nivelación César y JaimeDocumento2 páginasCICLO III - Ciencias Naturales-Etica Guía de Nivelación César y JaimeCesar Malambo LozanoAún no hay calificaciones
- CICLO III - Ciencias Naturales-Etica Guía 04 César y JaimeDocumento6 páginasCICLO III - Ciencias Naturales-Etica Guía 04 César y JaimeCesar Malambo LozanoAún no hay calificaciones
- CICLO III - Ciencias Naturales-Etica Guía 03 César y JaimeDocumento6 páginasCICLO III - Ciencias Naturales-Etica Guía 03 César y JaimeCesar Malambo LozanoAún no hay calificaciones
- CICLO III - Ciencias Naturales-Etica Guía 06 César y JaimeDocumento5 páginasCICLO III - Ciencias Naturales-Etica Guía 06 César y JaimeCesar Malambo LozanoAún no hay calificaciones
- CICLO III - Ciencias Naturales Guía 07 CésarDocumento5 páginasCICLO III - Ciencias Naturales Guía 07 CésarCesar Malambo LozanoAún no hay calificaciones
- CICLO IV - Ciencias Naturales-Ética Guía 04 César-Ginna y VanessaDocumento6 páginasCICLO IV - Ciencias Naturales-Ética Guía 04 César-Ginna y VanessaCesar Malambo LozanoAún no hay calificaciones
- Examen de Grupos Funcionales Orgánicos - 2019Documento2 páginasExamen de Grupos Funcionales Orgánicos - 2019Cesar Malambo LozanoAún no hay calificaciones
- Taller de Sistema Endocrino - 2019Documento2 páginasTaller de Sistema Endocrino - 2019Cesar Malambo LozanoAún no hay calificaciones
- Examen de Grupos Funcionales Orgánicos - 2019Documento2 páginasExamen de Grupos Funcionales Orgánicos - 2019Cesar Malambo LozanoAún no hay calificaciones
- CICLO III - Ciencias Naturales-Etica Guía 05 César y JaimeDocumento5 páginasCICLO III - Ciencias Naturales-Etica Guía 05 César y JaimeCesar Malambo LozanoAún no hay calificaciones
- CICLO VI-3.Ciencias Naturales Guía 06 CésarDocumento1 páginaCICLO VI-3.Ciencias Naturales Guía 06 CésarCesar Malambo LozanoAún no hay calificaciones
- CICLO III - Ciencias Naturales Guía 07 CésarDocumento5 páginasCICLO III - Ciencias Naturales Guía 07 CésarCesar Malambo LozanoAún no hay calificaciones
- Lab8 Sensores UltimoDocumento24 páginasLab8 Sensores UltimoGwarguif Brusce Anthony Diaz EguizabalAún no hay calificaciones
- BecDocumento25 páginasBecJosé Raul Suárez De La RosaAún no hay calificaciones
- HISTORIA DE La QuímicaDocumento4 páginasHISTORIA DE La Químicakevyn230Aún no hay calificaciones
- Laboratorio 2Documento6 páginasLaboratorio 2dddddAún no hay calificaciones
- Resumen Química IIDocumento151 páginasResumen Química IIBautii PincoAún no hay calificaciones
- Mecanismos de Transferencia en MatlabDocumento25 páginasMecanismos de Transferencia en Matlabana0% (1)
- Procesos de Elaboracion de Jabon y DetergentesDocumento4 páginasProcesos de Elaboracion de Jabon y DetergentesCesar CalzadillaAún no hay calificaciones
- Arm Odafin IloDocumento17 páginasArm Odafin Ilomaria__luceroAún no hay calificaciones
- Identificación de Fibras Por El Método de La LlamaDocumento10 páginasIdentificación de Fibras Por El Método de La LlamaAndre Zuñiga CamposAún no hay calificaciones
- NormasTécnicasAguaPotableDocumento87 páginasNormasTécnicasAguaPotableDaniel Valdez Gonzalez100% (1)
- Clase 10 BalanceDocumento26 páginasClase 10 BalanceToteB.P-h100% (1)
- SDS Hidroxido de Calcio ESTABILICALDocumento9 páginasSDS Hidroxido de Calcio ESTABILICALlaserminorteAún no hay calificaciones
- Practica Nº1 Mediciones y DensidadDocumento6 páginasPractica Nº1 Mediciones y Densidadraul rocha mejiaAún no hay calificaciones
- Ensayo 08 - LimitesDocumento16 páginasEnsayo 08 - Limitesﺥﻁﺱ ﻝﻥﻡﻙAún no hay calificaciones
- Servicio de agua y saneamiento en PillonaDocumento57 páginasServicio de agua y saneamiento en PillonaDarwin PerezAún no hay calificaciones
- Clase 1.Documento48 páginasClase 1.MarianoPingusChavezAún no hay calificaciones
- Sustento de Nota 91Documento7 páginasSustento de Nota 91Rosa Stefany MAAún no hay calificaciones
- Wire Pol FlexDocumento2 páginasWire Pol FlexacarisimovicAún no hay calificaciones
- Bomba de FuelleDocumento14 páginasBomba de FuelleEinnis DavilaAún no hay calificaciones
- HDS Urb Pirenat Atver 01Documento8 páginasHDS Urb Pirenat Atver 01Operaciones BendorfAún no hay calificaciones
- Quemaduras solares y fotoprotecciónDocumento58 páginasQuemaduras solares y fotoprotecciónalejandroesco100% (2)
- TP CartucheriaDocumento5 páginasTP CartucheriaGabriela CarrizoAún no hay calificaciones
- Cajas modulares CEMAR IP54-IK10Documento4 páginasCajas modulares CEMAR IP54-IK10Marcos AneivaAún no hay calificaciones
- Ensayo de Tracción Aleación de CobreDocumento11 páginasEnsayo de Tracción Aleación de CobreLissethAún no hay calificaciones
- Conferencia 1 Unidad 1 Química Orgánica 2020Documento40 páginasConferencia 1 Unidad 1 Química Orgánica 2020Jossenka Lisbeth Pin TomaloAún no hay calificaciones
- Listado de Medicamentos de Venta Libre Otc 12-06-2018Documento38 páginasListado de Medicamentos de Venta Libre Otc 12-06-2018ANDRESAún no hay calificaciones
- Leyes Ponderales 7Documento4 páginasLeyes Ponderales 7Irene MercadoAún no hay calificaciones
- Diagnostico de Sifilis y RPRDocumento57 páginasDiagnostico de Sifilis y RPRRobert Caballero BardalesAún no hay calificaciones
- Nitrobenceno ProyectoDocumento8 páginasNitrobenceno ProyectoLorenaRamirezParraAún no hay calificaciones