0% encontró este documento útil (0 votos)
264 vistas10 páginasEstructura de Lewis
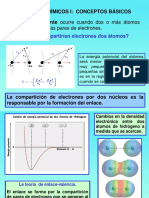
1) La estructura de Lewis describe la distribución de electrones en átomos y moléculas mediante el uso de puntos y líneas. 2) Las estructuras de Lewis muestran cómo los átomos comparten electrones para alcanzar la configuración de gas noble y formar enlaces covalentes. 3) En algunas moléculas como O3 y benceno, la estructura de Lewis no describe correctamente la distribución electrónica, por lo que se utiliza la teoría de resonancia para explicarla.
Cargado por
Cristian David Laporte CabreraDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
264 vistas10 páginasEstructura de Lewis
1) La estructura de Lewis describe la distribución de electrones en átomos y moléculas mediante el uso de puntos y líneas. 2) Las estructuras de Lewis muestran cómo los átomos comparten electrones para alcanzar la configuración de gas noble y formar enlaces covalentes. 3) En algunas moléculas como O3 y benceno, la estructura de Lewis no describe correctamente la distribución electrónica, por lo que se utiliza la teoría de resonancia para explicarla.
Cargado por
Cristian David Laporte CabreraDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd