Documentos de Académico
Documentos de Profesional
Documentos de Cultura
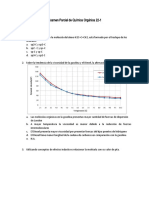
Q Clase7 UNT Reacciones Químicas
Cargado por
Edison PalaciosTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Q Clase7 UNT Reacciones Químicas
Cargado por
Edison PalaciosCopyright:
Formatos disponibles
QUÍMICA
Reacciones químicas
DESARROLLO
DESARROLLO DEL
DEL TEMA
TEMA
Son transformaciones donde una o más sustancias iniciales llamadas reactantes experimentan choques
efectivos entre sí, generando ruptura de enlaces químicos y produciéndose formación de nuevos
enlaces químicos. En consecuencia, la formación de nuevas sustancias, denominadas productos, con
propiedades distintas al de los reactantes.
Ecuación Química
Es la representación simbólica de una reacción química, donde para las sustancias reactantes y
productos se indican sus respectivos símbolos o fórmulas, así como también el estado físico y alguna
característica experimental de la reacción química.
2Na(s) + 2H2O(l) → 2NaOH(ac) + 1H2(g)
14444244443 1444442444443
Reactantes Productos
CLASIFICACIÓN DE LAS REACCIONES QUÍMICAS
1. Por la forma como se originan los productos
A) REACCIONES DE SÍNTESIS O ADICIÓN
Son aquéllas donde, a partir de dos o más sustancias reactantes, se obtiene un solo producto.
A + B + ... → P
Ejemplos:
N2 + 3H2 → 2NH3 2H2 + O2 → 2H2O
2Ca + O2 → 2CaO MgO + H2O → Mg(OH)2
B) REACCIONES DE DESCOMPOSICIÓN
Son aquéllas donde, a partir de una sola sustancia reactante, se obtienen dos o más productos.
UNT REGULAR 2021-III 1 QUÍMICA | 7
REACCIONES QUÍMICAS
R → D + E + ...
Ejemplos:
∆
2CuO(s) 2Cu(s) + O2(g): Pirólisis
Luz
2H2O2(l) 2H2O(l) + O2(g): Fotólisis
C.E.
2NaCl(l) 2Na(l) + Cl2(g) : Electrólisis
C) REACCIÓN DE SUSTITUCIÓN O DESPLAZAMIENTO SIMPLE
Es aquella donde un elemento de mayor reactividad desplaza a otro de menor
reactividad de su compuesto.
A + BC AC + B
Nota:
– Los metales más reactivos son los alcalinos y alcalinotérreos.
– Los no metales más reactivos son los halógenos.
Ejemplos:
Zn + H2SO4 → ZnSO4 Fe + 2HCl → FeCl2 + H2
Ca + 2AgNO3 → Ca(NO3)2 + 2Ag Cl2 + 2NaBr → 2NaCl + Br2
D) REACCIÓN DE SUSTITUCIÓN DOBLE O METÁTESIS
Es aquélla donde se produce un intercambio atómico entre dos compuestos
químicos según la afinidad química que poseen.
AB + CD AD + CB
Ejemplos:
NaCl + AgNO3 → NaNO3 + AgCl BaCl2 + H2SO4 → BaSO4 + 2HCl
CuO + H2SO4 → CuSO4 + H2O HCl + NaOH → NaCI + H2O
2. Reacciones químicas térmicas
A) REACCIÓN EXOTÉRMICA
Es aquélla que produce desprendimiento de energía.
Ejemplos:
C(s) + O2(g) → CO2(g) + 94 kcal/mol
C6H12O6(s) + 6O2(g) → 6CO2 + 6H2O + 2801KJ/mol
N2 + 3H2 → 2NH3 + 22kcal/mol
UNT REGULAR 2021-III 2 QUÍMICA | 7
REACCIONES QUÍMICAS
B) REACCIÓN ENDOTÉRMICA
Es aquélla que absorbe energía para formar los productos.
Ejemplos:
CaCO3(s) + 177,8 KJ/mol → CaO(s) + CO2(g)
N2(g) + O2(g) + 8kcal/mol → 2NO(g)
CO2(g) + 393,5 KJ/mol → C(s) + O2(g)
3. Reacciones de combustión
Son aquéllas que se producen por la interacción de un combustible compuesto or-
gánico) con un comburente (oxígeno). Son reacciones exotérmicas; liberan energía
en forma de luz y calor.
A) COMBUSTIÓN COMPLETA
Se produce cuando hay exceso de oxígeno.
Combustible + O2 → CO2 + H2O + Calor
Ejemplos:
C3H8 + 5O2 → 3CO2 + 4H2O C2H5OH + 3O2 → 2CO2 + 3H2O
B) COMBUSTIÓN INCOMPLETA
Se produce cuando hay poco oxígeno.
Combustible + O2 → CO + H2O
Combustible + O2 → C + H2O
Ejemplos:
2C3H8 + 7O2 → 6CO + 8H2O 2CH4 + 3O2 → 2CO + 4H2O
REACCIONES REDOX
Son aquellas reacciones donde se produce transferencia de electrones, la cual provoca
cambio del estado de oxidación de algunos elementos que participan en la reacción.
La terminología usada en las reacciones REDOX se resume en el siguiente cuadro.
REDOX
REDUCCIÓN OXIDACIÓN
Ganancia de e– Perdida de e–
Disminuye el E.O Aumenta el E.O
Agente Oxidante A.O Agente Reductor A.R
Transferencia de e–
QUÍMICA | 7 3 UNT REGULAR 2021-III
REACCIONES QUÍMICAS
Ejemplo:
Oxidación
Reducción
0 +1 0 +2
Ca + H2SO4 → H2 + CaSO4
Agente Agente Forma Forma
Reductor Oxidante Reducida Oxidada
Balanceo de ecuaciones químicas
Es el proceso que consiste en igualar el número de átomos de cada elemento químico
en ambos lados de la ecuación química, cumpliendo la ley fundamental de las reacciones
químicas que es la ley de conservación de la masa.
1. MÉTODO DE TANTEO
Aplicable a ecuaciones pequeñas y/o sencillas.
Secuencia de balanceo
ORDEN 1er 2do 3er 4to
ELEMENTOS Metal No metal H O
Ejemplo:
Balancear la siguiente ecuación química:
H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
Balanceamos en Ca: H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + H2O
Luego el P: 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + H2O
Balanceamos el H: 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
Finalmente se verifica el O.
2. MÉTODO REDOX
Aplicable a reacciones del tipo REDOX. Consta de los siguientes pasos:
A) Se determina el estado de oxidación de cada elemento.
B) Separar las semirreacciones de oxidación y reducción.
C) Se efectúa el balance atómico de cada semirreacción.
D) Se efectúa el balance de cargas eléctricas en cada semirreacción, sumando o
restando electrones.
E) Igualar los electrones ganados y perdidos, y sumar miembro a miembro las
semirreacciones.
UNT REGULAR 2021-III 4 QUÍMICA | 7
REACCIONES QUÍMICAS
F) Las reacciones obtenidas se reemplazan en la ecuación original, y el resto se
balancea por el método de tanteo.
Ejemplos:
Balancear la siguiente ecuación:
Reducción Oxidación
+5 –2 +2 0
HNO3 + H2S → NO + S + H2O
Reducción: N+5 + 3e– → Ni+2 } . 2
Oxidación: N–2 – 2e– → S0 } . 3
Sumando de las semirreacciones:
2N+5 + 3N–2 → 2N+2 + 3S0
Reemplazando en la ecuación original:
2HNO3 + 3H2S → 2NO + 3S + 4H2O
Balancear las siguientes ecuaciones:
A. MÉTODO DEL TANTEO
1. C2H2 + O2 CO2 + H2O
2. ZnCO3 + HNO3 Zn(NO3)2 + CO2 + H2O
3. BaS + H2O2 BaSO4 + H2O
4. PbCO3 + HCl PbCl2 + CO2 + H2O
5. H2S + H2SO3 S + H2O
B. MÉTODO REDOX
1. KMnO4 + H2SO4 + H2O2 MnSO4 + O2 + H2O + K2SO4
2. KMnO4 + HCI MnCl2 + Cl2 + H2O + KCl
3. Cu + HNO3 Cu(NO3)2 + NO2 + H2O
4. CuSO4 + Kl Cul2 + I2 + K2SO4
5. Kl + H2O2 + H2SO4 I2 + K2SO4 + H2O
QUÍMICA | 7 5 UNT REGULAR 2021-III
REACCIONES QUÍMICAS
EJERCICIOS DE CLASE
NIVEL 1 D) Cul(ac) ⇒ Cu(s) + Cul2(ac)
1. ¿Qué analogía es incorrecta? E) NaHCO3(s) ⇒ Na2CO3(s) + CO2(g) +
A) NH4l + Cl2 ⇒ NH4Cl + l2: desplazamiento H2O(liq)
B) CrCl3 + AgNO3 ⇒ Cr(NO3)3 + AgCl:
metátesis NIVEL 2
C) AgNO3 ⇒ Ag + NO2 + O2: despropor- 5. En la reacción: CO + O2 → CO2 el número
ción de oxidación del carbono cambia de:
D) Al + C ⇒ Al4C3: combinación A) +2a + 1 B) +4a + 1
E) MgBr2 + AgNO3 ⇒ Mg(NO3)2 + AgBr: C) +2a + 4 D) +4a + 2
doble desplazamiento E) N.A.
2. Identifique una reacción de doble despla- 6. En la reacción:
zamiento: HNO3 + Ag → AgNO3 + NO
A) Mg(s) + O2(g) ⇒ MgO(s) El número de oxidación del nitrógeno cam-
B) Mg(s) + N2(g) ⇒ Mg3N2(s) bia de:
C) MnO2(s) + Al ⇒ Al2O3(s) + Mn(s) A) +2a + 1 B) +2a + 5
D) C6H6O6(s) + O2(g) ⇒ CO2(s) + H2O(liq) C) +4a + 1 D) +5a + 4
E) BaCl2(ac) + (CH4)2CO3(ac) ⇒ BaCO3(s) E) +5a + 2
+ NH4Cl(ac)
7. Señale el agente oxidante en la reacción:
3. ¿Qué analogía es incorrecta? P + H2SO4 → H3PO4 + SO2 + H2O
A) KOH (ac) + CO 2(g) ⇒ K 2 CO 3(ac) + A) P B) H2SO4 C) H3PO4
H2O(liq): reacción de matátesis D) SO2 E) H2O
B) Cl2(g) + Kl(ac) ⇒ KCl(ac) + l2(ac): reac-
ción de desplazamiento 8. Señale la forma oxidada en la reacción:
C) Al(OH) 3(s) + HCl (ac) ⇒ AlCl 3(ac) + HNO3 + H2S → NO + S + H2O
H2O(liq): reacción de neutralización A) HNO3 B) H2S C) NO
D) KHCO 3(s) ⇒ K 2 CO 3(s) + CO 2(g) + D) S E) H2O
H2O(liq): reacción de desproporción
E) Cd(s) + H2SO4(ac) ⇒ CdSO4(ac) + H2(g): 9. En la reacción: Fe + CuCl2 → FeCl2 + Cu.
reacción de simple desplazamiento ¿Cuál es la sustancia que ha sido oxidada?
A) Fe B) CuCl2 C) FeCl2
4. ¿Cuál de las siguientes reacciones se puede D) Cu E) N.A
clasificar como una reacción de descompo-
sición y a la vez como una desproporción? 10. En la siguiente ecuación:
A) HgO(s) ⇒ Hg(liq) + O2(g) Nal + NalO3 + H2SO4 → l2 + Na2SO4 + H2O
B) KClO3(s) ⇒ KCl(s) + O2(g) A) El sodio se reduce.
C) CaSO4 . 2H2O(s) ⇒ CaSO4(s) + H2O(liq) B) El azufre se oxida.
UNT REGULAR 2021-III 6 QUÍMICA | 7
REACCIONES QUÍMICAS
C) El yodo se oxida. 13. Indicar el número de oxidación del yodo en
D) El yodo se reduce. el peryodato plúmbico.
E) C y D. A) +1 B) +3 C) +5
D) +7 E) +4
11. Completar la siguiente semi reacción in-
dicando el número de electrones que se 14. El número de oxidación del nitrógeno, del
transfieren. cloro y cromo en los componentes es:
P4 → P–3 Ca3N2 H4Cl2O9 Ag2Cr2O7
–
A) 12e B) 3 C) 6 A) 1–, 5+, 6+ B) 3–, 7+, 3+
D) 8 E) 4 C) 3+, 3+, 5+ D) 2+, 5+, 6+
E) 3–, 7+, 6+
NIVEL 3
12. ¿Cuál es el agente oxidante en la siguiente 15. En la síntesis de Haber–Bosch:
reacción? N2 + H2 → NH3
Al + CuSO4 → Al2(SO4)3 + Cu ¿Qué proposición es correcta?
A) Al A) El nitrógeno se oxida.
B) CuSO4 B) El hidrógeno se reduce.
C) Al2(SO4)3 C) El hidrógeno es dismutante.
D) Cu D) El nitrógeno se reduce.
E) Al y Cu E) No hay transferencia de electrones.
QUÍMICA | 7 7 UNT REGULAR 2021-III
También podría gustarte
- Química 5to Secundaria 17Documento25 páginasQuímica 5to Secundaria 17Metade Marvel A ChAún no hay calificaciones
- DESIGUALDADESDocumento2 páginasDESIGUALDADESALEJANDRINAAún no hay calificaciones
- 10 Compuestos Aromaticos IIDocumento17 páginas10 Compuestos Aromaticos IIRuth Castillo LopezAún no hay calificaciones
- Problemas de química propuestosDocumento2 páginasProblemas de química propuestosJans Cabrejos100% (1)
- 1 TemperaturaDocumento53 páginas1 TemperaturaErickBermudezAún no hay calificaciones
- Método RedoxDocumento2 páginasMétodo RedoxAndrés AhumadaAún no hay calificaciones
- Sumador CompletoDocumento7 páginasSumador CompletoIrving VazMarAún no hay calificaciones
- Trabajo Encargado de MatematicaDocumento14 páginasTrabajo Encargado de MatematicaPaolo PintoAún no hay calificaciones
- Capitulo 01 y 02 (Conceptos Basicos y Soluciones)Documento19 páginasCapitulo 01 y 02 (Conceptos Basicos y Soluciones)Luis GuaytaAún no hay calificaciones
- PF - GRUPO 3 - Delgado Farro Javier ManuelDocumento44 páginasPF - GRUPO 3 - Delgado Farro Javier ManuelJair Palacios Rodas100% (1)
- Examen Parcial de Química Orgánica 22-1Documento6 páginasExamen Parcial de Química Orgánica 22-1Alexia :3 PalominoAún no hay calificaciones
- TAREADocumento9 páginasTAREAANTON YORMAN APAZA OCHOAAún no hay calificaciones
- EcuacionRecta - Semana 1.1Documento23 páginasEcuacionRecta - Semana 1.1Martin HG0% (1)
- Actividad 3 ApaDocumento16 páginasActividad 3 ApaRenzoAún no hay calificaciones
- Hoja Taller Grupal #2 Átomo y Enlace QuímicoDocumento6 páginasHoja Taller Grupal #2 Átomo y Enlace QuímicoEdwyn Alexander Calvay GomezAún no hay calificaciones
- Trabajo de MatlabDocumento24 páginasTrabajo de MatlabPercy Sandoval SantistebanAún no hay calificaciones
- Matriz Leds 3 X 3 Controlado Por ARDUINO UNODocumento2 páginasMatriz Leds 3 X 3 Controlado Por ARDUINO UNOForumsur ArgentinaAún no hay calificaciones
- Documento 1Documento3 páginasDocumento 1Alejandro Quintanilla100% (1)
- Desarrollo Taller 1Documento8 páginasDesarrollo Taller 1yuly100% (1)
- Laboratorio 4 - Grupo AvantiDocumento9 páginasLaboratorio 4 - Grupo AvantiSamuel VillamilAún no hay calificaciones
- Repaso Equilibrio QuímicoDocumento2 páginasRepaso Equilibrio QuímicoElMaharajaAún no hay calificaciones
- Examen Parcial Mecatronica Coronado SalvadorDocumento5 páginasExamen Parcial Mecatronica Coronado SalvadorKevin Coronado SalvadorAún no hay calificaciones
- GUIA01Documento18 páginasGUIA01Miguel Angel CIAún no hay calificaciones
- Ejercicios de La Clase 2 - Programación para TodosDocumento12 páginasEjercicios de La Clase 2 - Programación para TodosWilder AcuñaAún no hay calificaciones
- Dominio y rango de funciones realesDocumento2 páginasDominio y rango de funciones realesVTROCEL100% (1)
- Problemas - Parte IIDocumento6 páginasProblemas - Parte IIDiego MqAún no hay calificaciones
- Reporte #7 - EstequiometríaDocumento2 páginasReporte #7 - EstequiometríaHuaman Ramos IsamarAún no hay calificaciones
- Introducción a las TIC - Primer Examen ParcialDocumento2 páginasIntroducción a las TIC - Primer Examen ParcialAlejandro EscobarAún no hay calificaciones
- EjerciciosDocumento3 páginasEjerciciosWendy TorresAún no hay calificaciones
- Algebra Ejercicios 100Documento4 páginasAlgebra Ejercicios 100cristhianAún no hay calificaciones
- Derivadas de Funciones Inversas Arc Seno y Arc Coseno-InformeDocumento11 páginasDerivadas de Funciones Inversas Arc Seno y Arc Coseno-InformeJose AndresAún no hay calificaciones
- Resta: IntroduccionDocumento10 páginasResta: IntroduccionEduardo ReyesAún no hay calificaciones
- Cálculos de masa molecular, moles y porcentaje de elementos en compuestos químicosDocumento4 páginasCálculos de masa molecular, moles y porcentaje de elementos en compuestos químicosRamón Almada100% (1)
- Estequeometria 1bDocumento2 páginasEstequeometria 1bSoraya Marín100% (2)
- Práctica Calificada N°1 MATEMATICADocumento2 páginasPráctica Calificada N°1 MATEMATICAYossi Gamonal CoronelAún no hay calificaciones
- Lab 4Documento16 páginasLab 4Cristopher Barra EspinozaAún no hay calificaciones
- 381 400Documento23 páginas381 400Angeler BrennanAún no hay calificaciones
- Jaferpin - TALLER DE TERMODINÁMICADocumento12 páginasJaferpin - TALLER DE TERMODINÁMICAJhonn Daniel Alvarado Quintana0% (2)
- 19 TUTORIA CAPITULO 11 ESTEQUIOMETRIA II ParteDocumento7 páginas19 TUTORIA CAPITULO 11 ESTEQUIOMETRIA II ParteStephanie100% (1)
- Fórmula longitud arco curva polarDocumento1 páginaFórmula longitud arco curva polarEvelign Antonieta Mateo Carreras100% (1)
- Derivadas ParcialesDocumento15 páginasDerivadas ParcialesJaime MedinaAún no hay calificaciones
- Deber 3Documento4 páginasDeber 3Maritza ReyesAún no hay calificaciones
- SolubilidadQuimicaIIDocumento4 páginasSolubilidadQuimicaIIMariel RosadoAún no hay calificaciones
- Optica ResueltosDocumento71 páginasOptica Resueltosjesi_lovejoyAún no hay calificaciones
- Funal Sesion 06Documento15 páginasFunal Sesion 06Jesús SJ Rivera CAún no hay calificaciones
- Función ÓxidosDocumento10 páginasFunción ÓxidosJorge Luis Valdez CondeñaAún no hay calificaciones
- TALLER ATOMO Y NUM. CUANTICOS APLICACION 10-3 Daniel MeloDocumento2 páginasTALLER ATOMO Y NUM. CUANTICOS APLICACION 10-3 Daniel Melodaniel meloAún no hay calificaciones
- Ejercicios sucesiones numéricas límitesDocumento55 páginasEjercicios sucesiones numéricas límitesMario Enrique Martinez ArismendiAún no hay calificaciones
- Estadistica Trabajo de JesusDocumento3 páginasEstadistica Trabajo de JesusAnonymous RuxFpFAún no hay calificaciones
- Equilibrios Ácido-BaseDocumento11 páginasEquilibrios Ácido-BaseEfrén SagastaAún no hay calificaciones
- Tarea #13Documento1 páginaTarea #13Yosman Paz MatosAún no hay calificaciones
- 08 Conservacion Del Momento LinealDocumento7 páginas08 Conservacion Del Momento Linealホアン ホアキンAún no hay calificaciones
- Trabajo Final de Punto de EquilibrioDocumento6 páginasTrabajo Final de Punto de EquilibrioJose Daniels WalkerAún no hay calificaciones
- X. Reacciones QuímicasDocumento58 páginasX. Reacciones QuímicasMILLA FLORYAN0% (1)
- Pitagoras Clase de Química-08 (Reacciones Químicas Ii)Documento28 páginasPitagoras Clase de Química-08 (Reacciones Químicas Ii)Vale OliveraAún no hay calificaciones
- PT QUÍMICA SEM-04 SESIÓN-7a 2022-2Documento38 páginasPT QUÍMICA SEM-04 SESIÓN-7a 2022-2Alexandra EuribeAún no hay calificaciones
- Reacciones Quimicas y Estequiometria 2017-IIDocumento60 páginasReacciones Quimicas y Estequiometria 2017-IIbrayerAún no hay calificaciones
- SEMANA 11 y 12 Reacciones Quimicas 1Documento23 páginasSEMANA 11 y 12 Reacciones Quimicas 1anon_455104866Aún no hay calificaciones
- SEMANA 5. Reacciones QuimicasDocumento51 páginasSEMANA 5. Reacciones QuimicasRony CarrilloAún no hay calificaciones
- Recristalización ácido benzoicoDocumento3 páginasRecristalización ácido benzoicoEdison PalaciosAún no hay calificaciones
- Solucion en Series de PotenciasDocumento38 páginasSolucion en Series de PotenciasEdison PalaciosAún no hay calificaciones
- Refractometria FICO 2Documento28 páginasRefractometria FICO 2Edison PalaciosAún no hay calificaciones
- Parcial CuantiDocumento6 páginasParcial CuantiEdison PalaciosAún no hay calificaciones
- SM62-Leyva-Música, Chicha, Mito e Identidad PopularDocumento165 páginasSM62-Leyva-Música, Chicha, Mito e Identidad PopularÁngel Flores Benavides100% (1)
- Enlace QuímicoDocumento59 páginasEnlace QuímicoEdison PalaciosAún no hay calificaciones
- Diagrama de FlujoDocumento1 páginaDiagrama de FlujoEdison PalaciosAún no hay calificaciones
- Quimica Sem 9-10Documento2 páginasQuimica Sem 9-10Edison PalaciosAún no hay calificaciones
- Enlace QuímicoDocumento59 páginasEnlace QuímicoEdison PalaciosAún no hay calificaciones
- Características y especificaciones técnicas de las materias primas algodónDocumento6 páginasCaracterísticas y especificaciones técnicas de las materias primas algodónkathAstridAún no hay calificaciones
- Transistor de Efecto de Campo Con Nanotubo SWDocumento71 páginasTransistor de Efecto de Campo Con Nanotubo SWRosalino Leonides Martinez MarquezAún no hay calificaciones
- Modelado multiescalaDocumento43 páginasModelado multiescalaMailenthAún no hay calificaciones
- Central de EsterilizacionDocumento26 páginasCentral de EsterilizacionJessi Chapilliquen100% (1)
- Tratamiento NitritosDocumento2 páginasTratamiento NitritosDiego F. Pérez GuerreroAún no hay calificaciones
- CONVERSIONDocumento1 páginaCONVERSIONDenaibeliAún no hay calificaciones
- NOTA: 92 Les Dije Que No Hicieran PortadaDocumento5 páginasNOTA: 92 Les Dije Que No Hicieran PortadaRicardo Barboza MontealegreAún no hay calificaciones
- Clasificación de Formas FarmacéuticasDocumento2 páginasClasificación de Formas FarmacéuticasZúñiga EstherAún no hay calificaciones
- Sílabo Bioquímica 2022-IIDocumento5 páginasSílabo Bioquímica 2022-IIGian Marco NUÑEZ SOTOAún no hay calificaciones
- Inv. 3 Jesus MarquezDocumento13 páginasInv. 3 Jesus MarquezJesus Antonio Ramos MarquezAún no hay calificaciones
- ARTÍCULO 4 - Reutilización de Aguas Servidas - Proyecto de LeyDocumento59 páginasARTÍCULO 4 - Reutilización de Aguas Servidas - Proyecto de LeyMANUEL VASQUEZ LOPEZAún no hay calificaciones
- Cuestionario EmpiricaDocumento2 páginasCuestionario EmpiricaAlvinAún no hay calificaciones
- Contaminacion en La Sub Ceunca Del Rio Antequera OruroDocumento10 páginasContaminacion en La Sub Ceunca Del Rio Antequera OruroMarcoAntonioTrujilloGarciaAún no hay calificaciones
- 111 NoneDocumento1 página111 NoneKrillin con bigoteAún no hay calificaciones
- Papeletas 2023-1 QAs 1628 - 031347Documento7 páginasPapeletas 2023-1 QAs 1628 - 031347pablo cruz100% (1)
- Plan de Contingencias - CalienteDocumento8 páginasPlan de Contingencias - CalienteKristy Florian100% (1)
- Aluminio VFDocumento53 páginasAluminio VFJose Fernando Huayhua ApfataAún no hay calificaciones
- Hidrolisis del anhídrido maleicoDocumento10 páginasHidrolisis del anhídrido maleicoRobinho Sullca CerronAún no hay calificaciones
- Aceite Termico Shell Oil S2 PDFDocumento2 páginasAceite Termico Shell Oil S2 PDFHector BarriosAún no hay calificaciones
- Technical Writing 2016 IIBCAUDODocumento56 páginasTechnical Writing 2016 IIBCAUDOPROCTORMEYERAún no hay calificaciones
- Tecnología Del ConcretoDocumento8 páginasTecnología Del ConcretoKeymer Guerrero ZavaletaAún no hay calificaciones
- Clase 1 Equipamientos y Principios Físicos. MX DigitalDocumento53 páginasClase 1 Equipamientos y Principios Físicos. MX DigitalCarlos AliagaAún no hay calificaciones
- Hidrocarburos AromáticosDocumento12 páginasHidrocarburos AromáticosShadow Mario0% (1)
- Taller # 3 Final 2021-2 QuimicaDocumento2 páginasTaller # 3 Final 2021-2 QuimicaSergio Alejandro RUIZ FOREROAún no hay calificaciones
- Microsoft Word - Repartido N 1 Transporte Ionico 2010Documento4 páginasMicrosoft Word - Repartido N 1 Transporte Ionico 2010Santiago MedinaAún no hay calificaciones
- Isotiazolinonas y Piritiona de zinc: Propiedades y actividad antimicrobianaDocumento3 páginasIsotiazolinonas y Piritiona de zinc: Propiedades y actividad antimicrobianaMaximiliano ValverdeAún no hay calificaciones
- Uso, Mantenimiento y Limpieza de Los Elementos de Proteccion PersonalDocumento6 páginasUso, Mantenimiento y Limpieza de Los Elementos de Proteccion PersonalLauritha CoronadoAún no hay calificaciones
- T1-Linea Del Tiempo-Elma-Cervantes Nieto Grecia Guadalupe-Qi4cDocumento2 páginasT1-Linea Del Tiempo-Elma-Cervantes Nieto Grecia Guadalupe-Qi4cCervantes NietoAún no hay calificaciones
- Informe Grupos 4 y 5 Quimica AnaliticaDocumento5 páginasInforme Grupos 4 y 5 Quimica Analiticagiulietta stylesAún no hay calificaciones
- Práctica 3 Preparación y Titulación de SolucionesDocumento8 páginasPráctica 3 Preparación y Titulación de SolucionesEdecio MarcanoAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Cómo Desintoxicar el Cuerpo de Metales Pesados: El Secreto Poco Hablado para Sentirte Mejor, Bajar de Peso y Tener más EnergíaDe EverandCómo Desintoxicar el Cuerpo de Metales Pesados: El Secreto Poco Hablado para Sentirte Mejor, Bajar de Peso y Tener más EnergíaCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Teoría de juegos: Una introducción matemática a la toma de decisionesDe EverandTeoría de juegos: Una introducción matemática a la toma de decisionesCalificación: 4 de 5 estrellas4/5 (1)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Medicina Funcional: La revolución en el tratamiento médicoDe EverandMedicina Funcional: La revolución en el tratamiento médicoCalificación: 5 de 5 estrellas5/5 (5)
- Nunca fuimos modernos: Ensayos de antropología simétricaDe EverandNunca fuimos modernos: Ensayos de antropología simétricaAún no hay calificaciones
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- En busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)De EverandEn busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)Calificación: 4.5 de 5 estrellas4.5/5 (3)
- Fisiología renal y metabolismo hidrosalino: Segunda ediciónDe EverandFisiología renal y metabolismo hidrosalino: Segunda ediciónAún no hay calificaciones
- Principios básicos de bioquímica de los alimentosDe EverandPrincipios básicos de bioquímica de los alimentosCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Madre Embarazada por Primera Vez: La Guía Completa Semana Tras Semana para Tener un Embarazo Tranquilo y Saludable Hasta Dar a LuzDe EverandMadre Embarazada por Primera Vez: La Guía Completa Semana Tras Semana para Tener un Embarazo Tranquilo y Saludable Hasta Dar a LuzCalificación: 5 de 5 estrellas5/5 (1)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Disciplina inteligente en la escuela: Hacia una pedagogía de la no violenciaDe EverandDisciplina inteligente en la escuela: Hacia una pedagogía de la no violenciaCalificación: 5 de 5 estrellas5/5 (3)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Diagnóstico y tratamiento del canino retenido: Aspectos clavesDe EverandDiagnóstico y tratamiento del canino retenido: Aspectos clavesCalificación: 3.5 de 5 estrellas3.5/5 (9)
- En busca del sentido de la educaciónDe EverandEn busca del sentido de la educaciónCalificación: 4.5 de 5 estrellas4.5/5 (6)