Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Equilibrio Químico
Cargado por
Luis Moreno0 calificaciones0% encontró este documento útil (0 votos)
68 vistas7 páginasEl documento describe el significado de los valores de la constante de equilibrio (Ke) en diferentes situaciones: Ke > 1 indica que la reacción favorece la formación de productos, Ke = 1 que no hay preferencia, y Ke < 1 que predomina la formación de reactivos. También presenta ejemplos de cálculos de Ke para varias reacciones químicas.
Descripción original:
Título original
EQUILIBRIO QUÍMICO
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl documento describe el significado de los valores de la constante de equilibrio (Ke) en diferentes situaciones: Ke > 1 indica que la reacción favorece la formación de productos, Ke = 1 que no hay preferencia, y Ke < 1 que predomina la formación de reactivos. También presenta ejemplos de cálculos de Ke para varias reacciones químicas.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
68 vistas7 páginasEquilibrio Químico
Cargado por
Luis MorenoEl documento describe el significado de los valores de la constante de equilibrio (Ke) en diferentes situaciones: Ke > 1 indica que la reacción favorece la formación de productos, Ke = 1 que no hay preferencia, y Ke < 1 que predomina la formación de reactivos. También presenta ejemplos de cálculos de Ke para varias reacciones químicas.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 7
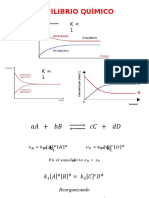
Significado de la constante de equilibrio
En un sistema en equilibrio se puede presentar algunas de las siguientes
situaciones:
Ke > 1. La concentración de los productos es mayor que la concentración de
los reactivos. Esto significa que la reacción es favorable en el sentido de
formación de los productos. Industrialmente se busca que se presente esta
situación, con el fin de optimizar la producción de algún compuesto deseado.
Ke = 1. El valor de la constante de equilibrio oscila alrededor de uno. Significa
que la proporción de reactivos y productos es similar, sin que favorezca la
formación de ninguno de los dos.
Ke < 1. La concentración de los productos es menor que la de los reactivos.
En este caso, se presenta una situación desfavorable en la formación de
productos, pues predomina la formación de reactivos.
CONSTANTES DE EQUILIBRIO PARA VARIAS
REACCIONES
2 HI (g) ↔ H2(g) + H2 (g) PRÁCTICA:
Ke = ǀH2ǀǀI2ǀ / ǀHIǀ2 1. Se colocan en un recipiente de vidrio
de 1 L 0,02 mol de PCl5 (g) y se llevan a
una temperatura de 200°C, con lo cual
2H2O(l) ↔ H3O(ac) + OH-(ac) PCl5 se descompone de acuerdo con la
Ke = ǀH3O+ǀǀOH-ǀ ecuación: PCl5(g) ↔ PCl3 (g) + Cl2
ǀPCl5 ǀ = 0,01076 mol/L
C(s) + 2H2(g) ↔ CH4(g) ǀ PCl3 ǀ = 0,00924 mol/L
Ke = ǀCH4ǀ/ǀH2ǀ2 Con esta información, calcula la
constante de equilibrio.
2. Se ha estudiado el siguiente equilibrio a 230°C:
2SO2(g) + O2 ↔ 2SO3 (g). En un experimento las concentraciones en
equilibrio de las sustancias son 2,6 M de SO2. 18,0 M de SO3 y 0,042 M
de O2. Determine el valor de Ke.
3. Se sabe que el valor de la constante de equilibrio Ke para la reacción:
PCl5(g) ↔ PCl3 (g) + Cl2 es 1,05 a 250°C. Si las concentraciones en
equilibrio son respectivamente 0,87 M y 0,463 M. ¿ Cuál es la
concentración del cloro en equilibrio a 250°C?
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- UD 6 Equilibrio Químico COMPLETODocumento66 páginasUD 6 Equilibrio Químico COMPLETOEmmaAún no hay calificaciones
- Equilibrio QuimicoDocumento14 páginasEquilibrio QuimicoLuis JaramilloAún no hay calificaciones
- Equilibrio QuimicoDocumento9 páginasEquilibrio QuimicoPEDRO AARON REY CHAVEZAún no hay calificaciones
- UNIDAD IV Semana 13 - EQUILIBRIO QUIMICODocumento10 páginasUNIDAD IV Semana 13 - EQUILIBRIO QUIMICOOmar Isaac Villaverde LopezAún no hay calificaciones
- Semana 08 Tema Equilibrio (Autoguardado)Documento43 páginasSemana 08 Tema Equilibrio (Autoguardado)Brandon GarroAún no hay calificaciones
- Guía 2 - Equilibrio QuímicoDocumento4 páginasGuía 2 - Equilibrio QuímicoMauricio ahumadaAún no hay calificaciones
- Diapositivas Tema. Equilibrio QuímicoDocumento24 páginasDiapositivas Tema. Equilibrio QuímicoEnrique PinazoAún no hay calificaciones
- Equilibrio QuimicoDocumento21 páginasEquilibrio QuimicoCRISTIAN MAURICIO LEON MERAAún no hay calificaciones
- Equilibrio QuimicoDocumento30 páginasEquilibrio QuimicoKaled ChahuanAún no hay calificaciones
- SESIÓN 3 Equilibrio QuímicoDocumento15 páginasSESIÓN 3 Equilibrio QuímicoA.DAún no hay calificaciones
- Trabajo en EquipoDocumento23 páginasTrabajo en EquipoJose David Escalona GarateAún no hay calificaciones
- EJERCICIOS DE EQUILIBRIO QUIMICO Modificado VirtualDocumento20 páginasEJERCICIOS DE EQUILIBRIO QUIMICO Modificado Virtualkaneki kenAún no hay calificaciones
- Ejercicios 2 Equilibrio QuimicoDocumento3 páginasEjercicios 2 Equilibrio QuimicoDENNIS - CONDORIAún no hay calificaciones
- Equilibrio QuímicoDocumento7 páginasEquilibrio QuímicoPilar YsabelAún no hay calificaciones
- Sesion 14 - Equilibrio QuímicoDocumento36 páginasSesion 14 - Equilibrio QuímicoYaquelin ocasAún no hay calificaciones
- Unidad 6. Equilibrio Acido BaseDocumento46 páginasUnidad 6. Equilibrio Acido BaseBryan Josue Amaya Mercedes100% (1)
- Equilibrio Gaseoso 2013-1Documento20 páginasEquilibrio Gaseoso 2013-1Josias Cueto MendozaAún no hay calificaciones
- Equilibrio QuimicoDocumento38 páginasEquilibrio QuimicoPaola Gonzales FarfanAún no hay calificaciones
- Tema 12. Equilibrio Químico PDFDocumento28 páginasTema 12. Equilibrio Químico PDFestefanoAún no hay calificaciones
- EQUILIBRIO QUIMICO para EstudiantesDocumento15 páginasEQUILIBRIO QUIMICO para EstudiantesMariana Beltrán OrtizAún no hay calificaciones
- Equilibrio QuímicoDocumento4 páginasEquilibrio Químicojdiazgall9395Aún no hay calificaciones
- Equilibrio QuimicoDocumento30 páginasEquilibrio QuimicoAMY FERNANDA FERNANDEZ DIAZAún no hay calificaciones
- Guía Síntesis Equilibrio QuímicoDocumento10 páginasGuía Síntesis Equilibrio QuímicoPame HunterAún no hay calificaciones
- Unidad IV Clase 12Documento16 páginasUnidad IV Clase 12Pedro Carrasco TorrezAún no hay calificaciones
- Equilibrio QuímicoDocumento27 páginasEquilibrio QuímicoDanielitha Martinez GamarraAún no hay calificaciones
- 9 - Unidad 8Documento6 páginas9 - Unidad 8LGM proAún no hay calificaciones
- Equilibrio QuímicoDocumento9 páginasEquilibrio QuímicoRicardo RodríguezAún no hay calificaciones
- S05.s1 - Material - Equilibrio QuímicoDocumento34 páginasS05.s1 - Material - Equilibrio QuímicoOlger Aragon BerlangaAún no hay calificaciones
- Ejercicios Sobre Equilibrio Quimico. PrimeraDocumento3 páginasEjercicios Sobre Equilibrio Quimico. Primeragjra1982100% (1)
- Capítulo 09 - Equilibrio QuímicoDocumento44 páginasCapítulo 09 - Equilibrio QuímicoLia Midori Giraldo CruzAún no hay calificaciones
- Unidad 7 Equilibrio QuímicoDocumento32 páginasUnidad 7 Equilibrio Químicofabian marzoliAún no hay calificaciones
- ppt.S05 - VFDocumento25 páginasppt.S05 - VFKokaAún no hay calificaciones
- Equilibrio QuimicoDocumento26 páginasEquilibrio Quimicogacv0925Aún no hay calificaciones
- Equilibrio QuimicoDocumento19 páginasEquilibrio QuimicoFred OmarAún no hay calificaciones
- Equilibrio Químico Mcgraw HillDocumento30 páginasEquilibrio Químico Mcgraw HillPriscilla RHAún no hay calificaciones
- Semana 14-Equilibrio QuimicoDocumento23 páginasSemana 14-Equilibrio QuimicoVictor HuallancaAún no hay calificaciones
- Unidad 2 Clase Equilibrio Quimico LidiaDocumento39 páginasUnidad 2 Clase Equilibrio Quimico LidiaDan CheshireAún no hay calificaciones
- Unidad1 EquilibrioDocumento33 páginasUnidad1 EquilibrioMarcosAún no hay calificaciones
- Apuntes Equilibrio Quim y EjerciciosDocumento10 páginasApuntes Equilibrio Quim y EjerciciosMatias Ignacio Zarate PiñeiroAún no hay calificaciones
- Capítulo VIIIDocumento7 páginasCapítulo VIIIMesa TorcidaAún no hay calificaciones
- Equilibrio QuimicoDocumento26 páginasEquilibrio QuimicopeccianAún no hay calificaciones
- Equilibrio Gaseoso-1Documento18 páginasEquilibrio Gaseoso-1retiformeAún no hay calificaciones
- ppt.S05 - VFDocumento25 páginasppt.S05 - VFLeonardo Jesus Fajardo AlbertisAún no hay calificaciones
- Equilibrio QuimicoDocumento1 páginaEquilibrio QuimicoDiego Ignacio Parra ZentenoAún no hay calificaciones
- Clase Equilibrio Quimico Aspectos CualitativosDocumento27 páginasClase Equilibrio Quimico Aspectos CualitativosDaniela EscobarAún no hay calificaciones
- Equilibrio QuímicoDocumento8 páginasEquilibrio QuímicoRios MiguelAún no hay calificaciones
- Equilibrio QuimicoDocumento45 páginasEquilibrio QuimicoflorZZ12Aún no hay calificaciones
- Equilibrio QuimicoDocumento12 páginasEquilibrio Quimicojoaquin gomenzoroAún no hay calificaciones
- Equilibrio Quc3admico CureDocumento39 páginasEquilibrio Quc3admico CureEmilse GonzalezAún no hay calificaciones
- CAP VI Equilibrio IONICO QADocumento24 páginasCAP VI Equilibrio IONICO QADaniela Leveau AlvaAún no hay calificaciones
- Equilibrio QuímicoDocumento3 páginasEquilibrio QuímicotutoriasaaptyAún no hay calificaciones
- Equilibrio QuimicoDocumento58 páginasEquilibrio QuimicoJosdan Machuca QuiñonesAún no hay calificaciones
- Equilibrio Quimico 12Documento30 páginasEquilibrio Quimico 12zoeAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Gasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleDe EverandGasificación de briquetas de carbón con biomasa:: una alternativa energética sostenibleAún no hay calificaciones
- Operaciones unitarias y proceso químico. QUIE0108: Operaciones básicas en planta químicaDe EverandOperaciones unitarias y proceso químico. QUIE0108: Operaciones básicas en planta químicaAún no hay calificaciones
- Experimento VirtualDocumento6 páginasExperimento VirtualLuis MorenoAún no hay calificaciones
- Manejo Práctico Del Trastorno TDAH 2021 WebDocumento16 páginasManejo Práctico Del Trastorno TDAH 2021 WebLuis MorenoAún no hay calificaciones
- Taller Principio de Le ChalelierDocumento3 páginasTaller Principio de Le ChalelierLuis MorenoAún no hay calificaciones
- ColoidesDocumento14 páginasColoidesLuis MorenoAún no hay calificaciones
- Laboratorio No 1 QM 11Documento2 páginasLaboratorio No 1 QM 11Luis MorenoAún no hay calificaciones
- Cálculos Químicos.Documento13 páginasCálculos Químicos.Luis MorenoAún no hay calificaciones
- Laboratorio Virtual Leyes Ponderales (QM 10°A)Documento3 páginasLaboratorio Virtual Leyes Ponderales (QM 10°A)Luis MorenoAún no hay calificaciones
- Cuál Será El Papel de La Química en El Siglo XXIDocumento3 páginasCuál Será El Papel de La Química en El Siglo XXILuis MorenoAún no hay calificaciones
- Cálculos Químicos.Documento13 páginasCálculos Químicos.Luis MorenoAún no hay calificaciones
- Laboratorio de Calorimetria.Documento3 páginasLaboratorio de Calorimetria.Luis MorenoAún no hay calificaciones
- Experimento No 2Documento3 páginasExperimento No 2Luis MorenoAún no hay calificaciones