Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Síndrome de Zellweger
Cargado por
Roberto GarciaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Síndrome de Zellweger
Cargado por
Roberto GarciaCopyright:
Formatos disponibles
Síndrome de Zellweger
Definición de la enfermedad
Es un trastorno de la biogénesis del peroxisoma caracterizado por defectos de
migración neuronal, rasgos craneofaciales dismórficos, convulsiones neonatales y
disfunción hepática.
ORPHA:912
Nivel de clasificación: Trastorno
Sinónimos: -
Prevalencia: Desconocido
Herencia: Autosómico recesivo
Edad de inicio o aparición: Neonatal
CIE-10: Q87.8
OMIM: 214100 214110 614859 614862 614866 614870 614872 614876
614882 614883 614886 614887 617370
UMLS: C0043459
MeSH: D015211
GARD: 7917
MedDRA: -
Resumen
Epidemiología
La prevalencia al nacimiento del espectro del síndrome Zellweger (PBD-ZSS) se
estima en alrededor de 1/50.000 en los Estados Unidos y de 1/500.000 en Japón. La
mayor incidencia del síndrome de Zellweger (ZS) se ha publicado en la región
Saguenay-Lac St Jean de Quebec (alrededor de 1/12.000).
Descripción clínica
Se inicia en el periodo neonatal, como resultado tanto de la malformación de
órganos como de la disfunción peroxisomal que causa un deterioro progresivo. Los
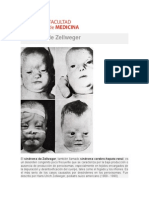
recién nacidos presentan rasgos craneofaciales dismórficos (facies aplanadas,
fontanela anterior grande, suturas abiertas, frente alta y prominente, occipucio
aplanado, fisuras palpebrales inclinadas hacia arriba, pliegues del epicanto, puente
nasal ancho), hipotonía profunda y convulsiones. Pueden presentarse macrocefalia
o microcefalia, paladar ojival, micrognatia y pliegues de piel redundantes en el
cuello. Son frecuentes las anomalías esqueléticas (condrodisplasia punctata) y los
quistes renales subcorticales. A menudo hay retraso en el crecimiento,
hepatomegalia, ictericia y coagulopatía. Los hallazgos oculares incluyen cataratas,
glaucoma, retinopatía pigmentosa, nistagmo, opacidad corneal y atrofia del nervio
óptico. Los cambios y pérdidas visuales son progresivos. Puede presentarse
pérdida de audición neurosensorial. Puede producirse criptorquidia e hipospadias
y clitoromegalia. La función del SNC está gravemente afectada y sufren un retraso
psicomotor profundo.
Etiología
El PBD-ZSS está causado por mutaciones en uno de los 13 genes PEX que
codifican las peroxinas. Las mutaciones en estos genes dan lugar a la biogénesis
anormal de peroxisomas.
Métodos diagnósticos
Se sospecha de ZS en el examen físico y se confirma mediante evaluación
bioquímica. Los niveles de ácidos grasos de cadena muy larga en plasma (VLCFA)
indican defectos del metabolismo de los ácidos grasos peroxisomales con elevadas
concentraciones en plasma de C26:0 y C26:1 e índices elevados de C24/C22 y
C26/C22. Las concentraciones de plasmalógenos C16 y C18 en la membrana del
eritrocito se reducen. Los niveles de ácidos pipecólicos en plasma aumentan.
Pueden secuenciarse los 13 genes PEX. La RM identifica la polimicrogiria
perisilviana, y otras malformaciones cerebrales.
Diagnóstico diferencial
Los principales diagnósticos diferenciales incluyen el síndrome de Usher I y II,
otros trastornos PBD-ZSS, defectos enzimáticos individuales en la beta-oxidación
de ácidos grasos de peroxisomas, y trastornos con hipotonía grave, convulsiones
neonatales, disfunción hepática o leucodistrofia.
Diagnóstico prenatal
Puede realizarse un estudio prenatal de los niveles VLCFA y la síntesis de
plasmalógenos en cultivo de amniocitos en vellosidades coriales. Si se han
identificado los dos alelos causantes de la enfermedad en los padres, puede hacerse
un diagnóstico prenatal así como un diagnóstico genético preimplantacional.
Consejo genético
El ZS es hereditario de forma autosómica recesiva por lo que es posible el consejo
genético.
Manejo y tratamiento
No hay cura para el ZS. Los medicamentos epilépticos estándar se usan para
controlar las convulsiones. La coagulopatía hepática puede ser tratada con
suplementos de vitamina mientras que la colestasis puede requerir el suministro de
todas las vitaminas liposolubles. Se puede necesitar una gastrostomía para
proporcionar una adecuada ingesta de calorías. Deben restringirse los alimentos
ricos en ácido fitánico. Los suplementos de ácidos biliares maduros, ácido cólico y
quenodesoxicólico pueden ayudar a mejorar la enfermedad hepática en bebés con
hepatopatía grave. Como los pacientes con ZS no pueden biosintetizar DHA,
también les puede ser proporcionada.
Pronóstico
Independientemente de las intervenciones, el pronóstico es desfavorable y la
mayoría de los bebés muren en el primer año de vida por una insuficiencia
respiratoria asociada a la infección o por una epilepsia intratable.
También podría gustarte
- La Enfermedad de Refsum InfantilDocumento5 páginasLa Enfermedad de Refsum InfantilAnggie Sanchez SaldañaAún no hay calificaciones
- Organelos Celulares y Enfermedades HumanasDocumento2 páginasOrganelos Celulares y Enfermedades Humanasnitzia carrasquedoAún no hay calificaciones
- Enfermedad de HersDocumento5 páginasEnfermedad de HersRonyadira Moscoso Monge33% (3)
- Resumen de Introducción A Los EIMDocumento17 páginasResumen de Introducción A Los EIMConsu consu07hotmail.comAún no hay calificaciones
- AmilopectinosisDocumento4 páginasAmilopectinosisVíctor Jesús Paredes MartinezAún no hay calificaciones
- Prevalencia: 1-5 / 10 000 Herencia: Recesivo Ligado Al X Edad de Inicio o Aparición: Infancia Deficiencia de Alfa Galactosidasa ADocumento7 páginasPrevalencia: 1-5 / 10 000 Herencia: Recesivo Ligado Al X Edad de Inicio o Aparición: Infancia Deficiencia de Alfa Galactosidasa AAndrés LázaroAún no hay calificaciones
- Glucogenosis Tipo IVDocumento10 páginasGlucogenosis Tipo IVmickevillanuevaAún no hay calificaciones
- Generalidades de Los Trastornos Metabólicos Neonatales Con Afectación NeurológicaDocumento13 páginasGeneralidades de Los Trastornos Metabólicos Neonatales Con Afectación NeurológicaThanery Chiri ZegarraAún no hay calificaciones
- Síndrome de AlagilleDocumento7 páginasSíndrome de Alagillestrauss100Aún no hay calificaciones
- Enfermedades Lipidos (NJJG)Documento6 páginasEnfermedades Lipidos (NJJG)Jacqueline Jiménez GuzmánAún no hay calificaciones
- Tesaurismosis Glucogenosis PDFDocumento6 páginasTesaurismosis Glucogenosis PDFDonaldo PerezAún no hay calificaciones
- El Síndrome de SmithDocumento13 páginasEl Síndrome de SmithjacquelineAún no hay calificaciones
- Presentacion BM Equipo 2Documento38 páginasPresentacion BM Equipo 2122- Juárez Alonso Francisco JavierAún no hay calificaciones
- Enfermedad de HersDocumento5 páginasEnfermedad de HersClarita MendozaAún no hay calificaciones
- Leucodistrofia MetacromaticaDocumento13 páginasLeucodistrofia MetacromaticaCarolina Chaverra Herrera100% (1)
- Síndrome de Shwachman-DiamondDocumento4 páginasSíndrome de Shwachman-DiamondZuleika VRAún no hay calificaciones
- AdrenoleucodistrofiaDocumento4 páginasAdrenoleucodistrofiaeugeblanc89Aún no hay calificaciones
- TEMA 10: Enfermedades Neurológicas Pediátricas Hereditarias Genética, Diagnóstico Molecular y Medicina de PrecisiónDocumento16 páginasTEMA 10: Enfermedades Neurológicas Pediátricas Hereditarias Genética, Diagnóstico Molecular y Medicina de PrecisiónMark Sal DontoAún no hay calificaciones
- Guia de Seminario de Enfermedades Por Deposito Lisosomal de LipidosDocumento18 páginasGuia de Seminario de Enfermedades Por Deposito Lisosomal de LipidosRuddy Humberto Sotomayor BrenesAún no hay calificaciones
- PATOLOGIASDocumento5 páginasPATOLOGIASNancy FierroAún no hay calificaciones
- Tema 16 LipidosisDocumento57 páginasTema 16 LipidosisJessica PachEcoAún no hay calificaciones
- Enfermedad de Hers - NDocumento4 páginasEnfermedad de Hers - NNadia OrtizAún no hay calificaciones
- Neurologia MetabolicasDocumento76 páginasNeurologia Metabolicasconsultorio la cardeneraAún no hay calificaciones
- Enfermedades PeroxisomalesDocumento14 páginasEnfermedades PeroxisomalesDaniel RomanoAún no hay calificaciones
- Anemia FanconiDocumento14 páginasAnemia FanconiManuelVergaraLdsAún no hay calificaciones
- Enfermedades Del Almacenamiento de GlucógenoDocumento9 páginasEnfermedades Del Almacenamiento de GlucógenoJhusleidy España ArroyoAún no hay calificaciones
- Glosario Endocrinología - Katherine Plaza Alvarado G7 Semiologia IIDocumento13 páginasGlosario Endocrinología - Katherine Plaza Alvarado G7 Semiologia IIStefania PlazaAún no hay calificaciones
- Enfermedad de CoriDocumento3 páginasEnfermedad de CoriPaula NaomiAún no hay calificaciones
- Óleo de LorenzoDocumento7 páginasÓleo de LorenzoCarla MoragasAún no hay calificaciones
- Síndrome de Kearns-SayreDocumento10 páginasSíndrome de Kearns-SayreMylene GutierrezAún no hay calificaciones
- SÍNDROME DE - DELECIÓN 22q11Documento7 páginasSÍNDROME DE - DELECIÓN 22q11Felipe Giraldo CadenaAún no hay calificaciones
- Tarea-Sistema de ConducciónDocumento2 páginasTarea-Sistema de ConducciónLizbeth GordilloAún no hay calificaciones
- Síndrome de LeighDocumento8 páginasSíndrome de LeighOrion Erenhu R. Gonzalez100% (1)
- Síndrome de ZellwegerDocumento8 páginasSíndrome de ZellwegerManuel DuarteAún no hay calificaciones
- Enfermedad de PompeDocumento24 páginasEnfermedad de PompeValeria Castro100% (1)
- SX MielodisplasicoDocumento38 páginasSX MielodisplasicoGenesis Martinez100% (1)
- Enfermedades de LipidosDocumento16 páginasEnfermedades de LipidosCAROL JULIETH DIAZ ARCILAAún no hay calificaciones
- 2020 Enfermedades Por Almacenamiento de LípidosDocumento7 páginas2020 Enfermedades Por Almacenamiento de LípidosNatalyAlvarezRodriguezAún no hay calificaciones
- Ensayo Kearns-SayreDocumento3 páginasEnsayo Kearns-SayreSantiagoTaraAún no hay calificaciones
- Enfermedad de WilsonDocumento16 páginasEnfermedad de WilsonAndreaAún no hay calificaciones
- Trisomia 21Documento3 páginasTrisomia 21Kent Terán ChávezAún no hay calificaciones
- Síndrome de DownDocumento4 páginasSíndrome de DownPablo De Olarte P.Aún no hay calificaciones
- Pediatria - SX Nefrotico PDFDocumento8 páginasPediatria - SX Nefrotico PDFYessica PérezAún no hay calificaciones
- Infografías GenéticaDocumento7 páginasInfografías GenéticaZAIRA EDITH HERNANDEZ RAMIREZAún no hay calificaciones
- Miopatias LipidicasDocumento6 páginasMiopatias LipidicasAndres AlzuaAún no hay calificaciones
- Ácidos NucleicosDocumento7 páginasÁcidos NucleicosFJXGCHKBHIÑAún no hay calificaciones
- El Sindrome de AlagilleDocumento26 páginasEl Sindrome de AlagilleJorge Alejandro Pinto RicoAún no hay calificaciones
- Enfermedades Del Almacenamiento de GlucógenoDocumento6 páginasEnfermedades Del Almacenamiento de GlucógenoKrizty CadenaAún no hay calificaciones
- DiaposDocumento26 páginasDiaposAmyAún no hay calificaciones
- Bioquimica EnfermedadesDocumento8 páginasBioquimica EnfermedadesLauraMilenaJaramilloRodriguezAún no hay calificaciones
- Enfermedad de BattenDocumento9 páginasEnfermedad de BattenUriel Robledo MagallónAún no hay calificaciones
- Síndrome de AlströmDocumento17 páginasSíndrome de AlströmAndres VillanuevaAún no hay calificaciones
- Síndrome de Hutchinson-GilfordDocumento4 páginasSíndrome de Hutchinson-GilfordRowuilmer FuentesAún no hay calificaciones
- Sindrome de MarfanDocumento11 páginasSindrome de MarfanAndrea neriaAún no hay calificaciones
- Anemias Hipoplasicas: Aspectos GeneralesDocumento14 páginasAnemias Hipoplasicas: Aspectos GeneralesWakahisaAún no hay calificaciones
- Sindrome de Alpers-HuttenlocherDocumento12 páginasSindrome de Alpers-Huttenlochersarith ibarraAún no hay calificaciones
- Enf Byler y El RestoDocumento11 páginasEnf Byler y El RestoKidys CasidyAún no hay calificaciones
- Sindrome de Noonan - Junto Con Diap.Documento8 páginasSindrome de Noonan - Junto Con Diap.Krizzia A. CádizAún no hay calificaciones
- Comprendiendo El Alzhéimer: 7 mitos y verdades que debes conocerDe EverandComprendiendo El Alzhéimer: 7 mitos y verdades que debes conocerCalificación: 5 de 5 estrellas5/5 (1)
- Absorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleDe EverandAbsorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleAún no hay calificaciones
- Test 2Documento4 páginasTest 2Roberto GarciaAún no hay calificaciones
- Test 3Documento5 páginasTest 3Roberto GarciaAún no hay calificaciones
- Tema 5 OadeDocumento22 páginasTema 5 OadeRoberto GarciaAún no hay calificaciones
- Test 4Documento4 páginasTest 4Roberto GarciaAún no hay calificaciones
- Test 5Documento5 páginasTest 5Roberto GarciaAún no hay calificaciones
- Test 1Documento4 páginasTest 1Roberto GarciaAún no hay calificaciones
- Tema 4 OadeDocumento68 páginasTema 4 OadeRoberto GarciaAún no hay calificaciones
- Tema 2 OadeDocumento29 páginasTema 2 OadeRoberto GarciaAún no hay calificaciones
- Gestión y Conservación de Los Fondos Museísticos.Documento14 páginasGestión y Conservación de Los Fondos Museísticos.Roberto GarciaAún no hay calificaciones
- El Tratado de ÁmsterdamDocumento2 páginasEl Tratado de ÁmsterdamRoberto GarciaAún no hay calificaciones
- Tema 3 OadeDocumento23 páginasTema 3 OadeRoberto GarciaAún no hay calificaciones
- Domus PDFDocumento14 páginasDomus PDFRoberto Garcia100% (1)
- Tema 1 OadeDocumento31 páginasTema 1 OadeRoberto GarciaAún no hay calificaciones
- Domus PDFDocumento14 páginasDomus PDFRoberto Garcia100% (1)
- Síndrome de GilbertDocumento1 páginaSíndrome de GilbertRoberto GarciaAún no hay calificaciones
- Lenguaje Documental PDFDocumento342 páginasLenguaje Documental PDFPatriciaAún no hay calificaciones
- Dialnet FuentesDeInformacionJuridica 5460669Documento26 páginasDialnet FuentesDeInformacionJuridica 5460669ChinamerAún no hay calificaciones
- Síndrome Del PiramidalDocumento5 páginasSíndrome Del PiramidalRoberto GarciaAún no hay calificaciones
- Síndrome Del XYYDocumento3 páginasSíndrome Del XYYRoberto GarciaAún no hay calificaciones
- Documentacion Murcia OposicionesDocumento10 páginasDocumentacion Murcia OposicionesRoberto GarciaAún no hay calificaciones
- Síndrome Del Navicular AccesorioDocumento3 páginasSíndrome Del Navicular AccesorioRoberto GarciaAún no hay calificaciones
- Síndrome X FrágilDocumento8 páginasSíndrome X FrágilRoberto GarciaAún no hay calificaciones
- El Síndrome de Fuga CapilarDocumento4 páginasEl Síndrome de Fuga CapilarRoberto Garcia100% (1)
- Xeroderma PigmentosoDocumento3 páginasXeroderma PigmentosoRoberto GarciaAún no hay calificaciones
- Síndrome de ZollingerDocumento2 páginasSíndrome de ZollingerRoberto GarciaAún no hay calificaciones
- Síndrome de Marshall o Síndrome PFAPADocumento2 páginasSíndrome de Marshall o Síndrome PFAPARoberto GarciaAún no hay calificaciones
- Síndrome de KlinefelterDocumento4 páginasSíndrome de KlinefelterRoberto GarciaAún no hay calificaciones
- El Síndrome de XiaDocumento4 páginasEl Síndrome de XiaRoberto GarciaAún no hay calificaciones
- Sindrome de ZinnerDocumento1 páginaSindrome de ZinnerRoberto GarciaAún no hay calificaciones
- Peligros y Riesgos Joaquin CañameroDocumento3 páginasPeligros y Riesgos Joaquin CañameroMilagros ChanganaquiAún no hay calificaciones
- Esn Inmunizaciones (SP)Documento34 páginasEsn Inmunizaciones (SP)Nelida ChoqueAún no hay calificaciones
- Profesiograma Consumer SolutionsDocumento31 páginasProfesiograma Consumer SolutionsAmelia Neira PedrozaAún no hay calificaciones
- TRATAMIENTOS PARA ENDOCARDITIS - Rivaldo VergaraDocumento6 páginasTRATAMIENTOS PARA ENDOCARDITIS - Rivaldo Vergararivaldo vergaraAún no hay calificaciones
- Anamnesis Psicológica Caso P.S.ODocumento3 páginasAnamnesis Psicológica Caso P.S.OKu NoupAún no hay calificaciones
- RFGDocumento31 páginasRFGCarmen PaguadaAún no hay calificaciones
- Material Complementar de Espanhol - 7º AnoDocumento7 páginasMaterial Complementar de Espanhol - 7º Anosouza_ufrjAún no hay calificaciones
- La Sociedad Del Cansancio y Transparencia... CTSDocumento12 páginasLa Sociedad Del Cansancio y Transparencia... CTSJuan Felipe SanchezAún no hay calificaciones
- Guia de Actividades y Rúbrica de Evaluación - Unidad 2 - Fase 4 - Necesidades Nutricionales de La Producción PDFDocumento8 páginasGuia de Actividades y Rúbrica de Evaluación - Unidad 2 - Fase 4 - Necesidades Nutricionales de La Producción PDFmirna monzonAún no hay calificaciones
- Teórico 5 Métodos de EvaluaciónDocumento16 páginasTeórico 5 Métodos de EvaluaciónVale PonceAún no hay calificaciones
- La Educacion Inclusiva en Bolivia - 2021Documento122 páginasLa Educacion Inclusiva en Bolivia - 2021Lorenzo Marfisi100% (1)
- El Cuerpo Una Máquina PerfectaDocumento2 páginasEl Cuerpo Una Máquina PerfectaAngie GalvisAún no hay calificaciones
- Res310-18 - PICT 2017 - Plan Argentina Innovadora 2020 - Proyectos AdjudicadosDocumento30 páginasRes310-18 - PICT 2017 - Plan Argentina Innovadora 2020 - Proyectos AdjudicadosDiego FößcatoAún no hay calificaciones
- Espejismo Texto ArgumentativoDocumento4 páginasEspejismo Texto Argumentativoapi-326318793Aún no hay calificaciones
- GasometriaDocumento6 páginasGasometriaEve SalgadoAún no hay calificaciones
- Marchitez VascularDocumento33 páginasMarchitez VascularNelson DukeAún no hay calificaciones
- Ud 6 Las Muestras de Sangre GMBDocumento89 páginasUd 6 Las Muestras de Sangre GMBMiguelAún no hay calificaciones
- Tema 2. ModelajeDocumento3 páginasTema 2. ModelajeClara Teresa Calzado Obret100% (3)
- Fallos28 Legitima DefensaDocumento27 páginasFallos28 Legitima DefensaRuben LealAún no hay calificaciones
- Con Que Saberes Cuento TAREA NUMERO 1Documento13 páginasCon Que Saberes Cuento TAREA NUMERO 1elprofe_nl50% (2)
- Hidroterapia CristinaDocumento22 páginasHidroterapia CristinaLinda BleyckAún no hay calificaciones
- Metodo HamacaTerapia ProyectoDocumento18 páginasMetodo HamacaTerapia ProyectoAna LyaAún no hay calificaciones
- Determinantes Sociales de La Salud y Su Influencia en La Atención Sanitaria-ResumenDocumento4 páginasDeterminantes Sociales de La Salud y Su Influencia en La Atención Sanitaria-ResumenMariela GajardoAún no hay calificaciones
- Peppermint Essential-OilDocumento1 páginaPeppermint Essential-OilKatia FCAún no hay calificaciones
- Cuando Tu Hermano o Hermana Tiene CancerDocumento17 páginasCuando Tu Hermano o Hermana Tiene CancerVeronica FerreiraAún no hay calificaciones
- Constancia Cita en LineaDocumento1 páginaConstancia Cita en LineaRuben RodriguezAún no hay calificaciones
- Karen HorneyDocumento1 páginaKaren HorneyNey RizoAún no hay calificaciones
- Universidad Tecnologica de Los Andes-1Documento15 páginasUniversidad Tecnologica de Los Andes-1marco Rojas CcolqquehuancaAún no hay calificaciones
- El Mensajero de NEPADocumento72 páginasEl Mensajero de NEPAThe Times LeaderAún no hay calificaciones
- Tema 47. Cuidados Generales de La PielDocumento14 páginasTema 47. Cuidados Generales de La PielRaquel Esteban0% (1)