Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fuentes Principales de Nitrógeno de Nitratos - en Aguas Subterráneas
Cargado por
Sarai Olmedo CruzDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Fuentes Principales de Nitrógeno de Nitratos - en Aguas Subterráneas
Cargado por
Sarai Olmedo CruzCopyright:
Formatos disponibles
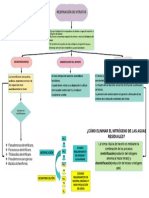
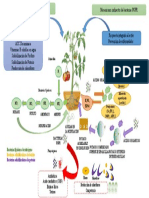
Fuentes principales de nitrógeno de nitratos
en aguas subterráneas
Fuente de entrada Características y Fuentes Formación de nitritos y nitratos Medidas para el control de nitratos (España)
a aguas subsuperficiales propiedades de nitratos
Naturales Nitritos ( menos soluble, Medidas preventivas
Procesos naturales Son muy móviles menos estable, en bajas concentraciones)
Rocas ígneas, por Establecer zonas de proteccion
-Por precipitación No son adsorbidos por los proceso de meteorización Oxidación bacteriana Solo ocurre en condiciones
-Intemperismo de los minerales materiales del acuífero incompleta del nitrógeno de poca oxigenación
en el medio acuático o terrestre Capacitar en un uso adecuado
-Descomposición de materia orgánica
Salitres, muy pocos: KNO3- NaNO3 de fertilizantes N-NO3 por lixiviación
No precipitan como un mineral
Provenientes de Reducción bacteriana del nitrato
Aire, insignificante Orientar en uso de purines
actividades humanas
Reduccion del nitrato cantidad
Nitratos
Ordenamiento
Fuente puntual
Por bacterias Óxido nítrico y el dióxido de de cédula de cultivo
nitrógeno, inducidos por los rayos Descomposición natural
-Excesiva fertilización
Contaminación Delimitación de areas sensibles a NO3
-Deforestación
Artificiales Por microorganismos
-Cambio de MO como rotación de cultivos de acuíferos
Delimitación de áreas
Fertilizantes Materiales nitrogenados orgánicos permanentes sin fertilizar:
Fuente no puntual Lentos para contaminarse
como las proteínas de plantas, - Agua con NO3 >70 mg/L
animales y excretas
Nítricos: 11 y el 16% en nitratos. Ejemplos: NaNO3,
-Efluentes de lagunas Difícilmente se autodepuran
Ca(NO3)2, KNO3. Medidas correctivas
-Tanques sépticos
El ion amonio
Ion nitrato, forma termodinámica
Amónicos: 21% en amonio. Ejemplo: (NH4)2SO4 Mezcla de aguas para disolución
estable del N en sistemas
Se oxida a nitritos y nitratos
acuosos y terrestres oxigenados
por proceso de oxidación
Amónicos y nítricos: 20 y 34% en nitratos y amonio. Clausura de puntos de contaminación
biológica (nitrificación)
Ejemplos : (NH4)NO3, Ca(NH4)2 y (NH4)2SO4.
Primera reacción por Modificación de la profundidad de sondeo
De Amidas: aportan en nitrógeno entre el 21 y el
Nitrosomonas (quimiolitróficas)
45% en amidas. Ejemplo: urea y
cianamida de calcio Embalse de agua en superficie
Segunda por Nitrobacter, las cuales para provocar denitrificación biológica
obtienen casi toda su energía de la
Excretas animales
oxidación de nitritos. Plantas de tratamiento de
agua para disminuir NO3
Producción de 43 kg de N
Resinas intercambiables
Impacto de la porcicultura en la calidad del agua
subterránea
Denitrificacion
biológica provocada
Nitrosaminas, cancerígenas en el estómago y
un problema respiratorio, la metahemoglobinemia
Osmosis inversa
Desechos municipales, industriales y del
transporte
5 Kg de N por persona anual
También podría gustarte
- Mapa Conceptual Menas de UranioDocumento3 páginasMapa Conceptual Menas de UranioNicolás Plata G.Aún no hay calificaciones
- Ciclo Del NitrogenoDocumento2 páginasCiclo Del NitrogenoSilvana ManchayAún no hay calificaciones
- Ciclo Del NitrogenoDocumento3 páginasCiclo Del NitrogenoSilvana ManchayAún no hay calificaciones
- Presentación NitrificaciónDocumento43 páginasPresentación NitrificaciónLaura R. ValbuenaAún no hay calificaciones
- Ciclo Del Nitrogeno PresentacionDocumento5 páginasCiclo Del Nitrogeno PresentacionAdan MonterrosaAún no hay calificaciones
- Ciclo Carbono. Cambios en La Atmósfera y El Clima22015 1Documento67 páginasCiclo Carbono. Cambios en La Atmósfera y El Clima22015 1katrinaAún no hay calificaciones
- Ciclo NitrogenoDocumento1 páginaCiclo Nitrogenogatob1Aún no hay calificaciones
- El Ciclo Del NitrogenoDocumento1 páginaEl Ciclo Del NitrogenoDante Yoel Aquino SangayAún no hay calificaciones
- IV Bim - 1er. Año - Bio - Guía 5 - Ciclo Del NitrogenoDocumento3 páginasIV Bim - 1er. Año - Bio - Guía 5 - Ciclo Del NitrogenoCarlos HinostrozaAún no hay calificaciones
- G1 - Remocion de Nitrogeno y FosforoDocumento40 páginasG1 - Remocion de Nitrogeno y FosforoCarlos AguirreAún no hay calificaciones
- 7° Ciclo Del NitrogenoDocumento2 páginas7° Ciclo Del NitrogenoYesith CastroAún no hay calificaciones
- Nitratos y NitritosDocumento26 páginasNitratos y NitritosSharon SarmientoAún no hay calificaciones
- Ciclo Del Nitrogeno para Primero de SecundariaDocumento3 páginasCiclo Del Nitrogeno para Primero de Secundariajoselo herrera mogotocoroAún no hay calificaciones
- A2A Ketty Ccallo CICLO DEL NITROGENO, AZUFRE Y FOSFORODocumento3 páginasA2A Ketty Ccallo CICLO DEL NITROGENO, AZUFRE Y FOSFOROCleliaCcalloPaccaAún no hay calificaciones
- 5 Federico Manejo de La Nutrición en Huertos de Aguacate (Spanish)Documento76 páginas5 Federico Manejo de La Nutrición en Huertos de Aguacate (Spanish)Adriana CatherineAún no hay calificaciones
- Discusión y Conclusion Lluvia Acida OkDocumento3 páginasDiscusión y Conclusion Lluvia Acida OkDiego Pillaca RojasAún no hay calificaciones
- Dia Positi VaDocumento1 páginaDia Positi VaGenesis SalazarAún no hay calificaciones
- Fijación Biológica de NitrógenoDocumento25 páginasFijación Biológica de NitrógenoMARIA FERNANDA MURILLO GÓMEZAún no hay calificaciones
- Ciclo Del NitrogenoDocumento1 páginaCiclo Del Nitrogenoluis fernando100% (1)
- Respiracion de Nitratos PDFDocumento1 páginaRespiracion de Nitratos PDFJenniffer Tatiana Gualacio BenavidezAún no hay calificaciones
- 4 - Muñoz Arboleda - Simposio Fertilidad NOA 2016 IMPORTANTE CONEDocumento51 páginas4 - Muñoz Arboleda - Simposio Fertilidad NOA 2016 IMPORTANTE CONEAlbar ConejoAún no hay calificaciones
- Fase 2 Diseño Y Construccion 1 Espina de Pescado LitosferaDocumento5 páginasFase 2 Diseño Y Construccion 1 Espina de Pescado LitosferaDavisMorenoAún no hay calificaciones
- IV Bim - 1er. Año - Bio - Guía 5 - Ciclo Del NitrogenoDocumento3 páginasIV Bim - 1er. Año - Bio - Guía 5 - Ciclo Del NitrogenoEfraín Gil Pando VegaAún no hay calificaciones
- Tarea 3 - 358025A-953Documento7 páginasTarea 3 - 358025A-953karenAún no hay calificaciones
- Acidez y Salinidad en ColombiaDocumento2 páginasAcidez y Salinidad en ColombiaGilina Maestre OtalvarezAún no hay calificaciones
- Cuadro SipnoticoDocumento4 páginasCuadro SipnoticoCarol CedilloAún no hay calificaciones
- Remoción de CR, Fe, Ni, Cu Y ZN de Un Agua Residual No Doméstica Usando Residuos Agroindustriales de Banano Como AdsorbentesDocumento18 páginasRemoción de CR, Fe, Ni, Cu Y ZN de Un Agua Residual No Doméstica Usando Residuos Agroindustriales de Banano Como AdsorbentesSantiago BedoyaAún no hay calificaciones
- Nitro AgroDocumento2 páginasNitro Agroanon_664247718Aún no hay calificaciones
- Euro Carne 12912004Documento16 páginasEuro Carne 12912004Milton Ed Guaran MogollonAún no hay calificaciones
- NitrogenoDocumento2 páginasNitrogenoJhony Albes GarciaAún no hay calificaciones
- Ciclo Del Nitrogeno Mapa MentalDocumento1 páginaCiclo Del Nitrogeno Mapa MentalJonathan100% (1)
- Ciclos BiogeoquímicosDocumento7 páginasCiclos BiogeoquímicosBrayan Einsten Montalvo RamírezAún no hay calificaciones
- Ciclo Del NitrógenoDocumento3 páginasCiclo Del NitrógenoYulieth QuispeAún no hay calificaciones
- Ambiente MarinoDocumento5 páginasAmbiente MarinoFox MenAún no hay calificaciones
- Identificacion de Los Impactos Ambientales Del Proyecto Minero Mina LA JUSTA.Documento1 páginaIdentificacion de Los Impactos Ambientales Del Proyecto Minero Mina LA JUSTA.jhonAún no hay calificaciones
- Remineralizacion de SuelosDocumento73 páginasRemineralizacion de SuelosAstrip100% (3)
- Mapa Conceptual de Ciclos BiogeoquimicosDocumento2 páginasMapa Conceptual de Ciclos Biogeoquimicosromy cuellarAún no hay calificaciones
- Ciclo Del NitrogenoDocumento1 páginaCiclo Del NitrogenoAINHOA GABRIELA AZEMA RODRIGUEZAún no hay calificaciones
- Grafica PlantaDocumento1 páginaGrafica PlantaLuis RuedaAún no hay calificaciones
- Trabajo de Investigación 2Documento4 páginasTrabajo de Investigación 2Anonymous mUX80t4LqAún no hay calificaciones
- El CarbonDocumento68 páginasEl CarbonRenataAlvaradoAún no hay calificaciones
- Qui MicaDocumento16 páginasQui MicaAngelica Lopez GutierrezAún no hay calificaciones
- Nitrogenado Clase 7Documento21 páginasNitrogenado Clase 7Diego Alejandro Pérez OjedaAún no hay calificaciones
- Mapa Mental Otro ElementosDocumento3 páginasMapa Mental Otro ElementosSilvana ManchayAún no hay calificaciones
- 2 - Composicion Quimica General Del Agua SubterraneaDocumento20 páginas2 - Composicion Quimica General Del Agua Subterraneaiubix92Aún no hay calificaciones
- Interpretación de Los Resultados de Parámetros Del SueloDocumento14 páginasInterpretación de Los Resultados de Parámetros Del SueloAndy K.100% (1)
- Eliminación de Nitratos Con Intercambio Iónico - PDFDocumento14 páginasEliminación de Nitratos Con Intercambio Iónico - PDFJulio TovarAún no hay calificaciones
- AnammoxDocumento30 páginasAnammoxMiguel BattikhAún no hay calificaciones
- Asimilacion Del Nitrogeno en Las Plantas: Glutamato + NH4+ + ATP Glutamina + ADP + PiDocumento1 páginaAsimilacion Del Nitrogeno en Las Plantas: Glutamato + NH4+ + ATP Glutamina + ADP + PiSANDRA ARLLET LEIVA ZAMUDIOAún no hay calificaciones
- Lixiviación - Cubas Castillo HernánDocumento1 páginaLixiviación - Cubas Castillo HernánHernann GutiereeAún no hay calificaciones
- Registro de GR y GR EspectralDocumento59 páginasRegistro de GR y GR EspectralChris EgasAún no hay calificaciones
- BioestruvitaDocumento10 páginasBioestruvitaHeidy Viviana Galan ComayanAún no hay calificaciones
- Matriz Comparativa de La Nom Aa 099 Scfi 2021Documento16 páginasMatriz Comparativa de La Nom Aa 099 Scfi 2021damaris pucAún no hay calificaciones
- Ciclo Del Nitrogeno para Primero de SecundariaDocumento3 páginasCiclo Del Nitrogeno para Primero de SecundariaMatthias VidalAún no hay calificaciones
- Ciclo Del Nitrogeno Mapa ConceptualDocumento1 páginaCiclo Del Nitrogeno Mapa ConceptualJonathanAún no hay calificaciones
- Taller Ciclos BiogeoquímicoDocumento5 páginasTaller Ciclos BiogeoquímicoGabriella DíazAún no hay calificaciones
- Nitratos y NitritosDocumento14 páginasNitratos y Nitritosluis carlosAún no hay calificaciones
- Nitro Compu EstosDocumento28 páginasNitro Compu EstosYessenia LagosAún no hay calificaciones
- Rayo 500 FW - 1LDocumento1 páginaRayo 500 FW - 1LSarai Olmedo CruzAún no hay calificaciones
- Oup Accepted Manuscript 2016.en - EsDocumento27 páginasOup Accepted Manuscript 2016.en - EsSarai Olmedo CruzAún no hay calificaciones
- Montezano2014 PT EsDocumento11 páginasMontezano2014 PT EsSarai Olmedo CruzAún no hay calificaciones
- 65-Texto Del Artículo-557-1-10-20200609Documento7 páginas65-Texto Del Artículo-557-1-10-20200609Sarai Olmedo CruzAún no hay calificaciones
- AGcacoalDocumento76 páginasAGcacoalSarai Olmedo CruzAún no hay calificaciones
- Maiz Microsuelo AireDocumento117 páginasMaiz Microsuelo AireSarai Olmedo CruzAún no hay calificaciones
- EB2005065001002 en EsDocumento6 páginasEB2005065001002 en EsSarai Olmedo CruzAún no hay calificaciones
- INFORME InclusionDocumento156 páginasINFORME InclusionSarai Olmedo CruzAún no hay calificaciones
- AlcachofasDocumento45 páginasAlcachofasSarai Olmedo CruzAún no hay calificaciones
- Cantus FirmusDocumento2 páginasCantus FirmusAlaan Castañeda MuñizAún no hay calificaciones
- Análisis EtnomusicológicoDocumento11 páginasAnálisis EtnomusicológicoAna Deisy García100% (1)
- Co-Ep-P-48 Procedimiento de Aplicaciòn de EstucoDocumento5 páginasCo-Ep-P-48 Procedimiento de Aplicaciòn de EstucoLaura Cataño100% (1)
- Uso de La Raya de Diálogo IIDocumento4 páginasUso de La Raya de Diálogo IICarito Andy TúnezAún no hay calificaciones
- Registro de Entrega de EPPSDocumento7 páginasRegistro de Entrega de EPPSLesly Maribel Gutierrez GonzalesAún no hay calificaciones
- Auditoria de Dulce MariaDocumento11 páginasAuditoria de Dulce Mariadeisy velandiaAún no hay calificaciones
- Referentes ParametricosDocumento5 páginasReferentes ParametricosIan Francesco Gonz�les ChahuaAún no hay calificaciones
- Sem6 TeratogénesisDocumento3 páginasSem6 TeratogénesisFede RamirezAún no hay calificaciones
- Actividad II Mapa Conceptual Importancia y Aplicación de Las Normas ParlamentariasDocumento6 páginasActividad II Mapa Conceptual Importancia y Aplicación de Las Normas ParlamentariasNorman PeñaAún no hay calificaciones
- Sobre Los Textos Poeticos en Juan Vazquez Mudarra y Narvaez PDFDocumento24 páginasSobre Los Textos Poeticos en Juan Vazquez Mudarra y Narvaez PDFRadamésPazAún no hay calificaciones
- Tarea 1.2 Plantilla GlorymelleDocumento2 páginasTarea 1.2 Plantilla GlorymelleArdnas OnetnecAún no hay calificaciones
- Condori Mamani Henry Brando El TeatroDocumento32 páginasCondori Mamani Henry Brando El TeatroCondori Mamani Henry BrandoAún no hay calificaciones
- 3060 PDDocumento106 páginas3060 PDPedro GuevaraAún no hay calificaciones
- Aprendizaje GuiadoDocumento6 páginasAprendizaje GuiadoSheila RBAún no hay calificaciones
- 2da Clase - PenicilinasDocumento49 páginas2da Clase - PenicilinasCátedra de Farmacología de la Escuela de Medicina de La UNIVERSIDAD DEL ZULIA100% (1)
- Resumen Papalia Capitulo 6Documento6 páginasResumen Papalia Capitulo 6MaferPlazaFamigliettiAún no hay calificaciones
- Monografia de ComunicaciònDocumento13 páginasMonografia de ComunicaciònKen-y Montero TovarAún no hay calificaciones
- Cuadernillo Tecnología 5ºDocumento6 páginasCuadernillo Tecnología 5ºirenegodoyl28Aún no hay calificaciones
- Perfil de Tesis en Educación Superior Postulante Javier JustinianoDocumento23 páginasPerfil de Tesis en Educación Superior Postulante Javier JustinianoJavier Luis JustinianoAún no hay calificaciones
- Fábulas en Viñetas ModDocumento16 páginasFábulas en Viñetas ModAnabel HiraldoAún no hay calificaciones
- Conservacion de Arte PlumarioDocumento31 páginasConservacion de Arte PlumarioAnonymous svtw3HAún no hay calificaciones
- Una Terapia Ocupacional Basada en Los Derechos HumanosDocumento26 páginasUna Terapia Ocupacional Basada en Los Derechos HumanoschiararociomorenoAún no hay calificaciones
- La PapaDocumento8 páginasLa PapaFC Angel LuisAún no hay calificaciones
- Guia #5 Grado Sexto Seres Vivos y Su ClasificacionDocumento9 páginasGuia #5 Grado Sexto Seres Vivos y Su ClasificacionCarlos andres OcoroAún no hay calificaciones
- Ejemplo de ReportajeDocumento8 páginasEjemplo de Reportajenanis432540% (5)
- Texturas de Las Rocas Ígneas PDFDocumento42 páginasTexturas de Las Rocas Ígneas PDFAlejandra Cusicanqui GonzálezAún no hay calificaciones
- El Iguano NoticiasDocumento7 páginasEl Iguano Noticiasdmcxdmcx7Aún no hay calificaciones
- Cap.6 Redes SecasDocumento7 páginasCap.6 Redes Secasjumancesu0% (2)
- TepsiDocumento6 páginasTepsiVanesa100% (1)
- MetacogniciónDocumento7 páginasMetacogniciónDamariz HernándezAún no hay calificaciones