Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica 2 Recristalización
Cargado por
Dayra HuertasDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica 2 Recristalización
Cargado por
Dayra HuertasCopyright:
Formatos disponibles
UNIVERSIDAD DE ANTIOQUIA, FACULTAD DE QUÍMICA FARMACÉUTICA
LABORATORIO DE QUÍMICA GENERAL QSQ-102 Profesor: Jaime O. Pérez O.
Practica: Solubilidad Fecha: 4 de diciembre de 2014
Dayra Nathaly Huertas
Melissa Arbeláez Jiménez
Objetivos
-Determinar la variación de la solubilidad en agua de un sólido en función de la temperatura.
Datos de la literatura.
Tubo de ensayo: 21,36 g
Tubo de ensayo con soporte: 32,40 g
Sal: 4,01 g
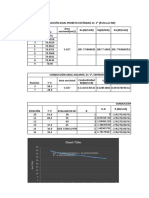
Tabla 1. Solubilidad del nitrato de potasio (KNO 3) en agua en función de la temperatura.
T (°C) 0 10 20 30 40 50 60 70 80 90 100 110 120
gsal/100gH2O 13,3 20,9 31,6 45,8 63,9 85,5 110 138 169 202 246 300 394
Datos experimentales.
Masa del soluto: 4,01 g de KNO3
Temperatura inicial del agua: 20 °C
Tabla 2. Datos de temperatura de volumen de agua en la determinación de la solubilidad de
KNO3
Denominació Temperatura (°C) Volumen agua (mL)
n
T1 65 3,00
T2 50 4,00
T3 42 5,00
T4 36 6,00
T5 32 7,00
Temperatura de referencia: Temperatura laboratorio = 28 °C
Cálculos.
Formula de solubilidad S = Masa soluto (g)
100 mL H 2O
Se usa de la siguiente manera: S = 4,01 g
Vagua (mL)
Reemplazamos en la formula Vagua con los valores obtenidos de la tabla 2
Así: S1 = 4,01 g X 100 = 133,66
3,00
Tabla 3. Resultados de la solubilidad del KNO 3 a diferentes temperaturas.
Solubilidad (S) Temperatura (°C)
133,66 65
100,25 50
80,2 42
66,83 36
57,28 32
3.5.4 Interpolar es sacar un valor de acuerdo a otros valores que se den en la tabla grafica que
se elabora por ejemplo, si existen varias concentraciones y entre ellas hay una de 98 y otra de
99 de concentración la interpolación entre 98 y 99 es igual a 97.
Si la gráfica está bien realizada no hay error o el error es muy pequeño.
CALCULO DEL PORCETAJE DE ERROR ES:
%error = Dato de la concentración obtenida por interpolación
Dato teórico de la concentración X 100
3.5.5 Si se aumenta la temperatura aumenta la solubilidad, en la mayoría de las sustancias. En
caso de que disminuya disminuye la solubilidad. En un proceso exotérmico se libera energía
aumentando la temperatura, por lo tanto el sólido disuelto aumentará su solubilidad.
Conclusiones.
1. El soluto al momento de ponerlo en el solvente no se disuelve totalmente.
2. La solubilidad depende de la temperatura.
3. Al comparar T1 = 50 °C y T2 = 65°C, T2 es menor porque hay más solvente y se disuelve
más fácil y a medida que aumenta el volumen la temperatura siempre será menor.
Bibliografía.
http://www.uantof.cl/salitre/Nitrato%20K.pdf
También podría gustarte
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- 0224 Oxigeno IndustrialDocumento5 páginas0224 Oxigeno IndustrialHector Isacc Palechor EspitiaAún no hay calificaciones
- Triptico de Manual de Operacion y Mantenimiento de Sistemas de Agua PotableDocumento2 páginasTriptico de Manual de Operacion y Mantenimiento de Sistemas de Agua PotableGabriela Olivera Angeles100% (5)
- Lubricantes Especiales - Kluber para Maquinas TextilesDocumento40 páginasLubricantes Especiales - Kluber para Maquinas TextilesWilly CalsinaAún no hay calificaciones
- Dossier Tecnico Desague PDFDocumento54 páginasDossier Tecnico Desague PDFcharlyAún no hay calificaciones
- E5P6J811Documento7 páginasE5P6J811sabAún no hay calificaciones
- Determinacion Calor de SolucionDocumento15 páginasDeterminacion Calor de Solucionsimon j ochoa aAún no hay calificaciones
- Practica 5 Propiedades Coligativas 1Documento7 páginasPractica 5 Propiedades Coligativas 1ampavase88% (8)
- Informe 5Documento7 páginasInforme 5Jose Yeison Urquijo HernandezAún no hay calificaciones
- Curva de SolubilidadDocumento16 páginasCurva de SolubilidadAna Esther Serpa SaezAún no hay calificaciones
- Curva de Solubilidad InorganicaDocumento11 páginasCurva de Solubilidad InorganicaDani BerrioAún no hay calificaciones
- Informe 5 de Laboratorio de QuímicaDocumento7 páginasInforme 5 de Laboratorio de QuímicaFranklin Flores BarrigaAún no hay calificaciones
- SolubilidadDocumento7 páginasSolubilidadMariaAún no hay calificaciones
- Laboratorio de Ebulloscopia 2Documento6 páginasLaboratorio de Ebulloscopia 2Diego CerqueraAún no hay calificaciones
- Qg1-Qfb1-Equipo N1-Pract N8-Curva Kno3Documento9 páginasQg1-Qfb1-Equipo N1-Pract N8-Curva Kno3Ruth GonzalezAún no hay calificaciones
- Informe de Inorganica OriginalDocumento16 páginasInforme de Inorganica OriginalCamilo Rafael Osorio PintoAún no hay calificaciones
- Quimica General Practica SolubilidadDocumento7 páginasQuimica General Practica SolubilidadBecky LizAún no hay calificaciones
- Articulo 3. Determinacion de La Curva de Solubilidad para Nitrato de Potasio y Otra SalDocumento11 páginasArticulo 3. Determinacion de La Curva de Solubilidad para Nitrato de Potasio y Otra SalCristian Sair Garcés NaranjoAún no hay calificaciones
- SOLUBILIDADDocumento7 páginasSOLUBILIDADxNeoZeedAún no hay calificaciones
- Curva de SolubilidadDocumento6 páginasCurva de SolubilidadJose Miguel Mejia GrauAún no hay calificaciones
- Práctica #4 Descenso Del Punto de Congelación de Un Solvente PuroDocumento21 páginasPráctica #4 Descenso Del Punto de Congelación de Un Solvente PuroMaría de los Ángeles Moreno CoronadoAún no hay calificaciones
- Reporte de Laboratorio N°3-2022-1Documento17 páginasReporte de Laboratorio N°3-2022-1Angel MarellaAún no hay calificaciones
- Termodinamica Informe 3Documento6 páginasTermodinamica Informe 3Daniel Alejandro Salamanca SantiagoAún no hay calificaciones
- Práctica - # - 6 (LQG) 2010Documento4 páginasPráctica - # - 6 (LQG) 2010César David Franchi Bethencourt67% (3)
- Informe de Práctica de Determinacion de Solubilidad de Solidos Josué Llivipuma Paralelo 201Documento5 páginasInforme de Práctica de Determinacion de Solubilidad de Solidos Josué Llivipuma Paralelo 201Jefferson Franco GallardoAún no hay calificaciones
- SolubilidadDocumento8 páginasSolubilidadBetsabee Ramírez LeónAún no hay calificaciones
- Solubilidad Del Ácido Benzoico y Determinación de Su Calor de SoluciónDocumento13 páginasSolubilidad Del Ácido Benzoico y Determinación de Su Calor de SoluciónHector Jesus Roca LoaizaAún no hay calificaciones
- Solubilidad Práctica No. 3 Quimica GeneralDocumento14 páginasSolubilidad Práctica No. 3 Quimica GeneralEnrique Herrera GonzálezAún no hay calificaciones
- Informe Entalpía de Mezclas de Fluidos BinariosDocumento7 páginasInforme Entalpía de Mezclas de Fluidos BinariosDalíAsesoríasAún no hay calificaciones
- Practica 4 Laboratorio de Fisicoquímica IiDocumento19 páginasPractica 4 Laboratorio de Fisicoquímica IiLuis Angel GomezAún no hay calificaciones
- Informe Fisicoquímica Ambiental UnadDocumento53 páginasInforme Fisicoquímica Ambiental Unadc1e2s3100% (2)
- Determinacion Calor de SolucionDocumento14 páginasDeterminacion Calor de SolucionDionisio MayorgaAún no hay calificaciones
- Calor de NeutralizaciongrpmDocumento13 páginasCalor de NeutralizaciongrpmjokervelozAún no hay calificaciones
- Solubilidad Acido BenzoicoDocumento13 páginasSolubilidad Acido BenzoicoKamila MartinezAún no hay calificaciones
- Informe Factor Vant' HoffDocumento12 páginasInforme Factor Vant' HoffNatasha Arcos100% (2)
- Laboratorio #3 - Propiedades Coligativas. Punto de CongelacionDocumento8 páginasLaboratorio #3 - Propiedades Coligativas. Punto de CongelacionVictor AristizabalAún no hay calificaciones
- Informe 9Documento4 páginasInforme 9Bayron pachecoAún no hay calificaciones
- Informe de Fisicoquimica de SolubilidadDocumento11 páginasInforme de Fisicoquimica de SolubilidadRiosaSanchezAún no hay calificaciones
- Informe 3 Lab de Fiqui - Variación de La Solubilidad Con La TemperaturaDocumento6 páginasInforme 3 Lab de Fiqui - Variación de La Solubilidad Con La TemperaturaPIERO MATIAS HERRERA SUAREZAún no hay calificaciones
- E1 P6 Mi 1214Documento6 páginasE1 P6 Mi 1214Zazil Guzmán100% (1)
- Informe Fisicoquimik CALOR DE NEUTRALIZACIÓNDocumento13 páginasInforme Fisicoquimik CALOR DE NEUTRALIZACIÓNCristian DiazAún no hay calificaciones
- Reporte 1 Fisicoquímica FCQDocumento12 páginasReporte 1 Fisicoquímica FCQGerardo GarciaAún no hay calificaciones
- Solubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Documento10 páginasSolubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Oscar Portillo100% (1)
- Entalpia de Descomposicion PDFDocumento18 páginasEntalpia de Descomposicion PDFale fgAún no hay calificaciones
- Determinacion de La Curva de SolubilidadDocumento18 páginasDeterminacion de La Curva de SolubilidadMaria BrangoAún no hay calificaciones
- QuimicaDocumento17 páginasQuimicaValeria SantinniAún no hay calificaciones
- TP 3 Lab SolubilidadDocumento2 páginasTP 3 Lab SolubilidadagrappaAún no hay calificaciones
- Trabajo Práctico #4 Solubilidad Del KCLO3Documento5 páginasTrabajo Práctico #4 Solubilidad Del KCLO3Pau Zalazar0% (1)
- Determinación Del Calor Diferencial de Solución.Documento4 páginasDeterminación Del Calor Diferencial de Solución.GICELAAún no hay calificaciones
- CONCLUSIONESDocumento13 páginasCONCLUSIONESLucy JonesAún no hay calificaciones
- Informe Semana 09Documento8 páginasInforme Semana 09Paola Cateriano ParedesAún no hay calificaciones
- Calor Diferencial de DisoluciónDocumento9 páginasCalor Diferencial de DisoluciónSteevenRafaelPinargoteAún no hay calificaciones
- Calor de Disolución y Neutralización Daniel-DeicyDocumento4 páginasCalor de Disolución y Neutralización Daniel-DeicyCatalina Duque HenaoAún no hay calificaciones
- 2do. Corte. Informe - Calor de Solución.Documento5 páginas2do. Corte. Informe - Calor de Solución.Paola RiveraAún no hay calificaciones
- Practica 2 FisicoquimicaDocumento15 páginasPractica 2 FisicoquimicaJuan Carlos ClarosAún no hay calificaciones
- Calor Específico de SólidosDocumento5 páginasCalor Específico de SólidosDavid QuinteroAún no hay calificaciones
- P8LQ14 Hernandez Hernandez Deissy JovitaDocumento10 páginasP8LQ14 Hernandez Hernandez Deissy JovitaDey HzAún no hay calificaciones
- Metodo de La SolubilidadDocumento12 páginasMetodo de La SolubilidadJenny Luz GomezAún no hay calificaciones
- Trabajo Practico n3.Documento7 páginasTrabajo Practico n3.Sebastian RomeroAún no hay calificaciones
- Informe Laboratorio 5Documento13 páginasInforme Laboratorio 5Emilia EscalanteAún no hay calificaciones
- Calor DiferencialDocumento3 páginasCalor DiferencialLuisa De La HozAún no hay calificaciones
- Practica 2 RecristalizaciónDocumento2 páginasPractica 2 RecristalizaciónDayra HuertasAún no hay calificaciones
- Practica 1 Separacion de MezclasDocumento2 páginasPractica 1 Separacion de MezclasDayra HuertasAún no hay calificaciones
- Lab P.Fusion y EbullicionDocumento4 páginasLab P.Fusion y EbullicionDayra HuertasAún no hay calificaciones
- Formula de Un HidratoDocumento5 páginasFormula de Un HidratoDayra HuertasAún no hay calificaciones
- Eficiencia de Una ReaccionDocumento5 páginasEficiencia de Una ReaccionDayra HuertasAún no hay calificaciones
- Informe ConduccionDocumento6 páginasInforme ConduccionDayra HuertasAún no hay calificaciones
- EXPO LAB OPE LLDocumento25 páginasEXPO LAB OPE LLDayra HuertasAún no hay calificaciones
- Informe RefrigeracionDocumento5 páginasInforme RefrigeracionDayra HuertasAún no hay calificaciones
- Transferencia de Calor Por RadiaciónDocumento6 páginasTransferencia de Calor Por RadiaciónDayra HuertasAún no hay calificaciones
- Métodos de Conservación de La LecheDocumento23 páginasMétodos de Conservación de La LecheDayra HuertasAún no hay calificaciones
- Guía para El Desarrollo Del Componente Práctico y Rúbrica de Evaluación - Fase 5 - Componente Práctico - Práctica de LaboratorioDocumento36 páginasGuía para El Desarrollo Del Componente Práctico y Rúbrica de Evaluación - Fase 5 - Componente Práctico - Práctica de LaboratorioAngel Tomas Castro AponteAún no hay calificaciones
- Informe Laboratorio EnzimasDocumento3 páginasInforme Laboratorio Enzimassophie oundjianAún no hay calificaciones
- PRACTICA 2do Parcial ERWIN VILLARROEL MENESESDocumento22 páginasPRACTICA 2do Parcial ERWIN VILLARROEL MENESESErwinAún no hay calificaciones
- LIPIDOSDocumento7 páginasLIPIDOSdianaAún no hay calificaciones
- Coolelf Auto SupraDocumento2 páginasCoolelf Auto Supramauricio1barrientos10% (1)
- Oxicorte ... WordDocumento6 páginasOxicorte ... WordVictor Raul Osnayo MamaniAún no hay calificaciones
- Asfixias Bioquimicas y SutilesDocumento11 páginasAsfixias Bioquimicas y SutilesMaría VillaAún no hay calificaciones
- Cationes 3con TubosDocumento10 páginasCationes 3con TubosLeitoAún no hay calificaciones
- Respuestas de Nomenclatura AndresDocumento2 páginasRespuestas de Nomenclatura AndresAndres Juan Corredor SanchezAún no hay calificaciones
- Actividades Unidad de Competencia 1 Quimica Ii 21BDocumento17 páginasActividades Unidad de Competencia 1 Quimica Ii 21BMafer HerreraAún no hay calificaciones
- AluminoDocumento181 páginasAluminoOSWALDO MORALESAún no hay calificaciones
- Tratamiento de Agua de Pozo para Producir Agua EmbotelladaDocumento12 páginasTratamiento de Agua de Pozo para Producir Agua EmbotelladaRuben TGAún no hay calificaciones
- Reactividad de Compuestos AromáticosDocumento51 páginasReactividad de Compuestos AromáticosMariangelikMartinezAbreuAún no hay calificaciones
- Guia Ejercicios Quim002 PDFDocumento85 páginasGuia Ejercicios Quim002 PDFConstanza Garay SchmittAún no hay calificaciones
- Anexo De-9 Lic 600-11Documento515 páginasAnexo De-9 Lic 600-11arqfun18Aún no hay calificaciones
- Solubilidad de Compuestos OrgánicosDocumento7 páginasSolubilidad de Compuestos OrgánicosSandy Yuri LuizagaAún no hay calificaciones
- OrganicaDocumento20 páginasOrganicamiguelAún no hay calificaciones
- Componentes para Botelas de SoldarDocumento32 páginasComponentes para Botelas de Soldarrodrigo contrerasAún no hay calificaciones
- Derivados Clorados +Documento3 páginasDerivados Clorados +Luis Arturo Ruiz GalindoAún no hay calificaciones
- Introducción A La RefineríaDocumento34 páginasIntroducción A La RefineríaborisAún no hay calificaciones
- 04 Especificaciones Tecnicas Instalaciones SanitariasDocumento77 páginas04 Especificaciones Tecnicas Instalaciones SanitariasGisella Meliza Salas EspinozaAún no hay calificaciones
- Tabla de Calibres y Medidas de TuboDocumento4 páginasTabla de Calibres y Medidas de TuboDavid LucioAún no hay calificaciones
- Soda CausticaDocumento2 páginasSoda Causticavictor arenas aranibarAún no hay calificaciones
- Ficha Tecnica Vpci-368Documento2 páginasFicha Tecnica Vpci-368jhonatan_osoresmAún no hay calificaciones
- Moles y EstequiometriaDocumento9 páginasMoles y EstequiometriaJosé luis100% (1)