0% encontró este documento útil (0 votos)
666 vistas9 páginasSimulador GASES IDEALES
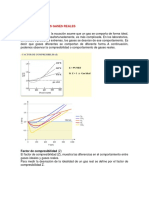
Este documento describe un simulador de gases ideales que permite modelar la mezcla y comportamiento de diferentes gases a escala de laboratorio. El simulador permite manipular variables como la temperatura, número de moléculas, y ancho del recipiente para observar su efecto en la presión. Se realizan diferentes casos variando estas variables y midiendo valores de presión. Los resultados muestran que a mayor temperatura o número de moléculas, mayor es la presión, mientras que a mayor ancho del recipiente la presión disminuye.
Cargado por
Anonymous 4rd8I79Derechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
666 vistas9 páginasSimulador GASES IDEALES
Este documento describe un simulador de gases ideales que permite modelar la mezcla y comportamiento de diferentes gases a escala de laboratorio. El simulador permite manipular variables como la temperatura, número de moléculas, y ancho del recipiente para observar su efecto en la presión. Se realizan diferentes casos variando estas variables y midiendo valores de presión. Los resultados muestran que a mayor temperatura o número de moléculas, mayor es la presión, mientras que a mayor ancho del recipiente la presión disminuye.
Cargado por
Anonymous 4rd8I79Derechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd