Documentos de Académico
Documentos de Profesional
Documentos de Cultura
TP ESTEQUIOMETRÍA Iaq
Cargado por
Andrea Soler0 calificaciones0% encontró este documento útil (0 votos)
13 vistas1 páginaEste documento presenta 4 problemas de estequiometría para resolver. El primer problema involucra calcular la fórmula, reacción química balanceada, moles de agua y oxígeno producidos y moléculas de monóxido de carbono liberadas durante la combustión incompleta de 2-metil-2-pentanol. El segundo problema implica calcular litros de oxígeno, gramos de agua y dióxido de carbono liberados y moléculas de oxígeno necesarias durante la combustión completa de un éter formado al
Descripción original:
ESTEQUIOMETRIA BÁSICA
Título original
tp ESTEQUIOMETRÍA iaq
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento presenta 4 problemas de estequiometría para resolver. El primer problema involucra calcular la fórmula, reacción química balanceada, moles de agua y oxígeno producidos y moléculas de monóxido de carbono liberadas durante la combustión incompleta de 2-metil-2-pentanol. El segundo problema implica calcular litros de oxígeno, gramos de agua y dióxido de carbono liberados y moléculas de oxígeno necesarias durante la combustión completa de un éter formado al
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
13 vistas1 páginaTP ESTEQUIOMETRÍA Iaq
Cargado por
Andrea SolerEste documento presenta 4 problemas de estequiometría para resolver. El primer problema involucra calcular la fórmula, reacción química balanceada, moles de agua y oxígeno producidos y moléculas de monóxido de carbono liberadas durante la combustión incompleta de 2-metil-2-pentanol. El segundo problema implica calcular litros de oxígeno, gramos de agua y dióxido de carbono liberados y moléculas de oxígeno necesarias durante la combustión completa de un éter formado al
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
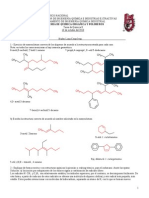
TRABAJO PRÁCTICO DE ESTEQUIOMETRÍA
RESOLVER LAS SIGUIENTES SITUACIONES PROBLEMÁTICAS:
1. Se disponen de 740 g. de 2 metil 2 pentanol y se someten a combustión incompleta:
a. Indique la fórmula del compuesto
b. Indique la reacción química balanceada
c. Calcule los moles de agua que se producen
d. Calcule los litros de oxigeno que se necesitan
e. Calcule las moléculas de monóxido de carbono liberadas.
2. Cuando se mezcla el butanol con el hexanol se forma un éter. Si se producen 3,92 moles
de dicho éter y se someten a combustión completa, calcular:
a. Litros de oxigeno necesarios.
b. Gramos de agua liberada
c. Moles de dióxido de carbono liberados
d. Moléculas de oxigeno necesarias
3. Un bioquímico realiza la combustión completa de 7,25. 10 23 moléculas de una cetona de
siete carbonos con dos ramificaciones. Exprese la fórmula del compuesto y de dos posibles
isómeros. Realice la combustión completa y balancee.
Calcular:
a. Para 700 g de la cetona , cuántos gramos de agua se liberan
b. Para 5,25 moles de la cetona cuantos gramos de oxigeno se necesitan
4. Para las siguientes sustancias:
a. Éter etil propílico e. 5 etil nonanal
b. 2,2,3,3 tertametil hexanol f. 1,2,3 propanotriol
c. 3 butanona g. 3,3 hexanodiol
d. Ácido 2 metil butanoico
Fórmula desarrollada y 2 isómeros
Combustión completa indicando gramos/ moles /moléculas y litros.
Calcule para 150g de cada una cuantos gramos de dióxido de carbono se formarán.
Prof. Soler Vidal Andrea Carolina Fecha de entrega: 22/10/15 Introducción a la Química
También podría gustarte
- Taller de AlcanosDocumento2 páginasTaller de Alcanosmarilu viafara l.Aún no hay calificaciones
- FISICADocumento5 páginasFISICAjhon limachiAún no hay calificaciones
- CUADERNILLODocumento16 páginasCUADERNILLOAyoze PérezAún no hay calificaciones
- Guia de Curso de Extraordinario de Química 2 2 1 1Documento5 páginasGuia de Curso de Extraordinario de Química 2 2 1 1atsiry gonzalesAún no hay calificaciones
- Preguntas Dominio - Científico 2020-02-19Documento17 páginasPreguntas Dominio - Científico 2020-02-19Adrii Giissell25% (4)
- Ejercicios de Hidrocarburos y de Estequiometria para El ParcialDocumento2 páginasEjercicios de Hidrocarburos y de Estequiometria para El ParcialVictor Sosa Flores100% (1)
- Problemasrepasoquimica 2Documento2 páginasProblemasrepasoquimica 2Juan Carlos Contador BaladonAún no hay calificaciones
- Ejercicios de Estequiometria 2023Documento2 páginasEjercicios de Estequiometria 2023GINA AZUCENA LOPEZ VERAAún no hay calificaciones
- Taller para Preparar El Bimestral de Quimica 11ºDocumento2 páginasTaller para Preparar El Bimestral de Quimica 11ºerika ortizAún no hay calificaciones
- TALLER 2 Istmina 2023-1Documento2 páginasTALLER 2 Istmina 2023-1Rosember RamirezAún no hay calificaciones
- Ejercicios Integradores de Contenidos-TFIDocumento7 páginasEjercicios Integradores de Contenidos-TFILautaro BotteAún no hay calificaciones
- Práctica de Ayudantía de Química 3ºPDocumento4 páginasPráctica de Ayudantía de Química 3ºPYef AntonioAún no hay calificaciones
- Química GeneralDocumento3 páginasQuímica GeneralDavid Peñates100% (1)
- Practica Final 2-2016 PDFDocumento2 páginasPractica Final 2-2016 PDFAlex Fernando Quispe MamaniAún no hay calificaciones
- Practica Final 2-2016Documento2 páginasPractica Final 2-2016Alex Fernando Quispe MamaniAún no hay calificaciones
- Balances de T1Documento3 páginasBalances de T1diegpAún no hay calificaciones
- Ejercicios de Repaso-Quimica de MaterialesDocumento4 páginasEjercicios de Repaso-Quimica de MaterialesjohnAún no hay calificaciones
- Procesosquimicos 53 64 1 8Documento8 páginasProcesosquimicos 53 64 1 82cczkgqgc4Aún no hay calificaciones
- Actividad - 2-Problemario Unidad - 1Documento10 páginasActividad - 2-Problemario Unidad - 1kevin kemsAún no hay calificaciones
- Parcial 1 - T1Documento1 páginaParcial 1 - T1Nicolas GalloAún no hay calificaciones
- Trababo Encarg Estequiometria 21-11Documento2 páginasTrababo Encarg Estequiometria 21-11Valentina VillegasAún no hay calificaciones
- Otros ExamnesDocumento9 páginasOtros ExamnesEliseo FloresAún no hay calificaciones
- Coloquio #3Documento3 páginasColoquio #3Mari Marisol RodriguezAún no hay calificaciones
- U4 Tarea 4 2023 2023 EstequiometríaDocumento2 páginasU4 Tarea 4 2023 2023 EstequiometríaRafaela ArroyoAún no hay calificaciones
- Parte I - 1º BachilleratoDocumento4 páginasParte I - 1º BachilleratoAntonioAún no hay calificaciones
- Taller 1 - EJERCICIOS RESUELTOSDocumento11 páginasTaller 1 - EJERCICIOS RESUELTOSPIERO ALESSANDRO ALFEREZ ABARCAAún no hay calificaciones
- Tutoría Regular 6Documento2 páginasTutoría Regular 6JacmAún no hay calificaciones
- Taller 2 Q1 2016-1Documento5 páginasTaller 2 Q1 2016-1Cristian MartinezAún no hay calificaciones
- Química Del Carbono - Acceso A La UniversidadDocumento39 páginasQuímica Del Carbono - Acceso A La Universidadcesar67% (3)
- Prueba de SuficienciaDocumento2 páginasPrueba de SuficienciaDaniela09876Aún no hay calificaciones
- Informe Trabajo Final 2023 - IiDocumento2 páginasInforme Trabajo Final 2023 - IiLEYLI YAHAIRA ZAPATA OROZCOAún no hay calificaciones
- Cartilla de Esteres y EpoxidosDocumento1 páginaCartilla de Esteres y EpoxidosPaniagua Murillo DavidAún no hay calificaciones
- Parcial Opu 2020 1Documento1 páginaParcial Opu 2020 1Jaquelyn Mantari EscobarAún no hay calificaciones
- QEyA ETS-Guiìa de EstudioDocumento10 páginasQEyA ETS-Guiìa de EstudioTed Gutierritos OrtizAún no hay calificaciones
- Fórmula Empírica y Molecular. de SelectividadDocumento2 páginasFórmula Empírica y Molecular. de SelectividadkamachaAún no hay calificaciones
- Ejercicios Estequiometria 2Documento2 páginasEjercicios Estequiometria 2María VRAún no hay calificaciones
- Guía de Ejercicios de Alcanos y Alquenos Y Propiedades ColigativasDocumento5 páginasGuía de Ejercicios de Alcanos y Alquenos Y Propiedades ColigativaslisshiAún no hay calificaciones
- GuiaQuímica Inorganica Ing QcaEd 2015Documento64 páginasGuiaQuímica Inorganica Ing QcaEd 2015Mirian VivarAún no hay calificaciones
- Quimica Del Carbono - Unidad 3 (Guia Especial Estequiometria)Documento9 páginasQuimica Del Carbono - Unidad 3 (Guia Especial Estequiometria)Martin CrispinoAún no hay calificaciones
- Taller Cálculos Químicos y Estequiometría.Documento16 páginasTaller Cálculos Químicos y Estequiometría.Ruben RamirezAún no hay calificaciones
- Quimica de Hidrocarburos 2013 SEgundo AprcialDocumento13 páginasQuimica de Hidrocarburos 2013 SEgundo AprcialCINL123Aún no hay calificaciones
- Ejercicios Misceláneos de QuímicaDocumento4 páginasEjercicios Misceláneos de QuímicaNatasha MirandaAún no hay calificaciones
- Ejercicios Site - GoogleDocumento2 páginasEjercicios Site - GoogleRicardo IbarraAún no hay calificaciones
- Química GeneralDocumento2 páginasQuímica GeneralFranchesco mendozaAún no hay calificaciones
- Separata 7 Q G CientificaDocumento2 páginasSeparata 7 Q G CientificaTatianaMachacaAún no hay calificaciones
- Ejercicio Balance GrupalDocumento19 páginasEjercicio Balance GrupalXimena Merma SAún no hay calificaciones
- Problemario Total 1 BDocumento6 páginasProblemario Total 1 BAnitaRodriguez0% (1)
- Quim General EjxDocumento9 páginasQuim General EjxCarlos Alfredo Rodriguez LoayzaAún no hay calificaciones
- CombustionDocumento10 páginasCombustionmei kimAún no hay calificaciones
- Ejercicios Repasar ExamenDocumento3 páginasEjercicios Repasar ExamenAnonymous CkgLp4X9Aún no hay calificaciones
- Practicas Realizadas PDFDocumento2 páginasPracticas Realizadas PDFNayrobi AcostaAún no hay calificaciones
- Guia N°7 - AlquinosDocumento2 páginasGuia N°7 - AlquinosNazareno LorenzattoAún no hay calificaciones
- Estequiometría 1Documento19 páginasEstequiometría 1Mercedes LOPEZ CARBAJALESAún no hay calificaciones
- Estequiometria 1 BachilleratorDocumento5 páginasEstequiometria 1 BachilleratorAlex LunaAún no hay calificaciones
- Guia Práctica #1 - EstequiometriaDocumento14 páginasGuia Práctica #1 - Estequiometriacolmega0% (1)
- BalanceDocumento8 páginasBalancedarloJD0% (1)
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Iones ActividadDocumento3 páginasIones ActividadAndrea SolerAún no hay calificaciones
- Pautas ObligatoriasDocumento1 páginaPautas ObligatoriasAndrea SolerAún no hay calificaciones
- Diagnostico Propiedades de La MateriaDocumento7 páginasDiagnostico Propiedades de La MateriaAndrea SolerAún no hay calificaciones
- Nivelacion Out 2021Documento16 páginasNivelacion Out 2021Andrea SolerAún no hay calificaciones
- Estados de Agregación de La MateriaDocumento3 páginasEstados de Agregación de La MateriaAndrea SolerAún no hay calificaciones
- Enlace Ionico y CovalenteDocumento8 páginasEnlace Ionico y CovalenteAndrea SolerAún no hay calificaciones
- Microscopio para CuadrosDocumento15 páginasMicroscopio para CuadrosAndrea SolerAún no hay calificaciones
- Cambios QuimicosDocumento8 páginasCambios QuimicosAndrea SolerAún no hay calificaciones
- Clasificacion de Reacciones QuimicasDocumento6 páginasClasificacion de Reacciones QuimicasAndrea SolerAún no hay calificaciones
- Diagnostico Ciencias NaturalesDocumento3 páginasDiagnostico Ciencias NaturalesAndrea Soler100% (1)
- Sistemas MaterialesDocumento10 páginasSistemas MaterialesAndrea SolerAún no hay calificaciones
- Proyecto Plan de Mejoras QuimicaDocumento6 páginasProyecto Plan de Mejoras QuimicaAndrea Soler100% (2)
- Constitución de Los Materiales y Cambios de EstadoDocumento8 páginasConstitución de Los Materiales y Cambios de EstadoAndrea SolerAún no hay calificaciones
- Integradora ReciclajeDocumento1 páginaIntegradora ReciclajeAndrea SolerAún no hay calificaciones
- Plan de Recuperacion de AprendizajesDocumento4 páginasPlan de Recuperacion de AprendizajesAndrea SolerAún no hay calificaciones
- Actividades de RecuperacionDocumento5 páginasActividades de RecuperacionAndrea SolerAún no hay calificaciones
- Química Del CarbonoDocumento2 páginasQuímica Del CarbonoAndrea SolerAún no hay calificaciones
- Evaluación FQ 3Documento1 páginaEvaluación FQ 3Andrea SolerAún no hay calificaciones
- Ev 3Documento2 páginasEv 3Andrea SolerAún no hay calificaciones