Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Paper 1 Depresion PDF
Paper 1 Depresion PDF
Cargado por
Carolina Leon HungTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Paper 1 Depresion PDF
Paper 1 Depresion PDF
Cargado por
Carolina Leon HungCopyright:
Formatos disponibles
REVISIÓN
Papel del sistema nervioso autónomo en la relación
entre depresión y enfermedad cardiovascular
R.G. García-Gómez a,b, P. López-Jaramillo b, C. Tomaz a
PAPEL DEL SISTEMA NERVIOSO AUTÓNOMO EN LA RELACIÓN
ENTRE DEPRESIÓN Y ENFERMEDAD CARDIOVASCULAR
Resumen. Introducción. Los resultados de varios estudios epidemiológicos han revelado que la depresión mayor está asocia-
da con un riesgo incrementado de desarrollar enfermedades cardiovasculares (ECV) y presentar complicaciones y nuevos
eventos en sujetos con ECV establecida. Los mecanismos fisiopatológicos responsables de este aumento del riesgo cardiovas-
cular en la depresión mayor aún no se han esclarecido. Desarrollo. El objetivo del presente trabajo es revisar la literatura
sobre los posibles mecanismos fisiopatológicos involucrados en la relación entre la depresión mayor y las ECV, con énfasis en
los estudios relacionados con disfunción autonómica cardiovascular y variabilidad de la frecuencia cardíaca. Asimismo, se
exponen hipótesis recientes acerca de los mecanismos neurales que subyacen en la disfunción autonómica en sujetos con
depresión mayor. Conclusiones. La evidencia disponible permite establecer la hipótesis de que sujetos con depresión mayor
presentan anormalidades en el funcionamiento de la red neuronal autonómica central, específicamente en el hipocampo, cor-
teza prefrontal y núcleos del tallo cerebral, que asociadas a la disminución de los niveles centrales de serotonina ocasionan
un predominio del flujo simpático y una pérdida del tono vagal cardíaco. La disfunción autonómica cardiovascular resultan-
te podría ser la causa principal del riesgo cardiovascular aumentado observado en la depresión mayor. En el futuro, el estu-
dio del sistema nervioso autónomo puede ser una herramienta útil en el desarrollo de nuevas estrategias terapéuticas enfoca-
das a disminuir la morbilidad y mortalidad cardiovascular en sujetos deprimidos. [REV NEUROL 2007; 44: 225-33]
Palabras clave. Depresión. Red neuronal autonómica central. Riesgo cardiovascular. Serotonina. Sistema nervioso autónomo.
Variabilidad de la frecuencia cardíaca.
INTRODUCCIÓN Asimismo, cada vez existen más evidencias de que los trastor-
El trastorno depresivo mayor (TDM) es una de las enfermeda- nos depresivos pueden modificar el pronóstico de estos pacien-
des mentales de mayor prevalencia en el mundo occidental y se tes. Se ha descrito que los sujetos con TDM presentan una tasa
convertirá, según datos de la Organización Mundial de la Salud, de mortalidad de dos a cuatro veces mayor después de un pri-
en la segunda causa de discapacidad en el mundo (después de la mer evento cardíaco [13-15].
enfermedad coronaria) en el año 2020 [1]. El TDM es una en- A pesar de la gran evidencia epidemiológica que soporta la
fermedad poco reconocida, mal diagnosticada y mal tratada. relación entre la depresión y las ECV, los mecanismos fisiopa-
Estudios realizados en Estados Unidos han demostrado que apro- tológicos de esta conexión permanecen poco conocidos. Las
ximadamente el 16,2% de la población sufre de depresión alteraciones en la función del sistema nervioso autónomo se han
mayor en algún momento de la vida, del cual, un tercio requiere postulado como una de las causas probables del riesgo cardio-
atención médica especializada por la perturbación de su entorno vascular aumentado en pacientes con depresión [16]. Diversos
familiar, laboral y social [2]. En los países en desarrollo, este autores han mostrado que los síntomas depresivos están asocia-
trastorno constituye el cuarto problema de salud más importan- dos con aberraciones en la regulación autonómica cardíaca, ca-
te, con una morbilidad total aproximada del 3,4% [3]. racterizadas por una actividad simpática aumentada y un tono
La depresión mayor se ha asociado fuertemente con un ries- parasimpático disminuido, que aumentan el riesgo de isquemia
go aumentado de desarrollar enfermedades cardiovasculares miocárdica, taquicardia ventricular, fibrilación ventricular y muer-
(ECV) [4-11]. La prevalencia del TDM en pacientes con enfer- te cardíaca súbita [17-19].
medad coronaria es aproximadamente del 18% y afecta anual- Recientemente, diversos estudios fisiológicos han sugerido
mente a millones de personas con trastornos cardiovasculares [12]. la hipótesis que el desequilibrio autonómico observado en los
sujetos con depresión mayor puede ser el resultado de alteracio-
Aceptado tras revisión externa: 30.10.06. nes en los circuitos autonómicos centrales, específicamente de
a
Laboratorio de Neurociencias y Comportamiento. Departamento de Cien- una desinhibición de circuitos neurales excitatorios simpáticos
cias Fisiológicas. Instituto de Biología. Universidad de Brasilia. Brasilia, que se encuentran bajo control inhibitorio tónico por parte de la
DF, Brasil. b Laboratorio de Fisiología Autonómica Cardiovascular. Instituto
de Investigaciones. Fundación Cardiovascular de Colombia. Floridablan- corteza prefrontal (CPF), estructura afectada en los sujetos con
ca, Colombia. TDM [16,20].
Correspondencia: Dr. Carlos Tomaz. Laboratorio de Neurociencias y Com-
portamiento. Departamento de Ciencias Fisiológicas. Instituto de Biología.
Universidad de Brasilia. Brasilia, DF, Brasil. CEP 70910-900. Fax: 61-32 OBJETIVO
741 251. E-mail: ctomaz@unb.br
En el presente trabajo se realiza una revisión de la bibliografía
Estudio financiado por el Instituto para el Desarrollo de la Ciencia y Tec- científica disponible sobre los posibles mecanismos fisiopatoló-
nología en Colombia (Colciencias), proyecto n.º 6566-04-16494, y por la
Fundação de Empreendimentos Científicos e Tecnológicos (FINATEC, Bra- gicos que explicarían la relación entre la depresión mayor y las
sil). RGGG recibió una beca de doctorado por parte de la Coordenação de ECV, con énfasis en los estudios de disfunción autonómica car-
Aperfeiçoamento de Pessoal de Nível Superior (CAPES). diovascular y variabilidad de la frecuencia cardíaca (VFC). Asi-
© 2007, REVISTA DE NEUROLOGÍA mismo, se exponen recientes hipótesis sobre los mecanismos
REV NEUROL 2007; 44 (4): 225-233 225
R.G. GARCÍA-GÓMEZ, ET AL
neurales que subyacen la disfunción autonómica en sujetos con BASES NEUROFISIOLÓGICAS: SISTEMA
depresión mayor. SEROTONINÉRGICO Y SISTEMA NERVIOSO
AUTÓNOMO CARDIOVASCULAR
Múltiples estudios han sugerido que la actividad central seroto-
EPIDEMIOLOGÍA DE LA RELACIÓN ninérgica influye de manera importante sobre el control del sis-
ENTRE LA DEPRESIÓN Y LA tema cardiovascular, específicamente en la regulación de la pre-
ENFERMEDAD CARDIOVASCULAR sión arterial y la frecuencia cardíaca [34,35]. Las principales
La depresión mayor se ha asociado fuertemente a una mayor vías serotoninérgicas tienen su origen en los núcleos del rafe en
morbilidad y mortalidad de origen cardiovascular [4-15]. Varios el tronco encefálico. Células de las partes rostrales de estos nú-
estudios han demostrado que la depresión puede aumentar el cleos se proyectan para el prosencefalo mientras que las células
riesgo de un individuo de padecer aterosclerosis, arritmias, in- de la parte caudal de los núcleos del rafe se proyectan a la mé-
farto agudo de miocardio, enfermedad cerebrovascular, fallo dula espinal.
cardíaco y muerte súbita [5-11]. Esta asociación se ha identifi- En las zonas involucradas en el control autonómico cardio-
cado en sujetos deprimidos con y sin enfermedad cardíaca sub- vascular (núcleo del tracto solitario, área ventrolateral vasopre-
yacente y ha mostrado ser independiente del uso de medica- sora y región hipotálamica anterior preóptica), se ha identifica-
mentos antidepresivos [21]. La depresión también se ha relacio- do una densa población de neuronas serotoninérgicas [36]. Las
nado con conocidos factores de riesgo cardiovascular como proyecciones ascendentes del núcleo del tracto solitario trans-
hipertensión esencial [22], diabetes mellitus [23], resistencia a miten información visceral a núcleos superiores y establecen
la insulina [24] y dislipidemia [25]. Además, algunas conductas conexiones con la formación reticular, hipotálamo, amígdala,
asociadas al riesgo cardiovascular como el tabaquismo y el se- sistema límbico, córtex cerebral insular y soméstesico. Estas es-
dentarismo también se han encontrado con mayor frecuencia en tructuras constituyen colectivamente la red neuronal autonómi-
los sujetos deprimidos [26,27]. ca central, que es la encargada de elaborar las respuestas inte-
Del espectro de ECV relacionadas con la depresión mayor, gradas de control visceral, entre ellas el control de la frecuencia
se ha descrito una asociación particularmente robusta con la cardíaca y la presión arterial [37]. La propuesta de que la sero-
enfermedad coronaria. En diversos estudios poblacionales se ha tonina está involucrada en la regulación central del sistema ner-
descrito un riesgo incrementado de desarrollar arteriosclerosis vioso autónomo se apoya en experimentos realizados en anima-
coronaria en sujetos con TDM [5-8]. Pratt et al [7], en un estu- les que involucran específicamente los receptores 5-HT1 en el
dio prospectivo realizado en 1.551 personas sin ECV con un núcleo del tracto solitario. En estos estudios se observó que la
seguimiento de 14 años, encontraron que el antecedente del TDM inyección intracerebral de serotonina y agonistas serotoninérgi-
aumentaba el riesgo de presentar un infarto agudo de miocardio cos produjo una disminución abrupta de la frecuencia cardíaca,
4,54 veces (IC 95%: 1,65-12,44) en comparación con sujetos no la presión arterial y la actividad simpática en los animales ex-
deprimidos. Esta asociación fue independiente de otros factores puestos [34]. Asimismo, cuando la síntesis de serotonina en el
de riesgo cardiovasculares conocidos. Además, Barefoot et al sistema nervioso central de ratas se bloqueó con p-clorofenila-
[6], en un estudio prospectivo realizado durante 27 años de se- lanina, se anuló la fase de hipotensión en respuesta a una hemo-
guimiento en una muestra comunitaria de hombres y mujeres rragia. Se conoce ampliamente que esta fase de hipotensión está
daneses, describieron una correlación directa entre la gravedad mediada por estímulos vagales, lo que sugiere que la serotonina
de los síntomas depresivos y el aumento del riesgo de presentar cumple un papel fundamental en la regulación del tono vagal
un infarto agudo de miocardio. Un reciente metaanálisis [8] que [35]. La actividad serotoninérgica central también se ha impli-
incluyó la revisión de 10 estudios de cohorte realizados en suje- cado en la génesis de la respuesta vagal exagerada observada en
tos con depresión, sin enfermedades concomitantes y con un pacientes con síncope neurocardiogénico [38,39].
seguimiento mayor a cuatro años, concluyó que la depresión El mantenimiento del tono vagal cardíaco ejercido por la se-
presenta un riesgo relativo global de 1,64 (IC 95%: 1,41-1,90) rotonina podría explicarse por su acción directa sobre los re-
para la presentación de enfermedad coronaria. Esta relación fue ceptores 5-HT1, lo que disminuye la presión arterial y la fre-
independiente de la presencia de otros factores de riesgo tradi- cuencia cardíaca, por la estimulación de terminales nerviosas
cionales como diabetes mellitus e hipertensión. colinérgicas posganglionares o ganglios cardíacos vagales vía
El TDM también se ha propuesto como un factor de riesgo receptores 5-HT3, y por una inhibición presináptica de la activi-
independiente para la recurrencia de eventos cardíacos en suje- dad simpática [40-42].
tos con ECV establecida [13-15,28-31]. Aproximadamente el Una disponibilidad reducida de serotonina (5-HT) en el sis-
18% de los sujetos diagnosticados con enfermedad coronaria tema nervioso central se ha implicado en el proceso fisiopatoló-
sin síndrome coronario agudo, cumple criterios para el TDM gico de la depresión [43]. Se ha descrito una disminución en los
[12] y su prevalencia es similar en el infarto agudo de miocardio niveles de serotonina y metabolitos de serotonina en el tejido
[28] y en los sujetos hospitalizados por insuficiencia cardíaca cerebral, así como en el líquido cefalorraquídeo en pacientes
congestiva [32]. Comparados con los sujetos no deprimidos, los con depresión sin tratamiento [44]. Los datos encontrados en
pacientes con TDM están expuestos a un riesgo un 72% mayor estudios experimentales sugieren la hipótesis de que en sujetos
de muerte por eventos cardiovasculares hasta 10 años después con TDM la reducción crónica de los niveles centrales de sero-
del diagnóstico de enfermedad coronaria. Este riesgo es inde- tonina puede llevar a la interrupción de sus efectos inhibitorios
pendiente de otros factores como la gravedad inicial de la enfer- sobre las áreas simpáticas centrales y a una disminución del to-
medad y el tratamiento recibido [15]. Un incremento similar del no vagal cardíaco. La regulación del sistema nervioso autóno-
riesgo se ha observado en pacientes con angina inestable [30], mo está determinada por el equilibrio dinámico entre el sistema
insuficiencia cardíaca congestiva [31] y después de cirugía co- nervioso simpático y parasimpático en respuesta a estímulos
ronaria [33]. externos. La alteración de este delicado equilibrio se ha asocia-
226 REV NEUROL 2007; 44 (4): 225-233
DEPRESIÓN Y RIESGO CARDIOVASCULAR
el sistema nervioso simpático, lo que desencadena
un estado de disfunción autonómica caracterizado
por una pérdida del tono vagal, una disminución de
la variabilidad de la frecuencia cardíaca (VFC) y un
mayor riesgo de desarrollar trastornos cardiovascu-
lares (Fig. 1).
EJE HIPOTÁLAMO-HIPÓFISIS-GLÁNDULA
ADRENAL Y RESPUESTA AL ESTRÉS
El eje hipotálamo-hipófisis-glándula adrenal (HHA)
es un sistema involucrado en las respuestas fisioló-
gicas al estrés. En respuesta a estímulos estresantes,
las neuronas del núcleo paraventricular del hipotá-
lamo secretan el factor liberador de corticotropina
(CRF) al sistema portahipofisiario. El CRF se trans-
porta luego a la hipófisis anterior y promueve la li-
beración de la hormona adrenocorticotropa (ACTH),
la cual controla la secreción de cortisol y, junto con
el sistema nervioso simpático, la liberación de cate-
colaminas (Fig. 2). Los glucocorticoides adrenales
modulan la actividad del eje HHA mediante retroali-
mentación a la hipófisis, hipocampo e hipotálamo.
El CRF también actúa como neurotransmisor en el
sistema nervioso central y coordina algunas de las
respuestas inmunes, endocrinas, autonómicas y com-
portamentales al estrés [50].
Gran cantidad de evidencias demuestran la hi-
peractividad del eje HHA en pacientes con TDM sin
tratamiento [50,51]. Esta actividad se ve reflejada
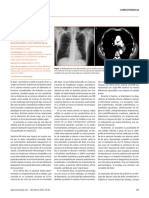
Figura 1. Papel de la red autonómica central en la disfunción autonómica cardiovascu- en: concentraciones elevadas de CRF en el líquido
lar de sujetos con depresión mayor. CPF: corteza prefrontal; NTS: núcleo del tracto soli- cefalorraquídeo, respuesta disminuida de la ACTH a
tario; VFC: variabilidad de la frecuencia cardíaca.
la administración de CRF, no supresión de la secre-
ción de cortisol en respuesta a dexametasona, hiper-
do a una mayor morbilidad y mortalidad [45]. Así, un estado de cortisolemia, crecimiento glandular hipofisiario y adrenal, y
alarma o estrés prolongado ocasionado por emociones negati- aumento del número de neuronas CRF hipotalámicas en el teji-
vas, como en la depresión mayor, puede colocar una demanda do post mortem de pacientes deprimidos en comparación con
excesiva de energía en el sistema y causar una disfunción [46]. los controles [52]. La hiperactividad del eje HHA puede ser uno
de los factores clave en la patogénesis de las ECV en sujetos con
TDM (Fig. 2). Las concentraciones elevadas de cortisol pro-
CORTEZA PREFRONTAL mueven los trastornos del metabolismo de los lípidos como hi-
Otro componente de la red neuronal autonómica central que se percolesterolemia e hipertrigliceridemia, y aceleran el daño a la
ha implicado en la regulación del sistema cardiovascular es la íntima y a las células endoteliales vasculares, y el desarrollo de
CPF [47]. La CPF tiene múltiples conexiones con áreas involu- aterosclerosis e hipertensión [53].
cradas en el control de la función autonómica como el hipotála- La hiperactividad del eje HHA lleva secundariamente a una
mo, el núcleo del tracto solitario, la sustancia periacueductal, la actividad exagerada del sistema simpatoadrenal a través de las
médula ventrolateral, la amígdala, el giro cingulado anterior y el vías regulatorias centrales. El CRF estimula el flujo simpático
giro parahipocampal. Estas áreas se proyectan a la columna in- mediante conexiones extrahipotalámicas a varios componentes
termedio-lateral de la médula espinal, la cual inerva los órganos centrales del sistema nervioso autónomo [54]. La hiperactivi-
autónomos periféricos [48]. Se ha propuesto que la CPF ejerce dad del sistema simpatoadrenal se ha documentado en el TDM
una inhibición tónica sobre los circuitos excitatorios simpáticos por una elevación en los niveles plasmáticos y urinarios de nor-
del tallo cerebral [47]. Bajo situaciones normales de estrés, la epinefrina y sus metabolitos [55,56]. Las elevadas concentra-
CPF se torna hipoactiva, lo cual permite un predominio del tono ciones de catecolaminas contribuyen al aumento del riesgo car-
simpático necesario para reacciones fisiológicas de alarma. diovascular en sujetos con TDM a través de diversos efectos.
En depresión unipolar y bipolar, los estudios con tomografía Así, la norepinefrina y la epinefrina actúan en los receptores β-
por emisión de positrones y resonancia magnética funcional han adrenérgicos cardíacos mediante el aumento de la frecuencia
sugerido una posible anormalidad anatómica en la CPF ventral cardíaca y la contractilidad del músculo cardíaco en sujetos con
al cuerpo calloso, asociada además a una disminución en el TDM [57]; además, producen vasoconstricción, lo que aumenta
tamaño y la actividad neuronal [49]. Así, existen datos suficien- el estrés de rozamiento en el endotelio vascular. Las elevaciones
tes para establecer la hipótesis de que los sujetos con TDM pre- de la frecuencia cardíaca y de la presión arterial están asociadas
sentan una pérdida de los procesos inhibitorios de la CPF sobre directamente con un aumento del riesgo de muerte súbita, is-
REV NEUROL 2007; 44 (4): 225-233 227
R.G. GARCÍA-GÓMEZ, ET AL
quemia del miocardio, arritmias e insuficien-
cia cardíaca congestiva [58].
Los niveles aumentados de catecolaminas
aumentan también la agregación plaquetaria
e incrementan el riesgo de trombosis corona-
ria e isquemia del miocardio [59,60]. Ade-
más, la hiperactividad del sistema noradre-
nérgico ejerce un efecto inhibitorio sobre la
síntesis de eicosanoides vasculares, lo que blo-
quea las acciones de prostaglandinas y leuco-
trienos sobre la inhibición de la agregación
plaquetaria, la permeabilidad y la contracción
vascular [59,61].
DEPRESIÓN MAYOR
Y FUNCIÓN AUTONÓMICA
Entre los síntomas clínicos que sugieren la
existencia de disfunción autonómica en la
depresión mayor se encuentran las alteracio-
nes en el sueño, el apetito, la temperatura, el
deseo sexual, la sudoración, así como las pa-
restesias gastrointestinales [62,63]. El exa-
men clínico de esta sintomatología puede re-
sultar difícil y subjetivo. Sin embargo, se han
desarrollado diversas baterías de pruebas y
procedimientos para la detección de la dis-
función autonómica de una forma más fiable
y reproducible, como la evaluación de la fun-
ción sudomotora, la función pupilar y del sis-
tema autónomo cardiovascular [64,65].
La mayoría de los resultados obtenidos en
estudios fisiológicos de evaluación de la fun-
ción autonómica en sujetos con depresión
mayor apoyan la hipótesis de un tono simpá-
tico incrementado y una función parasimpáti- Figura 2. Interacción entre la hiperactividad del eje hipotálamo-hipófisis-glándula adrenal y el
ca disminuida [17-19,55,66]. Guinjoan et al aumento del riesgo cardiovascular en la depresión mayor. ACTH: hormona adrenocorticotropa;
CRF: factor liberador de corticotropina.
[66], en un estudio realizado en pacientes de-
primidos sin patología cardiovascular, encon-
traron una amplitud de la respuesta simpaticocutánea significa- barorreflejo cardíaco muestra un equilibrio entre la actividad
tivamente aumentada en comparación con controles sanos simpática y vagal para el mantenimiento de una presión arterial
durante el ortostatismo y en la realización de la prueba de ejer- adecuada. Cuando ocurre un incremento agudo de la presión
cicio isométrico (handgrip), lo que sugiere una actividad simpá- arterial, la actividad vagal aumenta y la actividad eferente sim-
tica incrementada en estos sujetos. En contraste, en estudios de pática se reduce, lo que ocasiona una reducción de la frecuencia
función pupilar, los resultados no han sido concluyentes; algunos cardíaca y el tono arterial, mientras que cuando la presión arte-
informes muestran alteraciones en la pupilometría de pacientes rial disminuye ocurre el mecanismo contrario [68]. Una sensibi-
deprimidos en respuesta al reflejo pupilar a la luz después de lidad barorrefleja alterada se ha asociado a un mayor riesgo de
recibir el tratamiento antidepresivo, pero sin alteraciones en los presentar arritmias ventriculares y muerte cardíaca súbita [69].
sujetos deprimidos sin intervención farmacológica [67]. El barorreflejo arterial es una herramienta útil para el estu-
Los resultados más consistentes se han encontrado con la dio de los mecanismos de control cardiovascular. La sensibili-
realización de pruebas de función autonómica cardiovascular, dad de los barorreceptores puede estudiarse mediante el análisis
que constituyen la principal herramienta de estudio de la rela- de la relación entre fluctuaciones espontáneas en la frecuencia
ción entre depresión y riesgo cardiovascular. Estas pruebas com- cardíaca y la presión arterial en condiciones de reposo o con el
prenden, entre otras, el estudio de la sensibilidad barorrefleja, el llamado método de Oxford, que implica la manipulación de la
intervalo QT y la VFC. presión arterial mediante la aplicación endovenosa de fenilefri-
na, lo que produce un rápido incremento en la presión arterial y
Sensibilidad barorrefleja una bradicardia refleja [64].
Los barorreceptores arteriales son mecanorreceptores localiza- Recientemente, Broadley et al [70] evidenciaron una sensibi-
dos en el arco aórtico y en el seno carotídeo, que sirven para lidad barorrefleja disminuida en los pacientes deprimidos sin en-
regular la presión arterial mediante cambios rápidos en la fre- fermedad cardiovascular que habían recibido un tratamiento
cuencia y contracción cardíacas y en la capacitancia venosa. El efectivo para su sintomatología depresiva. Esta sensibilidad ba-
228 REV NEUROL 2007; 44 (4): 225-233
DEPRESIÓN Y RIESGO CARDIOVASCULAR
rorrefleja disminuida se asoció con una frecuencia cardíaca y [82]. En sujetos sanos es común encontrar un alto grado de va-
presión arterial elevadas en el grupo de los sujetos deprimidos en riabilidad de la frecuencia cardíaca [82], mientras que esta varia-
comparación con el grupo control, lo que sugería un tono simpá- bilidad se encuentra disminuida en pacientes con enfermedad
tico aumentado. Previamente se habían descrito hallazgos simi- coronaria grave, insuficiencia cardíaca congestiva o infarto agu-
lares en grupos de pacientes depresivos con enfermedad corona- do de miocardio [83]. Además, una VFC disminuida se ha rela-
ria y en pacientes postinfarto agudo de miocardio [71,72]. En cionado con una mayor mortalidad en pacientes con un infarto
uno de estos estudios, Pitzalis et al [71] describieron una reduc- agudo de miocardio reciente [83,84], enfermedad coronaria es-
ción en el control barorreflejo cardíaco en pacientes postinfarta- table [85] e insuficiencia cardíaca congestiva [86].
dos; sin embargo, esta asociación no se encontró en aquellos pa- Pueden existir también variaciones de la VFC ocasionadas
cientes que estaban recibiendo β-antagonistas, lo que sugiere que por numerosos factores fisiológicos y farmacológicos, y que no
la actividad aumentada del sistema nervioso simpático es un fac- constituyen hallazgos de significancia patológica. Los valores
tor preponderante en la alteración de la sensibilidad barorrefleja de la VFC pueden variar de acuerdo a factores como la edad del
en la depresión y posiblemente en el desencadenamiento de paciente [87-89], el género [89], la raza [87], el índice de masa
complicaciones cardiovasculares en este tipo de pacientes. corporal [90], la fase del ciclo menstrual [90], el grado de acti-
vidad física [91], la postura corporal [92] y el ritmo circadiano
Intervalo QT [93]. Asimismo, un gran número de medicamentos altera el fun-
El intervalo QT del electrocardiograma de superficie refleja la cionamiento del sistema nervioso autónomo y, por consiguien-
repolarización del miocardio ventricular. Una prolongación o te, la VFC, como los β-bloqueadores [94], la propafenona [95]
una variabilidad aumentada del intervalo QT se han asociado y la amiodarona [96], entre otros.
con una mayor ocurrencia de arritmias ventriculares y muerte La VFC se valora generalmente mediante dos tipos de técni-
súbita [73,74]. El sistema nervioso autónomo modula la dura- cas, el análisis en dominio de tiempo y el análisis en dominio de
ción de la repolarización ventricular y se ha demostrado que frecuencia. Para obtener las variables de VFC en dominio de
una actividad aumentada del sistema nervioso simpático se rela- tiempo, por lo general se emplean registros electrocardiográfi-
ciona con un incremento en la variabilidad del intervalo QT en cos de largos períodos (p. ej., 24 h). En este método se calculan
sujetos sanos [75,76]. medidas estadísticas como la media, la varianza y la desviación
Rainey et al [77] evidenciaron una prolongación significati- estándar de los intervalos entre ondas R sucesivas de una señal
va del intervalo QT en pacientes deprimidos en comparación electrocardiográfica [81]. Por otro lado, las variables en domi-
con los sujetos con diagnóstico de trastorno por abuso de sus- nio de frecuencia se obtienen por métodos geométricos median-
tancias y controles sanos. Esta asociación fue independiente del te el análisis espectral de registros electrocardiográficos de lar-
uso de antidepresivos tricíclicos. Posteriormente, los estudios go o corto plazo. Las principales variables calculadas son el
que evalúan la variabilidad del QT han confirmado la presencia poder de baja frecuencia (LF: 0,04-0,15 Hz) y el de alta fre-
de alteraciones en la repolarización ventricular en sujetos con cuencia (HF: 0,15-0,4 Hz). El componente HF corresponde a la
depresión mayor y con trastorno de pánico [78,79], y han mos- arritmia sinusal respiratoria y refleja principalmente la función
trado además que existe una correlación directa entre la grave- cardíaca vagal, mientras que el componente LF está influido por
dad de la sintomatología depresiva y la variabilidad del interva- la regulación de la presión arterial mediada por barorreceptores
lo QT [78]. Carney et al [80] evaluaron la variabilidad del QT y refleja tanto la actividad simpática como la parasimpática
en sujetos postinfartados depresivos en comparación con con- [81]. Para la realización de una determinación adecuada de la
troles pareados por sexo y edad. Se evaluó a los sujetos durante VFC es recomendable el análisis de una señal electrocardiográ-
24 horas con un registro electrocardiográfico ambulatorio en el fica con una duración mínima de cinco minutos tomada en de-
primer mes después de ocurrido el infarto de miocardio. Los pa- cúbito supino. Otras pruebas necesarias para la determinación
cientes con otro tipo de enfermedad cardiovascular o bajo trata- del equilibrio simpatovagal cardíaco son el análisis de la VFC
miento con antidepresivos tricíclicos o inhibidores de la mo- durante el ortostatismo y en respuesta a respiración profunda o
noaminooxidasa se excluyeron del estudio. Los autores encon- bien durante cambios de la presión intratorácica (maniobra de
traron una variabilidad del QT aumentada en ausencia de altera- Valsalva) [65].
ciones en la frecuencia cardíaca o VFC, por lo que propusieron
que la elevada mortalidad observada en sujetos deprimidos des- Depresión, variabilidad de la frecuencia
pués de un infarto agudo de miocardio puede relacionarse con cardíaca y riesgo cardiovascular
la alta ocurrencia de arritmias cardíacas debido a alteraciones Múltiples estudios han demostrado una asociación significativa
en el tiempo de repolarización ventricular. entre la depresión y una baja VFC en pacientes con enfermedad
coronaria estable o infarto agudo de miocardio [17,19,23,97],
Variabilidad de la frecuencia cardíaca lo que sugiere que las alteraciones en la regulación autonómica
El estudio de la VFC representa un método útil, económico, sen- cardíaca pueden contribuir al incremento del riesgo de eventos
sible y no invasivo en la valoración de la función autonómica cardiovasculares y mortalidad en pacientes deprimidos después
cardíaca [81]. La variabilidad latido a latido en el ritmo cardía- de un infarto de miocardio. Stein et al [17] evaluaron, en 40 pa-
co está determinada por el efecto modulatorio del sistema ner- cientes con enfermedad coronaria estable y depresión, la VFC
vioso autónomo sobre el marcapasos cardíaco como respuesta a mediante la monitorización electrocardiografía ambulatoria de
fluctuaciones hemodinámicas y otras perturbaciones fisiológi- 24 h y encontraron un aumento en la frecuencia cardíaca y una
cas. La VFC permite determinar el equilibrio entre la actividad disminución en los índices de VFC en aquellos sujetos con de-
simpática y parasimpática en el control del ritmo cardíaco. Una presión de intensidad moderada a grave en comparación con los
VFC disminuida está determinada por un tono parasimpático sujetos con patología coronaria sin depresión. Esta asociación
disminuido o una hiperactividad del sistema nervioso simpático no fue significativamente estadística en los pacientes con depre-
REV NEUROL 2007; 44 (4): 225-233 229
R.G. GARCÍA-GÓMEZ, ET AL
sión leve. Previamente, Krittayaphong et al [19] habían demos- lógicas de esta asociación pueden conducir a la alteración del
trado una correlación inversa entre la gravedad de la depresión y funcionamiento del sistema cardiovascular de sujetos con de-
la VFC en los sujetos con enfermedad coronaria. Los pacientes presión.
con puntuaciones altas en la escala Minnesota Multiphasic Per- La presencia de una respuesta fisiológica alterada al estrés
sonality Inventory-Depression (MMPI-D) mostraron una menor cotidiano en sujetos con TDM, caracterizada por la hiperactivi-
VFC en comparación con los sujetos con puntuaciones bajas, lo dad del sistema nervioso simpático y del eje HHA, podría ser el
que sugería la existencia de una relación directa entre la intensi- factor desencadenante del mayor riesgo cardiovascular en estos
dad de los síntomas depresivos y el grado de disfunción autonó- pacientes, a pesar de una función autonómica cardiovascular
mica en estos pacientes. Se han descrito resultados similares en normal en condiciones de reposo. Esto explicaría los resultados
pacientes con infarto agudo de miocardio independientemente controvertidos en el estudio de la VFC en reposo en sujetos con
de la edad y el género de los sujetos estudiados [23]. Asimismo, depresión, a diferencia de la consistencia de los hallazgos de
una baja VFC se ha asociado con una mayor tasa de mortalidad estudios que muestran una disminución de la VFC en respuesta
postinfarto [97]. En un estudio realizado en 311 sujetos depri- a estrés psicológico [55,103]. Light et al [55] estudiaron la fun-
midos con un infarto de miocardio reciente en comparación con ción autonómica cardiovascular de 60 mujeres con edades entre
367 pacientes infartados no deprimidos durante un período de 18 y 49 años sin ECV y encontraron que aquellas con mayores
seguimiento de 30 meses, se observó un riesgo 2,8 veces mayor puntuaciones de sintomatología depresiva en el inventario para
(IC 95%: 1,4-5,4) de mortalidad en los pacientes deprimidos en depresión de Beck presentaron una menor VFC y una mayor
comparación con aquellos sin sintomatología depresiva, con una concentración de norepinefrina plasmática en respuesta a una
proporción de riesgo atribuible a una baja VFC de 0,27 (IC 95%: prueba de estrés psicológico. Posteriormente, estos datos se re-
0,23-0,31) [97]. plicaron para ambos géneros por Hughes et al [103], quienes
Aunque la relación entre una VFC disminuida y la depre- encontraron una reducción del tono parasimpático cardíaco du-
sión en individuos con ECV se ha demostrado claramente, esta rante la exposición de estudiantes con sintomatología depresiva
asociación no ha sido totalmente establecida en pacientes depri- a una prueba de estrés mental. Estos resultados, aunque signifi-
midos sin patología cardíaca. Existen numerosos estudios que cativos, carecen aún de solidez para afirmar que el TDM se aso-
describen una reducción de la VFC en pacientes con TDM sin cia con una disminución de la VFC en respuesta a estrés psico-
patología cardiovascular [98-100]. Sin embargo, estos resulta- lógico, debido a que no se realizó un diagnóstico de depresión
dos son conflictivos en relación con otros estudios que no mues- mayor en los sujetos participantes, sino que se utilizaron pun-
tran diferencias en la VFC en sujetos con TDM en comparación tuaciones de escalas para la sintomatología depresiva como pa-
con controles sanos [101,102]. Estos resultados divergentes po- rámetro para su diferenciación entre casos y controles.
drían explicarse por las diferentes técnicas de medición de la
VFC, por diferencias en las características de los sujetos es- Efectos del tratamiento antidepresivo sobre
tudiados, como la edad y el género, por los distintos criterios la variabilidad de la frecuencia cardíaca
diagnósticos para la depresión o por diferencias en la gravedad La asociación directa encontrada entre la gravedad de la depre-
de los síntomas depresivos y la presencia o ausencia de medica- sión y la alteración del tono autonómico cardiovascular en suje-
ción antidepresiva. tos con TDM hacen suponer que la mejoría de la sintomatología
depresiva puede dar como resultado el incremento de la modula-
Variabilidad de la frecuencia cardíaca ción vagal de la frecuencia cardíaca y, por consiguiente, un au-
en respuesta al estrés psicológico mento de la VFC. De hecho, existen evidencias que muestran
Los resultados más consistentes se han encontrado en el estudio que el tratamiento efectivo de la depresión se acompaña de un
de la VFC en sujetos deprimidos en respuesta a pruebas de es- incremento significativo de la VFC [110-114]. Los inhibidores
trés psicológico [55,103]. El estrés mental es un importante pro- selectivos de recaptación de serotonina se han recomendado es-
vocador de disfunción ventricular izquierda e isquemia mio- pecialmente en pacientes con ECV y TDM debido a su perfil no
cárdica en pacientes con enfermedad arterial coronaria [104]. cardiotóxico y a que en algunos estudios han mostrado un efec-
Igualmente, las anormalidades del movimiento de la pared car- to positivo sobre la VFC [110,111]. Por ejemplo, McFarlane et
díaca inducidas por el estrés en sujetos con enfermedad corona- al [110], en un ensayo clínico aleatorizado controlado con pla-
ria se han asociado con un riesgo tres veces mayor de presentar cebo que incluyó a 27 sujetos deprimidos postinfartados, de-
nuevos eventos cardiovasculares en comparación con los pa- mostraron que la administración de sertralina de forma continua
cientes sin estrés [105]. Además de las alteraciones de la movi- se asociaba con aumento de la VFC y su retorno a valores simi-
lidad cardíaca y vasoconstricción coronaria, el estrés puede lares a los observados en pacientes sin enfermedad coronaria.
aumentar la hiperactividad del sistema HHA, el sistema nervio- Otros tratamientos que han mostrado mejorar la VFC en sujetos
so simpático y, por consiguiente, los efectos deletéreos de estos deprimidos han sido la terapia electroconvulsiva [112] y la tera-
sistemas sobre el aparato cardiovascular [106]. Existe una gran pia comportamental [113]. El efecto beneficioso sobre la VFC
cantidad de evidencias que sugiere que el estrés puede ser un de los distintos tipos de tratamientos antidepresivos se ha aso-
factor primordial en la aparición y evolución de los trastornos ciado directamente a la remisión de los síntomas depresivos en
depresivos [107]. En estudios con grandes muestras clínicas, las los pacientes tratados. Por otro lado, a pesar de una reducción
experiencias vitales estresantes se han correlacionado con una similar en la sintomatología depresiva, el uso de antidepresivos
mayor probabilidad de desarrollar TDM y presentar una mayor tricíclicos ha mostrado tener efectos deletéreos sobre el sistema
frecuencia de recaídas y resistencia al tratamiento antidepresivo cardiovascular, aumentando la frecuencia cardíaca y disminu-
[108,109]. Estos datos apoyan la idea de que el desencadena- yendo la VFC de pacientes con TDM, esto probablemente debi-
miento y mantenimiento del TDM se encuentra estrechamente do a sus efectos colaterales anticolinérgicos [114], por lo que su
ligado a experiencias estresantes y que las consecuencias fisio- uso no se recomienda en pacientes con ECV y TDM.
230 REV NEUROL 2007; 44 (4): 225-233
DEPRESIÓN Y RIESGO CARDIOVASCULAR
CONCLUSIONES tema nervioso simpático y una alteración de la regulación del to-
Los resultados de múltiples estudios permiten establecer la hipó- no vagal cardíaco en pacientes con depresión. El estudio de la
tesis que alteraciones en la red neuronal autonómica central y sus función autonómica cardiovascular es una herramienta funda-
diferentes conexiones con el sistema nervioso autónomo periféri- mental en el esclarecimiento de los mecanismos fisiopatológicos
co son las responsables por un mayor riesgo cardiovascular en que subyacen al incremento del riesgo cardiovascular en la de-
sujetos con depresión mayor. Específicamente, las anormalida- presión mayor. Su relativo bajo costo, sensibilidad y aplicación
des en el funcionamiento del hipocampo, la corteza prefrontal y no invasiva lo establecen como un método indispensable para la
los núcleos del tallo cerebral asociadas a una disminución en los realización de estudios de pronóstico y para el desarrollo de nue-
niveles de serotonina en el sistema nervioso central se han postu- vas estrategias terapéuticas enfocadas a disminuir la morbilidad
lado como la causa principal de una actividad aumentada del sis- y la mortalidad cardiovascular en los sujetos deprimidos.
BIBLIOGRAFÍA
1. Murray CJL, López AD. The global burden of disease: a comprehen- 22. Wells KB, Rogers W, Burnam A, Greenfield S, Ware JE. How the med-
sive assessment of mortality and disability from diseases, injuries, and ical comorbidity of depressed patients differs across health care set-
risk factors in 1990 and projected to 2020. Cambridge, MA: Harvard tings: results from the Medical Outcomes Study. Am J Psychiatry
University Press; 1996. 1991; 148: 1688-96.
2. Kessler R, Berglund P, Delmenr O, Jin R, Koretz D, Merikangas K, et 23. Patten SB, Beck CA, Kassam A, Williams JV, Barbui C, Metz LM.
al. The epidemiology of major depressive disorder. Results from the Long-term medical conditions and major depression: strength of asso-
National Comorbidity Survey Replication (NCS-R). JAMA 2003; 289: ciation for specific conditions in the general population. Can J Psychi-
3095-105. atry 2005; 50: 195-202.
3. Gómez-Restrepo C, Bohórquez A, Pinto D, Gil J, Rondón M, Díaz- 24. Winokur A, Maislin G, Phillips JL, Amsterdam JD. Insulin resistance
Granados N. Prevalencia de depresión y factores asociados con ella en after oral glucose tolerance testing in patients with major depression.
la población colombiana. Rev Panam Salud Publica 2004; 16: 378-86. Am J Psychiatry 1988; 145: 325-30.
4. O’Connor CM, Gurbel P, Serebruany VL. Depression and ischemic 25. Nakao M, Yano E. Relationship between major depression and high
heart disease. Am Heart J 2000; 140: S63-9. serum cholesterol in Japanese men. Tohoku J Exp Med 2004; 204:
5. Anda R, Williamson D, Jones D, Macera C, Eaker E, Glassman A, et 273-87.
al. Depressed Affect, hopelessness, and the risk of ischemic heart dis- 26. Fergusson DM, Goodwin RD, Horwood LJ. Major depression and cig-
ease in a cohort of U.S. adults. Epidemiology 1993; 4: 285-94. arette smoking: results of a 21-year longitudinal study. Psychol Med
6. Barefoot JC, Schroll M. Symptoms of depression, acute myocardial 2003; 33: 1357-67.
infarction, and total mortality in a community sample. Circulation 1996; 27. Penninx BW, Deeg DJ, Van Eijk JT, Beekman AT, Guralnik JM.
93: 1976-80. Changes in depression and physical decline in older adults: a longitudi-
7. Pratt LA, For DE, Crum RM, Armenian HK, Gallo JJ, Eaton WW. nal perspective. J Affect Disord 2000; 61: 1-12.
Depression, psychotropic medication and risk of myocardial infarc- 28. Frasure-Smith N, Lesperance F, Talajic M. Depression following myo-
tion. Prospective data from the Baltimore ECA follow-up. Circulation cardial infarction: impact on 6 month survival. JAMA 1993; 270: 1819-25.
1996; 94: 3123-9. 29. Lesperance F, Frasure-Smith N, Talajic M, Bourassa MG. Five-year
8. Wulsin LR, Singal BM. Do depressive symptoms increase the risk for risk of cardiac mortality in relation to initial severity and one-year
the onset of coronary disease? A systematic quantitative review. Psy- changes in depression symptoms after myocardial infarction. Circula-
chosom Med 2003; 65: 201-10. tion 2002; 105: 1049-53.
9. Rosengren A, Hawken S, Ounpuu S, Sliwa K, Zubaid M, Almahmeed 30. Lesperance F, Frasure-Smith N, Juneau M, Theroux P. Depression and
WA. Association of psychosocial risk factors with risk of acute myocar- 1-year prognosis in unstable angina. Arch Intern Med 2000; 160: 1354-60.
dial infarction in 11,119 cases and 13,648 controls from 52 countries (the 31. Jiang W, Alexander J, Christopher E, Kuchibhatla M, Gaulden LH,
INTERHEART study): case-control study. Lancet 2004; 364: 953-62. Cuffe MS, et al. Relationship of depression to increased risk of mortal-
10. Krishnan KR. Depression as a contributing factor in cerebrovascular ity and rehospitalization in patients with congestive heart failure. Arch
disease. Am Heart J 2000; 140: S70-6. Intern Med 2001; 161: 1849-56.
11. Plante G. Depression and cardiovascular disease: a reciprocal relation- 32. Freedland KE, Rich MW, Skala JA, Carney RM, Davila-Roman VG,
ship. Metab Clin Exp 2005; 54: 45-8. Jaffe AS. Prevalence of depression in hospitalized patients with con-
12. Carney RM, Rich MW, Tevelde A, Saini J, Clark K, Jaffe AS. Major gestive heart failure. Psychosom Med 2003; 65: 119-28.
depressive disorder in coronary artery disease. Am J Cardiol 1987; 60: 33. Blumenthal JA, Lett HS, Babyak MA, White W, Smith PK, Mark DB,
1273-5. et al. Depression as a risk factor for mortality after coronary artery by-
13. Glassman AH, Shapiro PA. Depression and the course of coronary pass surgery. Lancet 2003; 362: 604-9.
artery disease. Am J Psychiatry 1998; 155: 4-11. 34. Feldman P, Galiano F. Cardiovascular effects of serotonin in the nucle-
14. Frasure-Smith N, Lesperance F, Talajic M. Depression and 18 months us of the solitary tract. Am J Physiol 1995; 269: S48-56.
prognosis after myocardial infarction. Circulation 1995; 91: 999-1005. 35. Morgan DA, Thoren P, Wilczynski EA, Victor RG, Mark AL. Seroton-
15. Barefoot JC, Helms MJ, Mark DB, Blumenthal JA, Califf RM, Haney ergic mechanisms mediate renal sympathoinhibition during severe he-
TL, et al. Depression and long-term mortality risk in patients with co- morrhage in rats. Am J Physiol 1988; 255: S496-502.
ronary artery disease. Am J Cardiol 1996; 78: 613-7. 36. Grubb BP, Karas BJ. The potential role of serotonin in the pathogene-
16. Irani S. A novel neurological mechanism to explain the adverse effect of sis of neurocardiogenic syncope and related autonomic disturbances.
depression on coronary artery disease. Med Hypotheses 2005; 64: 284-7. Interv Card Electrophysiol 1998; 2: 325-32.
17. Stein PK, Carney RM, Freedland KE, Skala JA, Jaffe AS, Kleiger RE, 37. Navarro X. Fisiología del sistema nervioso autónomo. Rev Neurol 2002;
et al. Severe depression is associated with markedly reduced heart rate 35: 553-62.
variability in patients with stable coronary heart disease. J Psychosom 38. Guzmán JC, García RG, Dillenburg R, Silva-Sieger F, López-Jaramillo
Res 2000; 48: 493-500. P, Morillo CA. Central serotoninergic response to orthostatic challenge
18. Carney RM, Freedland KE, Veith RC. Depression, the autonomic nervous in patients with neurocardiogenic syncope. Europace 2006; 8: 306-11.
system and coronary heart disease. Psychosom Med 2005; 67: S29-33. 39. García RG, Guzmán JC, Silva SY, Zarruk JG, López-Jaramillo P, Mo-
19. Krittayaphong R, Cascio WE, Light KC, Sheffield D, Golden RN, rillo CA, et al. The role of central serotoninergic system in neurocar-
Finkel JB. Heart rate variability in patients with coronary artery dis- diogenic syncope etiology. MedUNAB 2005; 8: 197-201.
ease: differences in patients with higher and lower depression scores. 40. Dabire H. Central 5-hydroxytryptamine (5-HT) receptors in blood pre-
Psychosom Med 1997; 59: 231-5. ssure regulation. Therapie 1991; 46: 421-9.
20. Thayer JF, Brosschot JF. Psychosomatics and psychopathology: looking 41. Dabire H, Cherqui C, Fournier B, Schmitt H. Comparison of effects of
up and down from the brain. Psychoneuroendocrinology 2005; 30: 1050-8. some 5-HT1 agonists on blood pressure and heart rate of normotensive
21. Carney RM, Freedland KE, Miller GE, Jaffe AS. Depressión as a risk anaesthetized rats. Eur J Pharmacol 1987; 140: 259-66.
factor for cardiac mortality and morbidity: a review of potential mech- 42. Saxena PR, Villalon CM. Cardiovascular effects of serotonin agonists
anisms. J Psychosom Res 2002; 53: 897-902. and antagonists. J Cardiovasc Pharmacol 1990; 15: S17-34.
REV NEUROL 2007; 44 (4): 225-233 231
R.G. GARCÍA-GÓMEZ, ET AL
43. Kalia M. Neurobiological basis of depression: an update. Metabolism 71. Pitzalis MV, Iacoviello M, Todarello O, Fioretti A, Guida P, Massari F,
2005; 54: S24-7. et al. Depression but not anxiety influences the autonomic control of
44. Asberg M, Traskman L, Thoren P. 5-HIAA in the cerebrospinal fluid. A heart rate after myocardial infarction. Am Heart J 2001; 141: 765-71.
biochemical suicide predictor? Arch Gen Psychiatry 1976; 33: 1193-7. 72. Watkins LL, Grossman P. Association of depressive symptoms with
45. Peng CK, Buldyrev SV, Hausdorff JM, Havlin S, Mietus JE, Simons M, reduced baroreflex cardiac control in coronary artery disease. Am Heart
et al. Non-equilibrium dynamics as an indispensable characteristic of a J 1999; 137: 453-7.
healthy biological system. Integr Physiol Behav Sci 1994; 29: 283-93. 73. Schwartz PJ, Wolf S. QT interval prolongation as predictor of sudden
46. Sampaio de Miranda LH, Tomaz CA, Porto CC. Aspectos psicossoci- death in patients with myocardial infarction. Circulation 1978; 57: 1074-7.
ais e culturais das doenças cardiovasculares. In Porto CC, ed. Doenças 74. Bonnemeier H, Hartmann F, Wiegand UKH, Bode F, Katus HA, Ri-
do coraçao, prevençao e tratamento. Rio de Janeiro: Guanabara Koo- chardt G. Course and prognostic implications of QT interval and QT
gan; 2005. p. 101-9. interval variability after primary coronary angioplasty in acute myo-
47. Amat J, Baratta MV, Paul E, Bland ST, Watkins LR, Maier SF. Medial cardial infarction. J Am Coll Cardiol 2001;37: 44-50.
prefrontal cortex determines how stressor controllability affects behav- 75. Ishida S, Nakagawa M, Fujino T, Yonemochi H, Saikawa T, Ito M. Cir-
ior and dorsal raphe nucleus. Nat Neurosci 2005; 8: 365-71. cadian variation of QT interval dispersion: correlation with heart rate
48. Barbas H, Saha S, Rempel-Clower N, Ghashghaei T. Serial pathways variability. J Electrocardiol 1997; 30: 205-10.
from primate prefrontal cortex to autonomic areas may influence emo- 76. Yeragani VK, Pohl R, Jampala VC, Balon R, Kay J, Igel G. Effect of
tional expression. BMC Neurosci 2003; 4: 25-36. posture and isoproterenol on beat-to-beat heart rate and QT variability.
49. Drevets WC. Neuroimaging studies of mood disorders. Biol Psychiat Neuropsychobiology 2000; 41: 113-23.
2000; 48: 813-29. 77. Rainey JM Jr, Pohl RB, Bilolikar SG. The QT interval in drug-free
50. Arborelius L, Owens MJ, Plotsky PM, Nemeroff CB. The role of corti- depressed patients. J Clin Psychiatry 1982; 43: 39-40.
cotropin-releasing factor in depression and anxiety disorders. J Endo- 78. Yeragani VK, Pohl R, Jampala VC, Balon R, Ramesh C, Srinivasan K.
crinol 1999; 160: 1-12. Increased QT variability in patients with panic disorder and depres-
51. Plotsky PM, Owens MJ, Nemeroff CB. Psychoneuroendocrinology of sion. Psychiatry Res 2000; 93: 225-35.
depression. Hypothalamic-pituitary-adrenal axis. Psychiatr Clin North 79. Nahshoni E, Aizenberg D, Strasberg B, Dorfman P, Sigler M, Imbar S,
Am 1998; 21: 293-307. et al. QT dispersion in the surface electrocardiogram in elderly patients
52. Raadsheer FC, Hoogendijk WJG, Stam FC, Tilders FJH, Swaab DF. with major depression. J Affect Disord 2000; 60: 197-200.
Increased numbers of corticotropin-releasing hormone expressing neu- 80. Carney RM, Freedland KE, Stein PK, Watkins LL, Catellier D, Jaffe
rons in the hypothalamic paraventricular nucleus of depressed patients. AS, et al. Effects of depression on QT interval variability after myocar-
Neuroendocrinology 1994; 60: 436-44. dial infarction. Psychosom Med 2003; 65: 177-80.
53. Troxler RG, Sprague EA, Albanese RA, Fuchs R, Thompson AJ. The 81. Task Force of the European Society of Cardiology and the North Ameri-
association of elevated plasma cortisol and early atherosclerosis as de- can Society of Pacing and Electrophysiology. Heart rate variability.
monstrated by coronary angiography. Atherosclerosis 1977; 26: 151-62. Standards of measurement, physiological interpretation, and clinical
54. Brown MR, Fisher LA, Spiess J, Rivier C, Rivier J, Vale W. Cortico- use. Circulation 1996; 93: 1043-65.
tropin-releasing factor: actions on the sympathetic nervous system and 82. Kristal-Boneh E, Raifel M, Froom P, Ribak J. Heart rate variability in
metabolism. Endocrinology 1982; 111: 928-31. health and disease. Scand J Work Environ Health 1995; 21: 85-95.
55. Light KC, Kothandapani RV, Allen MT. Enhanced cardiovascular and 83. Huikuri HV, Makikallio TH. Heart rate variability in ischemic heart
plasma catecholamine responses in women with depressive symptoms. disease. Auton Neurosci 2001; 90: 95-101.
Int J Psychophysiol 1998; 28: 157-66. 84. La Rovere MT, Bigger Jr JT, Marcus FI, Mortara A, Schwartz PJ.
56. Roy A, Pickar D, DeJong J, Karoum F, Linnoila M. Norepinephrine Baroreflex sensitivity and heart-rate variability in prediction of total
and its metabolites in cerebrospinal fluid, plasma, and urine: relation- cardiac mortality after myocardial infarction. ATRAMI (Autonomic
ship to hypothalamic-pituitary-adrenal axis function in depression. Arch Tone and Reflexes After Myocardial Infarction) Investigators. Lancet
Gen Psychiatry 1988; 45: 849-57. 1998; 351: 478-84.
57. Lechin F, Van der Dijs B, Orozco B, Lechin ME, Baez S, Lechin AE, et 85. Huikuri HV, Jokinen V, Syvanne M, Nieminen MS, Airaksinen KE,
al. Plasma neurotransmitters, blood pressure, and heart rate during Ikaheimo MJ, et al. Heart rate variability and progression of coronary
supine resting, orthostasis, and moderate exercise conditions in major atherosclerosis. Arterioscler Thromb Vasc Biol 1999; 19: 1979-85.
depressed patients. Biol Psychiatry 1995; 38: 166-73. 86. Guzzeti S, La Rovere MT, Pinna GD, Maestri R, Borrón E, Porta A, et
58. Palatini P. Heart rate as a risk factor for atherosclerosis and cardiovas- al. Different spectral components of 24 h heart rate variability are relat-
cular mortality. Drugs 1999; 57: 713-24. ed to different modes of death in chronic heart failure. Eur Heart J
59. Anfossi G, Tovati M. Role of catecholamines in platelet function: patho- 2005; 26: 357-62.
physiological and clinical significance. Eur J Clin Invest 1996; 32: 353-70. 87. Choi JB, Hong S, Nelesen R, Bardwell WA, Natarajan L, Schubert C,
60. Bruce E, Musselman DL. Depression, alterations in platelet function, et al. Age and ethnicity differences in short-term heart-rate variability.
and ischemic heart disease. Psychosom Med 2005; 67: S34-6. Psychosom Med 2006; 68: 421-6.
61. Gerritsen ME. Physiological and pathophysiological roles of eico- 88. Vigo DE, Guinjoan SM, Scaramal M, Siri LN, Cardinali DP. Wavelet
sanoids in the microcirculation. Cardiovasc Res 1996; 32: 720-32. transform shows age-related changes of heart rate variability within inde-
62. Bicakova-Rocher A, Gorceix A, Reinberg A, Ashkenazi II, Ticher A. pendent frequency components. Auton Neurosci 2005; 123: 94-100.
Temperature rhythm of patients with major affective disorders: reduced 89. Antelmi I, De Paula RS, Shinzato AR, Peres CA, Mansur AJ, Grupi CJ.
circadian period length. Chronobiol Int 1996; 13: 47-57. Influence of age, gender, body mass index, and functional capacity on
63. Davidson J, Turnbull CD. Diagnostic significance of vegetative symp- heart rate variability in a cohort of subjects without heart disease. Am J
toms in depression. Br J Psychiatry 1986; 148: 442-6. Cardiol 2004; 93: 381-5.
64. Hilz M, Dutsch M. Quantitative studies of autonomic function. Muscle 90. Vallejo M, Marquez MF, Borja-Aburto VH, Cardenas M, Hermosillo
Nerve 2006; 33: 6-20. AG. Age, body mass index, and menstrual cycle influence young wo-
65. López-Pájaro LF, Ferrer-Gila T, Martínez-Cano E, De Miguel-Blanes men’s heart rate variability –a multivariable analysis. Clin Auton Res
C, Rodríguez-Albariño A. Desarrollo de una unidad dedicada al estu- 2005; 15: 292-8.
dio del sistema nervioso autónomo. Rev Neurol 2003; 36: 653-60. 91. Gutin B, Howe C, Johnson MH, Humphries MC, Snieder H, Barbeau
66. Guinjoan SM, Bernabo JL, Cardinali DP. Cardiovascular tests of auto- P. Heart rate variability in adolescents: relations to physical activity,
nomic function and sympathetic skin responses in patients with major fitness, and adiposity. Med Sci Sports Exerc 2005; 37: 1856-63.
depression. J Neurol Neurosurg Psychiatry 1995; 59: 299-302. 92. Vuksanovic V, Gal V. Nonlinear and chaos characteristics of heart period
67. Bar KJ, Greiner W, Jochum T, Friedrich M, Wagner G, Sauer H. The time series: healthy aging and postural change. Auton Neurosci 2005;
influence of major depression and its treatment on heart rate variability 121: 94-100.
and pupillary light reflex parameters. J Affect Disord 2004; 82: 245-52. 93. Bilan A, Witczak A, Palusinski R, Myslinski W, Hanzlik J. Circadian
68. Joyner MJ, Shepherd JT. Autonomic control of circulation. In Low PA, rhythm of spectral indices of heart rate variability in healthy subjects. J
ed. Clinical autonomic disorders. Boston: Little Brown; 1993. p. 55-67. Electrocardiol 2005; 38: 239-43.
69. LaRovere MT, Pinna GD, Hohnloser SH. Baroreflex sensitivity and 94. Pitzalis MV, Mastropasqua F, Massari F, Forleo C, Passantino A, Co-
heart rate variability in identification of patients at risk for life-threat- lombo R. Effects of hydrophilic and lipophilic beta-blockers on heart
ening arrhythmias: implications for clinical trials. Circulation 2001; rate variability and baroreflex sensitivity in normal subjects. Pacing
103: 2072-7. Clin Electrophysiol 1998; 21: 559-67.
70. Broadley AJ, Frenneaux MP, Moskvina V, Jones CJ, Korszun A. Baro- 95. Lombardi F, Torzillo D, Sandrome G, Dalla Vecchia L, Finocchiaro ML,
reflex sensitivity is reduced in depression. Psychosom Med 2005; 67: Bernasconi R, et al. Beta-blocking effect of propafenone based on spec-
648-51. tral analysis of heart rate variability. Am J Cardiol 1992; 70: 1028-34.
232 REV NEUROL 2007; 44 (4): 225-233
DEPRESIÓN Y RIESGO CARDIOVASCULAR
96. Rohde LE, Polanczyk CA, Moraes RS, Ferlin E, Ribeiro JP. Effect of MM, et al. Mental stress-induced myocardial ischemia and cardiac
partial arrhythmia suppression with amiodarone on heart rate variability events. JAMA 1996; 275: 1651-6.
of patients with congestive heart failure. Am Heart J 1998; 136: 31-6. 106. McEwen BS. The neurobiology of stress: from serendipity to clinical
97. Carney RM, Blumenthal JA, Freedland KE, Stein PK, Howells WB, relevance. Brain Res 2000; 886: 172-89.
Berkman LF, et al. Low heart rate variability and the effect of depres- 107. Kessler RC. The effects of stressful life events on depression. Annu
sion on post-myocardial infarction mortality. Arch Intern Med 2005; Rev Psychol 1997; 48: 191-214.
165: 1486-91. 108. Monroe SM, Harkness K, Simons AD, Thase ME. Life stress and the
98. Agelink MW, Boz C, Ullrich H, Andrich J. Relationship between symptoms of major depression. J Nerv Ment Dis 2001; 189: 168-75.
major depression and heart rate variability. Clinical consequences and 109. Ravindran AV, Griffiths J, Waddell C, Anisman H. Stressful life events
implications for antidepressive treatment. Psychiatry Res 2002; 113: and coping styles in relation to dysthymia and major depressive disorder:
139-49. variations associated with alleviation of symptoms following pharmaco-
99. O’Connor MF, Allen JJB, Kaszniak AW. Autonomic and emotion regu- therapy. Prog Neuropsychopharmacol Biol Psychiatry 1995; 19: 637-53.
lation in bereavement and depression. J Psychosom Res 2002; 52: 183-5. 110. McFarlane A, Kamath M, Fallen EL, Malcom V, Cherian F, Norman G.
100. Nahshoni E, Aravot D, Aizenberg D, Sigler M, Zalsman G, Strasberg Effect of sertraline on the recovery rate of cardiac autonomic function
B, et al. Heart rate variability in patients with major depression. Psycho- in depressed patients after acute myocardial infarction. Am Heart J 2001;
somatics 2004; 45: 129-34. 142: 617-23.
101. Yeragani VK, Pohl R, Balon R, Ramesh C, Glitz D, Jung I, et al. Heart 111. Khaykin Y, Dorian P, Baker B, Shapiro C, Sandor P, Mironov D, et al.
rate variability in patients with major depression. Psychiatry Res 1991; Autonomic correlates of antidepressant treatment using heart-rate vari-
37: 35-46. ability analysis. Can J Psychiatry 1998; 43: 183-6.
102. Moser M, Lehofer M, Hoehn-Saric R, McLeod DR, Hildebrandt G, 112. Nahshoni E, Aizenberg D, Sigler M, Strasberg B, Zalsman G, Imbar S, et
Steinbrenner B, et al. Increased heart rate in depressed subjects in spite al. Heart rate variability increases in elderly depressed patients who
of unchanged autonomic balance. J Affect Disord 1998; 48: 115-24. respond to electroconvulsive therapy. J Psychosom Res 2004; 56: 89-94.
103. Hughes JW, Stoney CM. Depressed mood is related to high-frequency 113. Carney RM, Freedland KE, Stein PK, Skala JA, Hoffman P, Jaffe AS.
heart rate variability during stressors. Psychosom Med 2000; 62: 796-803. Change in heart rate and heart rate variability during treatment for
104. Jain D, Shaker SM, Burg MM, Wackers FJ, Soufer R, Zaret BL. depression in patients with coronary heart disease. Psychosom Med
Effects of mental stress on left ventricular and peripheral vascular per- 2000; 62: 639-47.
formance in patients with coronary artery disease. J Am Coll Cardiol 114. Rechlin T, Claus D, Weis M, Kaschka WP. Decreased heart rate vari-
1998; 31: 1314-22. ability parameters in amitriptyline treated depressed patients: biologi-
105. Jiang W, Babyak M, Krantz DS, Waugh RA, Coleman RE, Hanson cal and clinical significance. Eur Psychiatry 1995; 10: 189-94.
THE ROLE PLAYED BY THE AUTONOMIC NERVOUS SYSTEM IN THE
RELATION BETWEEN DEPRESSION AND CARDIOVASCULAR DISEASE
Summary. Introduction. Findings from several epidemiological studies have revealed that major depression is associated with
an increased risk of developing cardiovascular diseases (CVD) and presenting complications and new events in subjects with
already-established CVD. The pathophysiological mechanisms responsible for this increased cardiovascular risk in major
depression remain unclear. Development. The aim of this work is to review the literature on the possible pathophysiological
mechanisms involved in the relation between major depression and CVD, with special emphasis on the studies dealing with
cardiovascular autonomic dysfunction and heart rate variability. Likewise, recent hypotheses concerning the neural mechanisms
underlying autonomic dysfunction in subjects with major depression are also discussed. Conclusions. The evidence that is
currently available allows us to hypothesise that there are anomalies in the functioning of the central autonomic neural
network in subjects with major depression, and more specifically in the hippocampus, prefrontal cortex and the brain stem
nuclei. Such abnormalities, in association with lower central levels of serotonin give rise to a predominance of the sympathetic
flow and a loss of cardiac vagal tone. The resulting cardiovascular autonomic dysfunction could be the main cause of the
increased cardiovascular risk observed in major depression. In the future, studying the autonomic nervous system may be a
useful tool in the development of new therapeutic strategies aimed at reducing cardiovascular morbidity and mortality in
subjects with depression. [REV NEUROL 2007; 44: 225-33]
Key words. Autonomic nervous system. Cardiovascular risk. Central autonomic neural network. Depression. Heart rate variability.
Serotonin.
REV NEUROL 2007; 44 (4): 225-233 233
También podría gustarte
- Madariaga Francisco Seleccion de Poemas PDFDocumento41 páginasMadariaga Francisco Seleccion de Poemas PDFPablo MontaAún no hay calificaciones
- Factores Que Influyen en El Comportamiento HumanoDocumento4 páginasFactores Que Influyen en El Comportamiento HumanoCarolina Galeas50% (2)
- R3 U2 FBD UvegDocumento7 páginasR3 U2 FBD UvegAle De GarrixAún no hay calificaciones
- Predominancia de Lenguas Por Provincias 1Documento3 páginasPredominancia de Lenguas Por Provincias 1Alonso 1Aún no hay calificaciones
- Predominancia de Lenguas Por RegionesDocumento1 páginaPredominancia de Lenguas Por RegionesAlonso 1Aún no hay calificaciones
- Modernismo Literario Y Modernismo ReligiosoDocumento19 páginasModernismo Literario Y Modernismo ReligiosoAlonso 1Aún no hay calificaciones
- Rendimiento Del Estudio Diagnóstico Del Autismo. La Aportación de La Neuroimagen, Las Pruebas Metabólicas y Los Estudios GenéticosDocumento6 páginasRendimiento Del Estudio Diagnóstico Del Autismo. La Aportación de La Neuroimagen, Las Pruebas Metabólicas y Los Estudios GenéticosAlonso 1Aún no hay calificaciones
- Cuestionario DysphaparkDocumento9 páginasCuestionario DysphaparkFabiolaParadaGomezAún no hay calificaciones
- Cefalea Vagal - Bi060379 PDFDocumento2 páginasCefalea Vagal - Bi060379 PDFAlonso 1Aún no hay calificaciones
- El Trastorno de La Percepción Invertida o Inclinada PDFDocumento9 páginasEl Trastorno de La Percepción Invertida o Inclinada PDFAlonso 1Aún no hay calificaciones
- Síndrome de La Persona Rígida PDFDocumento2 páginasSíndrome de La Persona Rígida PDFAlonso 1Aún no hay calificaciones
- INFORME Analisis Fisicoquimico LixiviadosDocumento9 páginasINFORME Analisis Fisicoquimico LixiviadosMartha VallejoAún no hay calificaciones
- Guia Unidad 5 y 6Documento2 páginasGuia Unidad 5 y 6Yeca martinezAún no hay calificaciones
- Analisis de Sentencia T - 510 de 2003Documento23 páginasAnalisis de Sentencia T - 510 de 2003andersonAún no hay calificaciones
- Curriculum Vitae Uriel FernándezDocumento3 páginasCurriculum Vitae Uriel Fernándezsteelyhead100% (1)
- Tema1 - Fisico-QuimicaDocumento5 páginasTema1 - Fisico-QuimicaNelson TeranAún no hay calificaciones
- Ficha Tecnica SimplificadaDocumento29 páginasFicha Tecnica SimplificadaEdward Gerald Alayo de la CruzAún no hay calificaciones
- PDocumento6 páginasPEnergya CorporacionAún no hay calificaciones
- Ayuda Memoria Matrícula Digital 2023 - GeneralDocumento2 páginasAyuda Memoria Matrícula Digital 2023 - GeneralLeonardo YufraAún no hay calificaciones
- Informe de Laboratorio 7 de Física Mecánica: Aplicaciones Estáticas de La Segunda Ley de NewtonDocumento3 páginasInforme de Laboratorio 7 de Física Mecánica: Aplicaciones Estáticas de La Segunda Ley de NewtonDaniel Sierra100% (1)
- Guía 5 - Cómo Organizar El Mantenimiento de La Tecnología para El Cuidado de La Salud - DFID PDFDocumento230 páginasGuía 5 - Cómo Organizar El Mantenimiento de La Tecnología para El Cuidado de La Salud - DFID PDFG10vaSAún no hay calificaciones
- Actividad 1Documento3 páginasActividad 1Ana MendozaAún no hay calificaciones
- Práctica 1Documento3 páginasPráctica 1María CristinaAún no hay calificaciones
- Las Protociudades de MeseniaDocumento9 páginasLas Protociudades de MeseniaedgenbaAún no hay calificaciones
- Ensayo SocratesDocumento5 páginasEnsayo SocratesAlee AleeAún no hay calificaciones
- 1971 Del Pensamiento Alienado Al Pensamiento CreativoDocumento3 páginas1971 Del Pensamiento Alienado Al Pensamiento CreativoJuan Pablo Muciño CorreaAún no hay calificaciones
- Informe Final - Adolfo Altamirano RodriguezDocumento7 páginasInforme Final - Adolfo Altamirano Rodriguezramonavilaruiz1970Aún no hay calificaciones
- Equilibrio en El Comercio InternacionalDocumento4 páginasEquilibrio en El Comercio InternacionalSergio FloresAún no hay calificaciones
- Hospitales en Victor Larco Herrera Con CategoriaDocumento3 páginasHospitales en Victor Larco Herrera Con CategoriaELIA STEFANY BOCANEGRA ASENCIOAún no hay calificaciones
- Introducción Actividad Lógica en EI. Desginación y Simbolización 2020Documento42 páginasIntroducción Actividad Lógica en EI. Desginación y Simbolización 2020Sonia del ÁguilaAún no hay calificaciones
- Proyecto Armado II Grupo C2 Sem1-2021 DIAZ-RINCON-ROA-VARGAS INFORME EN WORD TERCERA ENTREGADocumento168 páginasProyecto Armado II Grupo C2 Sem1-2021 DIAZ-RINCON-ROA-VARGAS INFORME EN WORD TERCERA ENTREGASarah CarrilloAún no hay calificaciones
- Tarea 2 FisicaDocumento3 páginasTarea 2 FisicaJuan Sebastian Qioñones OsorioAún no hay calificaciones
- Apunte Cirug A 7Documento12 páginasApunte Cirug A 7Fede ApriAún no hay calificaciones
- Plasticos y Medio Ambiente FinalDocumento18 páginasPlasticos y Medio Ambiente FinalEmmanuel CRAún no hay calificaciones
- Marketing Contab.Documento81 páginasMarketing Contab.DANIEL RODRIGO QUISPE ORDONEZAún no hay calificaciones
- Valoracion Productiva de Lechuga HidropoDocumento7 páginasValoracion Productiva de Lechuga HidropoMarisol Velasquez CarmonaAún no hay calificaciones
- Trabajo Práctico N°6: Luzia Alonso Iannone, Navila El Hage, Diana Lopez Duarte, M. Sol IllanesDocumento9 páginasTrabajo Práctico N°6: Luzia Alonso Iannone, Navila El Hage, Diana Lopez Duarte, M. Sol IllanesAgustina FeijooAún no hay calificaciones
- ¿Lo Que Sucede Cuando Se Ora Con Todo El Corazón?Documento2 páginas¿Lo Que Sucede Cuando Se Ora Con Todo El Corazón?Aninive JimenezAún no hay calificaciones