Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica Nº2 Titulacion Complexometrica PDF
Practica Nº2 Titulacion Complexometrica PDF
Cargado por
Elizabeth Nina Villca0 calificaciones0% encontró este documento útil (0 votos)
12 vistas5 páginasTítulo original
106217966-PRACTICA-Nº2-TITULACION-COMPLEXOMETRICA.pdf
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
12 vistas5 páginasPractica Nº2 Titulacion Complexometrica PDF
Practica Nº2 Titulacion Complexometrica PDF
Cargado por
Elizabeth Nina VillcaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
TITULACION COMPLEXOMETRICA
PRÁCTICA Nº 2
TITULACION COMPLEXOMETRICA
I. OBJETIVOS
- Aplicar los principios básicos de la volumetría por formación de
complejos en la determinación de la dureza de una muestra de
agua.
II. PRINCIPIOS TEÓRICOS
COMPLEXOMETRIA
La complejometría o complexometría es una técnica para la
determinación analítica directa o indirecta de elementos o
compuestos por medición del complejo soluble formado. Cualquier
compuesto que forme cuantitativamente un complejo estable con su
ion metálico, puede ser usado en complejometría, si se dispone de
un medio adecuado para determinar el punto final de la reacción.
Muchas reacciones dan iones complejos o moléculas neutras sin
disociar. Pero pocas pueden usarse para valoración, pues la mayoría
de los complejos son demasiado inestables para la valoración
cuantitativa, porque forman más de un complejo con un ion metálico
dado y esto dificulta la determinación del punto final.
DETERMINACIÓN CUANTITATIVA DE LA DUREZA DEL AGUA
Desde 1945 se hicieron estudios sistemáticos de estos complejos y
descubrieron un método analítico para determinar la dureza del
agua en el que usaban ácido etilendiamintetracético (EDTA) como
valorante, así como murexida y negro de eriocromo T como
indicadores.
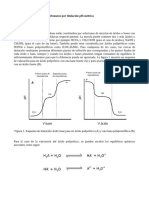
El negro de ericromo T que se utiliza en dicha titulación, es conocido
también como NET, es un indicador de iones metálicos, muy utilizado
para titular diversos cationes comunes, comportándose como un
ácido débil. Los complejos metálicos del NET frecuentemente son
rojos en un rango de pH entre 4 a 12, cuando está libre en solución
en un rango de pH menor a 10 su color es rosado, a pH igual a 10 es
de color azul.
Este tipo de volumetría tiene como principal aplicación la
determinación cuantitativa de la dureza en muestras de agua.
La DUREZA es una característica química del agua y podemos
definirla como la suma de las concentraciones de los iones calcio y
UTP | Laboratorio de Química
TITULACION COMPLEXOMETRICA
magnesio presentes en ella, expresadas como CaCO3 en mg/L. Estos
iones pueden estar presentes bajo la forma de carbonatos,
bicarbonatos, cloruros, sulfatos y ocasionalmente nitratos de calcio y
magnesio. Cabe resaltar que estos iones no son los únicos que le
confieren la dureza al agua ya que en menor proporción también lo
hacen el hierro, el aluminio, el estroncio y otros metales.
Existen dos tipos de dureza:
• Dureza Temporal: Determinada por el contenido de carbonatos y
bicarbonatos de calcio y magnesio. Puede ser eliminada por ebullición del
agua y posterior precipitación y filtración, también se le conoce como
"Dureza de Carbonatos".
• Dureza Permanente: Determinada por todas las sales de calcio y
magnesio excepto carbonatos y bicarbonatos. No puede ser eliminada por
ebullición del agua y también se le conoce como "Dureza de No
Carbonatos".
El rango de dureza varía entre cero y cientos de mg/L, dependiendo
de la procedencia del agua y/o del tratamiento al que haya sido
sometida. El agua adquiere la dureza a su paso a través de las
formaciones de roca que contienen los elementos que la producen.
Debido al poder solvente del agua y a ciertas condiciones ácidas que
adquiere a su paso por la capa de suelo, ataca a las rocas,
particularmente a la calcita (CaCO3), entrando los compuestos en
solución.
0 – 75 mg/L CaCO3 Agua Blanda
75 – 150 mg/L CaCO3 Agua Semi-Dura
150 – 300 mg/L CaCO3 Agua Dura
más de 300 mg/L CaCO3 Agua Muy Dura
Esta dureza es un problema doméstico e industrial. Por ejemplo
cuando se hierve agua en un recipiente metálico de uso diario, se
genera un depósito sólido indeseable en las paredes del recipiente al
que se le conoce como “sarro”, las cuales al ser malas conductoras
del calor, demoran el hervido del agua cada vez más. Una alta
dureza causa problemas de incrustación en calderas, tuberías,
lavadoras, planchas.
Por estas razones es conveniente el ablandamiento de las aguas
duras pudiendose utilizar diferentes métodos como el uso de
UTP | Laboratorio de Química
TITULACION COMPLEXOMETRICA
carbonatos solubles, hervido del agua, destilación, intercambio
iónico u ósmosis inversa.
Hervido del agua.- Cuando se hierve el agua unos minutos se
reduce la dureza pero no desaparece totalmente. Esta parte de la
dureza que se reduce es la dureza temporal y su reducción se
debe a la precencia de iones bicarbonato HCO3-, que se transforman
en iones carbonato CO3-2 y con producción de dióxido de carbono CO2
por efecto del calor. Estos iones reaccionan de inmediato con los
iones Ca+2 ó Mg+2, de acuerdo a la reacción:
Ca+2 + 2 HCO3- → CaCO3 ↓ + H2O + CO2↑
III. PROCEDIMIENTO EXPERIMENTAL
a) Materiales y equipos:
- Matraz erlenmeyer
- Bureta
- Vaso de precipitado
- Pipeta
- Piceta
- Luna de reloj
- Soporte universal
b) Reactivos:
- Solución de EDTA standard
- Indicador negro de ericromo NET
- Solución buffer de pH 10
- Agua destilada
- Agua potable
c) Procedimiento:
a)
1. Determinación de la Dureza Total:
• Vierta 15 mL de agua dura (potable) a un erlenmeyer de 100
mL, más 3 mL de solución buffer y trazas de indicador negro
de ericromo. (NET).
UTP | Laboratorio de Química
TITULACION COMPLEXOMETRICA
• Agregue en la bureta solución valorada de EDTA, hasta un
volumen referencial.
• Gota a gota inicie la titulación con agitación continua del
erlenmeyer.
• Continúe la titulación hasta que la solución cambie de rojiza
a azulina.
• Anote el consumo de solución EDTA y calcule la dureza del
agua expresado en mg de CaCO3 /litro o ppm.
ml EDTA * 1000 * f
Dureza Total ( mg CaCO3 / l ) ó (ppm) =
ml de muestra
f (factor experimental) = considerar el valor asignado por el profesor.
2. Determinación de la Dureza Permanente:
• En un vaso de precipitados llevar a ebullición 50 mL de agua
potable. Tapar el vaso con una luna de reloj y dejar enfriar.
• Filtrar el agua hervida y reponer el volumen evaporado con
agua destilada. Proceda a titular 15 mL de esta solución de
igual forma que en el caso anterior (1).
• Determine mediante cálculos la dureza temporal sabiendo
que se obtiene por diferencia entre la dureza total y la
dureza permanente.
IV. TABLA DE RESULTADO
Complete la siguiente tabla con sus datos y resultados obtenidos:
Volumen de muestra de agua (mL)
Concentración de la solución de EDTA (N)
Volumen gastado de EDTA en la Dureza Total (mL)
Volumen gastado en la Dureza Permanente (mL)
Dureza Total (ppm CaCO3)
UTP | Laboratorio de Química
TITULACION COMPLEXOMETRICA
Dureza Permanente (ppm CaCO3)
Dureza Temporal (ppm CaCO3)
V. CUESTIONARIO
1. Usted sabe que el término dureza se refiere a la cantidad de calcio y
magnesio disueltos en el agua, principalmente en las aguas naturales.
¿Donde tienen su origen estos minerales y por que varían en mayor o
menor grado su presencia en este tipo de agua?
2. Ordene los diferentes tipos de agua propuestos de menor a mayor
dureza y detalle brevemente que ocurriría si a unos 5 mililitros de cada
una de estas aguas, le agrega 2 mL de una solución jabonosa. Sustente si
hay de por medio un fenómeno químico.
Agua de caño, agua destilada, agua de mar, agua desionizada, agua de
lluvia, agua de río.
3. Detalle brevemente las consecuencias de la dureza del agua a nivel
industrial, doméstico y medio ambiental. Proponga un método de
ablandamiento.
4. Proponga las ecuaciones químicas ocurridas entre los iones calcio,
magnesio y el ácido etilendiamintetracético.
UTP | Laboratorio de Química
También podría gustarte
- Manual Npi Introduccion Camion Minero 797b Caterpillar Componentes Operacion Sistemas Flujos Aceite Aire555555Documento56 páginasManual Npi Introduccion Camion Minero 797b Caterpillar Componentes Operacion Sistemas Flujos Aceite Aire555555cristian100% (2)
- Practica Nº2 Operaciones BasicasDocumento5 páginasPractica Nº2 Operaciones BasicasQUÍMICA0% (1)
- Valoración Por Complexometria 2020Documento24 páginasValoración Por Complexometria 2020Juan Pablo Sará FoncecaAún no hay calificaciones
- Practica N° 10 Volumetria de Oxidacion-Reduccion IIDocumento16 páginasPractica N° 10 Volumetria de Oxidacion-Reduccion IIKatia Yesica Tineo Canales100% (2)
- INFORME PermanganometriaDocumento20 páginasINFORME PermanganometriaMay_LOVEme0% (4)
- Collin Rodney - Gurdjieff - El Desarrollo de La LuzDocumento271 páginasCollin Rodney - Gurdjieff - El Desarrollo de La LuzManoel Messias Ferreira Lima100% (1)
- Informe de Lab. ComplexometriaDocumento10 páginasInforme de Lab. Complexometriaiaraneda30Aún no hay calificaciones
- Cap II DisolucionesDocumento128 páginasCap II DisolucionesLuisQuiñones100% (1)
- Ejemplo Cálculo Viga ReticuladaDocumento10 páginasEjemplo Cálculo Viga ReticuladaMartin CalderónAún no hay calificaciones
- Barrera Cutanea PDFDocumento8 páginasBarrera Cutanea PDFDaniel ZamudioAún no hay calificaciones
- Clase IDocumento41 páginasClase IQUÍMICA100% (2)
- EdtaDocumento14 páginasEdtahenry Suarez100% (1)
- Guía General para Memoria de Cálculo de Instalaciones de Agua FríaDocumento9 páginasGuía General para Memoria de Cálculo de Instalaciones de Agua FríaMaríaJosselineCalleAún no hay calificaciones
- Práctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote TDocumento5 páginasPráctica 6-Determinación Volumétrica de Cloruros Por El Metodo de Mohr-Aguilar M-Pinargote Ttania pinargote0% (1)
- PRACTICA Visualizacion de FlujosDocumento21 páginasPRACTICA Visualizacion de FlujosCarlosJavierSalsaBoy100% (1)
- Laboratorio Nº4-Ablandamiento de Agua-IpqDocumento9 páginasLaboratorio Nº4-Ablandamiento de Agua-IpqNAYSU VENTURA POCCOHUANCAAún no hay calificaciones
- Informe# 6 Quim Analítica Grupo4, A - Volumetría Redox Determinación de Peróxido de Hidrógeno en Agua OxigenadaDocumento14 páginasInforme# 6 Quim Analítica Grupo4, A - Volumetría Redox Determinación de Peróxido de Hidrógeno en Agua OxigenadaSol Angie GalvanAún no hay calificaciones
- 854ATGDocumento66 páginas854ATGxtian-crAún no hay calificaciones
- COMPLEXOMETRÍADocumento8 páginasCOMPLEXOMETRÍAhernando guerrero100% (3)
- Informe 5 ComplexometriaDocumento6 páginasInforme 5 ComplexometriaDenaquel JimenezAún no hay calificaciones
- ArgentometriaDocumento3 páginasArgentometriaMauricio Camarena100% (1)
- AnaliticaDocumento34 páginasAnaliticamipeneAún no hay calificaciones
- Práctica 5 Análisis Carbonatos BicarbonatosDocumento4 páginasPráctica 5 Análisis Carbonatos BicarbonatosFranklin Pastrana ArteagaAún no hay calificaciones
- HinsbergDocumento1 páginaHinsbergPRISCILA YAMILET JIMENEZ MANZOAún no hay calificaciones
- Practica 16 Calculo Teorico y Experimental de PH de Disoluciones de Acidos Bases y Sales Disoluciones ReguladorasDocumento7 páginasPractica 16 Calculo Teorico y Experimental de PH de Disoluciones de Acidos Bases y Sales Disoluciones ReguladorasJosh Emg100% (1)
- Practica Alcoholes QuimicaDocumento13 páginasPractica Alcoholes QuimicaSherri Barr64% (11)
- Informe de Mezcla de Acidos GeraldineDocumento8 páginasInforme de Mezcla de Acidos GeraldineGeraldiine RamirezAún no hay calificaciones
- Taller No. 1 AnaliticaDocumento12 páginasTaller No. 1 AnaliticaRobin Angel Romero100% (2)
- PRACTICA #6-QUIMICA ANALITICA-VOLUMETRÍA de PRECIPITACION - Determinación de La Concentraciòn de Cloruros en El Agua PotableDocumento8 páginasPRACTICA #6-QUIMICA ANALITICA-VOLUMETRÍA de PRECIPITACION - Determinación de La Concentraciòn de Cloruros en El Agua PotableCynthia GonzalesAún no hay calificaciones
- Titulaciones ConductimétricasDocumento9 páginasTitulaciones ConductimétricasTiffanny Romero PauccarimaAún no hay calificaciones
- Práctica 2Documento7 páginasPráctica 2ppchuy344Aún no hay calificaciones
- Ejercicios Tercer ParcialDocumento7 páginasEjercicios Tercer ParcialCamila Jackelyne ApazaAún no hay calificaciones
- Informe 8 - Disoluciones Amortiguadoras de PHDocumento14 páginasInforme 8 - Disoluciones Amortiguadoras de PHJessica Fernanda Coaricona OrtegaAún no hay calificaciones
- Determinacion de Acido Acetico en VinagreDocumento5 páginasDeterminacion de Acido Acetico en VinagreEnriqueCondoFAún no hay calificaciones
- Titulaciones ComplexometricasDocumento8 páginasTitulaciones ComplexometricasJulián EzAún no hay calificaciones
- Volumetría de Oxido - Reducción IDocumento10 páginasVolumetría de Oxido - Reducción IingrossAún no hay calificaciones
- Practica - 7 Volumetria de ComplejosDocumento5 páginasPractica - 7 Volumetria de ComplejosNafracla22Aún no hay calificaciones
- ComplexometriaDocumento5 páginasComplexometriaDiego PadillaAún no hay calificaciones
- Deber Quimica AnaliticaDocumento8 páginasDeber Quimica AnaliticaFabian Cabrera GuerraAún no hay calificaciones
- Indicadores MetalocromicosDocumento6 páginasIndicadores MetalocromicosAlberto Jeremías Castillo SuárezAún no hay calificaciones
- CoulombímetroDocumento3 páginasCoulombímetroJorge Lopez MendozaAún no hay calificaciones
- Practica 2. Acido Acetil SalicilicoDocumento9 páginasPractica 2. Acido Acetil SalicilicogstorrespAún no hay calificaciones
- Valoracion Poteniometrica Con Acido FosforicoDocumento18 páginasValoracion Poteniometrica Con Acido FosforicoCinthya Knowles Gonzalez Rios100% (1)
- Dureza de Agua Por ComplexometriaDocumento14 páginasDureza de Agua Por Complexometriakate_idal100% (1)
- Teoría de Formacion de Complejos PDFDocumento5 páginasTeoría de Formacion de Complejos PDFgerson95Aún no hay calificaciones
- Practica 1 QMC108 PDFDocumento2 páginasPractica 1 QMC108 PDFwilver Rodriguez avendaño33% (3)
- Informe 5 Acidimetria 1 Parte PDFDocumento10 páginasInforme 5 Acidimetria 1 Parte PDFDani SantoyoAún no hay calificaciones
- Evaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDocumento3 páginasEvaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDayana BotelloAún no hay calificaciones
- Problemario-Quimica Organica II AlcoholesDocumento2 páginasProblemario-Quimica Organica II AlcoholesAndrés Velázquez75% (4)
- DicromatometriaDocumento5 páginasDicromatometriaEliecer GonzalezAún no hay calificaciones
- Factores Que Influyen en La Formación de ComplejosDocumento2 páginasFactores Que Influyen en La Formación de ComplejosLuis Angel Castillo OrtizAún no hay calificaciones
- Libro COULOMBIMETRIA Y ELECTROGRAVIMETRIADocumento22 páginasLibro COULOMBIMETRIA Y ELECTROGRAVIMETRIALeidys Begambre VergaraAún no hay calificaciones
- Aplicaciones de ElectrogravimetriaDocumento8 páginasAplicaciones de ElectrogravimetriaNICK MARALLANO0% (1)
- Cuántos Gramos de CuSO4Documento4 páginasCuántos Gramos de CuSO4Richard Peña Alcca0% (1)
- Calcio AphaDocumento3 páginasCalcio AphaRocio BedogniAún no hay calificaciones
- Reporte Practica 2 RefractometríaDocumento5 páginasReporte Practica 2 RefractometríaFiliberto MartínezAún no hay calificaciones
- Las Normas Generales de Trabajo en Un Laboratorio de Química OrgánicaDocumento9 páginasLas Normas Generales de Trabajo en Un Laboratorio de Química OrgánicaJaquelina Leal100% (1)
- Practica 4Documento5 páginasPractica 4Milka Rafaela Acero VargasAún no hay calificaciones
- Soluciones IIDocumento3 páginasSoluciones IIValeria Agudelo Gómez100% (2)
- Ácido Fosfórico - Coca Cola InformeDocumento21 páginasÁcido Fosfórico - Coca Cola InformeigrajalesAún no hay calificaciones
- Error de Valoración Debido Al IndicadorDocumento2 páginasError de Valoración Debido Al IndicadorMaría Alejandra MaidanaAún no hay calificaciones
- Obtención de BenzofenonaDocumento9 páginasObtención de BenzofenonaPaola RamirezAún no hay calificaciones
- Laboratorio # 7. Dureza en Una Muestra de AguaDocumento6 páginasLaboratorio # 7. Dureza en Una Muestra de AguadeymerAún no hay calificaciones
- Titulación ComplexométricaDocumento8 páginasTitulación ComplexométricaCeleni Jaime BadaAún no hay calificaciones
- Practica 3Documento15 páginasPractica 3Wara Martha Pacheco HuancaAún no hay calificaciones
- DUREZA DEL AGUA GironDocumento4 páginasDUREZA DEL AGUA GironISMAEL ALFONZO GUTIERREZ LLAPAPASCAAún no hay calificaciones
- Dureza Del AguaDocumento15 páginasDureza Del AguaNehemias Ruiz mamaniAún no hay calificaciones
- Determinacion de Dureza TotalDocumento11 páginasDeterminacion de Dureza TotalMiguel Murillo CanulAún no hay calificaciones
- Sesión 01 - Semana 01Documento2 páginasSesión 01 - Semana 01QUÍMICA100% (1)
- Practica Nº4 Equilibrio QuimicoDocumento6 páginasPractica Nº4 Equilibrio QuimicoQUÍMICAAún no hay calificaciones
- Reacciones QuimicasDocumento12 páginasReacciones QuimicasQUÍMICAAún no hay calificaciones
- Practica Nº4 Funciones Quimicas InorganicasDocumento6 páginasPractica Nº4 Funciones Quimicas InorganicasQUÍMICA71% (7)
- UQMDocumento15 páginasUQMQUÍMICAAún no hay calificaciones
- Enlace QuimicoDocumento28 páginasEnlace QuimicoQUÍMICA33% (3)
- Practica Nº3 Enlace QuimicoDocumento5 páginasPractica Nº3 Enlace QuimicoPaolo Morante RiosAún no hay calificaciones
- Practica # - 3 Volumetria Por RetrocesoDocumento6 páginasPractica # - 3 Volumetria Por RetrocesoQUÍMICA75% (8)
- Tabla PeriodicaDocumento31 páginasTabla PeriodicaQUÍMICA100% (1)
- Tabla PeriodicaDocumento31 páginasTabla PeriodicaQUÍMICA100% (1)
- Ejercicios Teoria AtomicaDocumento3 páginasEjercicios Teoria AtomicaQUÍMICAAún no hay calificaciones
- Practica Nº1 Volumetria Acido BaseDocumento7 páginasPractica Nº1 Volumetria Acido BaseQUÍMICA0% (3)
- Clase 2quiDocumento30 páginasClase 2quiJenny DelgadoAún no hay calificaciones
- Práctica Nº1 - Mediciones y DensidadDocumento6 páginasPráctica Nº1 - Mediciones y DensidadQUÍMICA100% (5)
- MicroscopiosDocumento6 páginasMicroscopiosDe la cruz De los santos Aurelia ConcepciónAún no hay calificaciones
- Diapositivas de La Solucion Ejercicio #7Documento13 páginasDiapositivas de La Solucion Ejercicio #7Aldair Vargas LunaAún no hay calificaciones
- Nuevo Documento de Microsoft WordDocumento3 páginasNuevo Documento de Microsoft Wordanonymous ella no te amaAún no hay calificaciones
- Newton Rules Biology PDFDocumento3 páginasNewton Rules Biology PDFraarorAún no hay calificaciones
- T05 Acciones en La EdificaciónDocumento22 páginasT05 Acciones en La EdificaciónMa SiluAún no hay calificaciones
- Undav - S.e.5. - Emparrillados, Casetonados, Losas Sin Vigas y Sist. PrenovaDocumento7 páginasUndav - S.e.5. - Emparrillados, Casetonados, Losas Sin Vigas y Sist. Prenovaandrea soledad arandaAún no hay calificaciones
- Tema N 3Documento22 páginasTema N 3luz wara coca pomaAún no hay calificaciones
- Vectorial PDFDocumento73 páginasVectorial PDFjonasAún no hay calificaciones
- Bloques de Concreto y TridipanelDocumento12 páginasBloques de Concreto y TridipanelDiana Flor VivancoAún no hay calificaciones
- Gaceta Oficial No 4044Documento392 páginasGaceta Oficial No 4044IngGerman TineoAún no hay calificaciones
- Obtención Analítica de La Constante de Stefan - Boltzmann A Partir de La Estadística de Bose - EinsteinDocumento23 páginasObtención Analítica de La Constante de Stefan - Boltzmann A Partir de La Estadística de Bose - EinsteinAndrésFelipeQuirogaMirandaAún no hay calificaciones
- Ajustes Tolarancias Acabados SuperficialesDocumento31 páginasAjustes Tolarancias Acabados SuperficialesJuan Chapaca0% (1)
- Factores Bioticos y AbioticosDocumento2 páginasFactores Bioticos y AbioticosJosé AguilarAún no hay calificaciones
- Practica 3 Medidores de CaudalDocumento10 páginasPractica 3 Medidores de CaudalLuis JaramilloAún no hay calificaciones
- Informe Técnico: Estudio de Mecánica de Suelos para Saneamiento BasicoDocumento138 páginasInforme Técnico: Estudio de Mecánica de Suelos para Saneamiento BasicoCarlos Cabos OlivaresAún no hay calificaciones
- Tesis Jairo WilliansDocumento111 páginasTesis Jairo WilliansLuisJoseAmundarayAún no hay calificaciones
- Anexo 10 Volumen 3 SuplementoDocumento17 páginasAnexo 10 Volumen 3 SuplementocontroladoraereoAún no hay calificaciones
- CL1Documento6 páginasCL1Gustavo OleaAún no hay calificaciones
- T.dinamica 1Documento7 páginasT.dinamica 1Joel Andres CevallosAún no hay calificaciones
- Laboratorio Numero 2 SlinkyDocumento8 páginasLaboratorio Numero 2 SlinkyDaniel Santiago Garzón QuirogaAún no hay calificaciones
- Colorante TartrazinaDocumento7 páginasColorante TartrazinaE Marc MedinaAún no hay calificaciones
- El Desdoblamiento Del TiempoDocumento15 páginasEl Desdoblamiento Del TiempofereliAún no hay calificaciones