0% encontró este documento útil (0 votos)
200 vistas8 páginasActividad enzimática de la amilasa
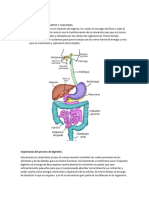
Este documento describe un experimento para determinar la actividad de la enzima amilasa salival. Los objetivos incluyen investigar cómo afectan la temperatura, el pH y sustancias inhibitorias la actividad de la amilasa. Los resultados muestran que la actividad amilasa aumenta con la temperatura óptima y disminuye a temperaturas extremas. La actividad también depende del pH. Además, la amilasa hidroliza específicamente almidón pero no sacarosa, lo que demuestra su especificidad como enzima.
Cargado por
gabriela morenoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
200 vistas8 páginasActividad enzimática de la amilasa
Este documento describe un experimento para determinar la actividad de la enzima amilasa salival. Los objetivos incluyen investigar cómo afectan la temperatura, el pH y sustancias inhibitorias la actividad de la amilasa. Los resultados muestran que la actividad amilasa aumenta con la temperatura óptima y disminuye a temperaturas extremas. La actividad también depende del pH. Además, la amilasa hidroliza específicamente almidón pero no sacarosa, lo que demuestra su especificidad como enzima.
Cargado por
gabriela morenoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd