Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Analisis
Cargado por
MAICOL ESTIVEN CHOCONTA CARREÑO0 calificaciones0% encontró este documento útil (0 votos)
9 vistas2 páginasananlisi de resultados bovinos
Título original
analisis
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoananlisi de resultados bovinos
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
9 vistas2 páginasAnalisis
Cargado por
MAICOL ESTIVEN CHOCONTA CARREÑOananlisi de resultados bovinos
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 2
1.
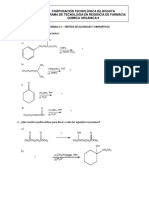
ANALISIS DE RESULTADOS
Puntos de fusión
Las sustancias analizadas en el laboratorio son sustancias solidas de carácter
orgánico a excepción del hielo que pudo ser utilizado como patrón, estas
sustancias orgánicas se caracterizan por tener en sus estructuras moleculares
enlaces covalentes. Para el estudio de los puntos de fusión de cada sustancia
se debe tener en cuenta las fuerzas intermoleculares que poseen.
Empezando con las sustancias patrón utilizadas para la calibración:
En el agua: La unión puente hidrógeno es un caso particular de la fuerza
dipolo permanente, en el cual al ser mayor la fracción de carga que se separa,
es más intensa. Las moléculas que presentan la posibilidad de unión puente
hidrógeno presentarán entonces las tres fuerzas intermoleculares (London, dip–
dip y pte. Hidrógeno).
En la bezonfenona: Debido a la forma angular de la molécula con el
vértice en el grupo >C=0 y la polaridad del doble enlace carbono – oxigeno, las
cetonas son moléculas polares, por lo que las fuerzas intermoleculares son de
orientación. Estas son más fuertes que las de dispersión (existente en los
hidrocarburos) pero más débiles que el enlace de hidrógeno (existentes en los
alcoholes). Como consecuencia los puntos de fusión y de ebullición son más
altos que los de los hidrocarburos semejantes, pero más bajos que los alcoholes.
En el caso de la urea que es una di-amida, se observa que la
representación de las formas resonantes de una amida justifica su fuerte
naturaleza polar. Los enlaces de hidrógeno y las atracciones dipolares
estabilizan la fase sólida, por lo que los puntos de fusión son más altos. Las
amidas tienen puntos de fusión más elevados que el ácido, los nitrilos, los
ésteres y los cloruros de ácido
Por ultimo tenemos el ácido benzoico el cual es un acido carboxílico, sus enlaces
forman puentes de hidrógeno, por tal razón su punto de fusión es tan alto
comparado con la benzofenona, Además dado que los anillos aromáticos son
planos, se pueden empaquetar muy bien con los que las fuerzas que se crean
entre ellos son muy elevadas. . Esto se puede comprobar comparando las
temperaturas de fusión de moléculas alifáticas y aromáticas de igual número de
átomos de carbono: Naftaleno: 80 °C ; Decano: -28 °C
Punto de Ebullición
El punto de ebullición se le determina a aquellas sustancias en estado líquido,
en este laboratorio, se tenía como muestra problema la cual estaba más
compuesta de la parte inorgánica que orgánica, al principio desconocida, se
comenzó con el procedimiento pero por errores del científico y de manejo de los
instrumentos, no se pudo tomar la temperatura a la que la sustancia comenzó a
subir por el capilar, y por lo tanto el procedimiento ya tenía errores, por falta de
tiempo y de reactivos no se pudo volver a realizar dicho procedimiento.
Para la determinación del punto de ebullición es necesario sumergir el tubo de
ensayo con el capilar dentro del tubo de Thiel que contiene aceite mineral, esto
se hace con el fin de crear un calentamiento indirecto o llamados también baños
de calefacción. Las sustancias utilizadas en el baño calefactor deben tener las
siguientes características:
a. Tener un punto de ebullición más alto que el punto de fusión de la
sustancia.
b. No descomponer antes, ni cerca del punto de fusión de las sustancia.
c. Poder conducir bien el calor pero paulatinamente.
A parte del aceite mineral puede ser utilizada glicerina como sustancia dentro del
tubo de Thiele.
También podría gustarte
- Informe de Determinacion de Cloruros 2 1Documento11 páginasInforme de Determinacion de Cloruros 2 1MAICOL ESTIVEN CHOCONTA CARREÑOAún no hay calificaciones
- Guia3 Determinacion de ClorurosDocumento5 páginasGuia3 Determinacion de ClorurosMAICOL ESTIVEN CHOCONTA CARREÑOAún no hay calificaciones
- Laboratorio de Determinacion de ClorurosDocumento12 páginasLaboratorio de Determinacion de Clorurosroyer torrezAún no hay calificaciones
- PuntucionDocumento13 páginasPuntucionMAICOL ESTIVEN CHOCONTA CARREÑOAún no hay calificaciones
- HolaDocumento13 páginasHolaMAICOL ESTIVEN CHOCONTA CARREÑOAún no hay calificaciones
- Taller S2-5Documento5 páginasTaller S2-5MAICOL ESTIVEN CHOCONTA CARREÑOAún no hay calificaciones
- Guia #3. Separacion y Purificacion de Un MedicamentoDocumento3 páginasGuia #3. Separacion y Purificacion de Un MedicamentoMAICOL ESTIVEN CHOCONTA CARREÑOAún no hay calificaciones
- Unidad IIIDocumento8 páginasUnidad IIIRonanAún no hay calificaciones
- Colorantes y El Arte de TeñirDocumento6 páginasColorantes y El Arte de TeñirCandyPapeleriaAún no hay calificaciones
- Ciencia de Los AlimentosDocumento14 páginasCiencia de Los AlimentosLorena CastroAún no hay calificaciones
- Fuerza de La Estructura ProteicaDocumento3 páginasFuerza de La Estructura ProteicaAna Victoria Ramírez IriarteAún no hay calificaciones
- Cuestionario BioquímicaDocumento36 páginasCuestionario BioquímicaCindy PazAún no hay calificaciones
- 10 Ejemplos de Enlaces Metálicos Serán Como Ejemplo Redes de Átomos Unidos deDocumento8 páginas10 Ejemplos de Enlaces Metálicos Serán Como Ejemplo Redes de Átomos Unidos depipe042Aún no hay calificaciones
- Química de Fijación IIDocumento33 páginasQuímica de Fijación IIAdolfo Antonio Ríos AlcortaAún no hay calificaciones
- Clase 1 BromatologíaDocumento23 páginasClase 1 BromatologíaAnonymous x4FVAKIHqAún no hay calificaciones
- 101 - Propiedades Únicas Del AguaDocumento3 páginas101 - Propiedades Únicas Del AgualeoAún no hay calificaciones
- Química IIDocumento33 páginasQuímica IICamila VivianiAún no hay calificaciones
- CAP - 11 - Quimica - La - Ciencia - Central - 12va - Edicion (2) - 472-509Documento38 páginasCAP - 11 - Quimica - La - Ciencia - Central - 12va - Edicion (2) - 472-509LEONEL EDUARDO SALAZAR DAGAAún no hay calificaciones
- Fuerzas IntermolecularesDocumento4 páginasFuerzas IntermolecularesWinkler Heiner Jota Andi100% (1)
- Historia Del Descubrimiento de Las MacromoleculasDocumento40 páginasHistoria Del Descubrimiento de Las MacromoleculasNanixe Shunashi Padilla MorenoAún no hay calificaciones
- Apuntes de Enlaces Quimicos 2018 PDFDocumento20 páginasApuntes de Enlaces Quimicos 2018 PDFRoberto SantiagoAún no hay calificaciones
- FUERZAS IntermolecularesDocumento17 páginasFUERZAS IntermolecularesJose CastilloAún no hay calificaciones
- Formato Cuadro Comparativo Actividad N°5..Documento6 páginasFormato Cuadro Comparativo Actividad N°5..Cristian Tierradentro0% (1)
- Interacciones Intermoleculares PresentacionDocumento29 páginasInteracciones Intermoleculares PresentacionlolazarAún no hay calificaciones
- Mapas Conceptuales en QuimicaDocumento17 páginasMapas Conceptuales en QuimicaJose LabradorAún no hay calificaciones
- Propiedades Del AguaDocumento19 páginasPropiedades Del AguaVIVIAún no hay calificaciones
- FUERZAS IntermolecularesDocumento11 páginasFUERZAS IntermolecularesFabiola Del Pilar CuroAún no hay calificaciones
- Cuestionario. Práctica 6 Extracción de Edulcorantes NaturalesDocumento6 páginasCuestionario. Práctica 6 Extracción de Edulcorantes NaturalesDelgado Muñoz Felizza SofiaAún no hay calificaciones
- T-5 PlantasDocumento40 páginasT-5 PlantasSara Ramírez SánchezAún no hay calificaciones
- Quimica 2 UtpDocumento215 páginasQuimica 2 UtpEdgfer SantAún no hay calificaciones
- Biologia Molecular. Fundamentos y AplicacionesDocumento173 páginasBiologia Molecular. Fundamentos y Aplicacionesshady182100% (1)
- Informe de Laboratorio Identificación de Grupos FuncionalesDocumento16 páginasInforme de Laboratorio Identificación de Grupos FuncionalesPAOLA ANDREA DIAZ TAPIAAún no hay calificaciones
- CARTEL de La Práctica 3, NRC 13959Documento1 páginaCARTEL de La Práctica 3, NRC 13959Berenice Sanchez GalindoAún no hay calificaciones
- Clase0 RepasoDocumento112 páginasClase0 RepasoCarolina VazquezAún no hay calificaciones
- El Agua y Las Sales MineralesDocumento6 páginasEl Agua y Las Sales MineralesDaniela Rodriguez PerezAún no hay calificaciones
- Elaboración de Poli (N-Isopropilacrilamida) y Determinación de Su Temperatura de Transición Conformacional (LCST)Documento12 páginasElaboración de Poli (N-Isopropilacrilamida) y Determinación de Su Temperatura de Transición Conformacional (LCST)Elias Arenas PanccaAún no hay calificaciones
- Capítulo 11, Fuerzas Intermoleculares, Líquidos y Sólidos, Practica Resuelta.Documento9 páginasCapítulo 11, Fuerzas Intermoleculares, Líquidos y Sólidos, Practica Resuelta.Luis Jose Serracin0% (1)