0% encontró este documento útil (0 votos)
1K vistas10 páginasInforme 5 Analitica
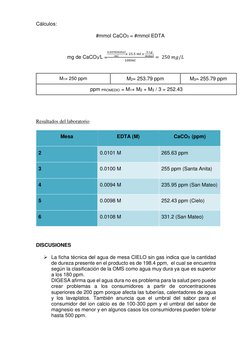
La práctica tuvo como objetivo determinar la dureza del agua, expresada en mg/L de CaCO3, mediante volumetría ácido-base. Inicialmente se estandarizó una solución de EDTA utilizando muestras de CaCO3, obteniendo una concentración promedio de 0.0098 M. Luego, se tomó una muestra de agua mineral y se tituló con EDTA, determinando que contenía 250 mg/L de CaCO3. Finalmente, se analizaron más muestras de agua, encontrando valores de dureza entre
Cargado por
Lemon TeaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
1K vistas10 páginasInforme 5 Analitica
La práctica tuvo como objetivo determinar la dureza del agua, expresada en mg/L de CaCO3, mediante volumetría ácido-base. Inicialmente se estandarizó una solución de EDTA utilizando muestras de CaCO3, obteniendo una concentración promedio de 0.0098 M. Luego, se tomó una muestra de agua mineral y se tituló con EDTA, determinando que contenía 250 mg/L de CaCO3. Finalmente, se analizaron más muestras de agua, encontrando valores de dureza entre
Cargado por
Lemon TeaDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd