Documentos de Académico
Documentos de Profesional
Documentos de Cultura
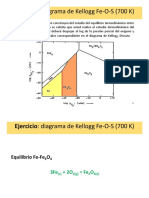
Cálculos BALANCE DE ENERGÍA DEL PROCESO DE TOSTACIÓN DE CONCENTRADOS DE SULFURO DE ZINC 1
Cargado por
Jose CarlosTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cálculos BALANCE DE ENERGÍA DEL PROCESO DE TOSTACIÓN DE CONCENTRADOS DE SULFURO DE ZINC 1
Cargado por
Jose CarlosCopyright:
Formatos disponibles
CÁLCULOS:
A. BALANCE DE MATERIALES:
Gases (1173°K)
SO2
N2
O2
HORNO DE Calcina
Concentrado de
TOSTACIÓN ZnO(s)
Zinc.
(1173°K)
ZnS(s)
(298°K)
Aire
O2: 21%
N2: 79%
ZnS(s) + 1.5 O2 (g) = ZnO(s) + SO2 (g)
o TABLA Nº 1: Balance de Materiales (Base: 1000 Kg.)
ENTRADA Kmoles Kg. SALIDA Kmoles Kg.
Conc. de Calcina de Zn
Zinc:
ZnS 10.309 1 000.00 ZnO 10.309 835.029
Aire: Gases:
O2 19.330 618.56 O2 3.866 123.71
N2 72.720 2036.16 N2 72.720 2036.16
SO2 10.309 659.78
TOTAL: 3654.72 TOTAL: 3654.68
15 de septiembre del 2015
BASE DE CÁLCULO: 1000 Kg. ZnS/hora
1Kmol ZnS * 1000 Kg ZnS = 10.309 Kmol ZnS
97Kg ZnS
o Por balances estequiométricos, se pueden realizar los siguientes cálculos:
ZnS(s) + 1.5O2 (g) = ZnO(s) + SO2 (g)
1.5 Kmol O2 (g) * 10.309 Kmol ZnS(s) = 15.464 Kmol O2 (g)
1 Kmol ZnS(s)
1 Kmol ZnO (g) * 10.309 Kmol ZnS(s) = 10.309 Kmol ZnO (g)
1 Kmol ZnS(s)
1 Kmol SO2 (g) * 10.309 Kmol ZnS(s) = 10.309 Kmol SO2 (g)
1 Kmol ZnS(s)
10.309 ZnS(s) + 15.464 O2 (g) = 10.309 ZnO(s) + 10.309 SO2 (g)
O2 teórico = 15.464 Kmol O2
O2 exceso = O2 teórico* porcentaje
Exceso O2 = 15.464 Kmol O2*25%
Exceso O2 = 3.866 Kmol O2
Aire: En 100 Kmol aire
79 Kmol N2 = 3.762 Kmol N2/Kmol O2
21 Kmol O2
N2 teórico = 15.464 Kmol O2 * (3.762 Kmol N2/Kmol O2)
N2 teórico = 58.176 Kmol N2
N2 exceso = N2 teórico* porcentaje
N2 exceso = 58.176 Kmol N2 * 25%
N2 exceso = 14.544 Kmol N2
15 de septiembre del 2015
BALANCE PARCIAL DE AIRE:
Kmoles O2 N2 Aire
Teórico 15.464 58.176 73.640
Exceso 3.866 14.544 18.410
Total 19.33 72.72 92.05
TABLA N°02: BALANCE DE ENERGÍA:
ENTRADA Kmoles KJ SALIDA Kmoles KJ
Conc. de Calcina de Zn
Zinc:
ZnS 10.309 0.00 ZnO 10.309
Aire: Gases:
O2 19.330 0.00 O2 3.866
N2 72.720 0.00 N2 72.720
SO2 10.309
TOTAL: TOTAL:
BASE DE CÁLCULO:
𝐓𝐬
𝐓𝐞
𝐐 = ∑(𝐦 ∫ 𝐂𝐩. 𝐝𝐓)𝐬𝐚𝐥𝐢𝐝𝐚 − ∑(𝐦 ∫ 𝐂𝐩. 𝐝𝐓)𝐞𝐧𝐭𝐫𝐚𝐝𝐚 + ∑ ∆𝐇°𝐑,𝟐𝟗𝟖°𝐊 + 𝐏
𝟐𝟗𝟖
𝟐𝟗𝟖
𝐞 𝐓
CÁLCULO DE: ∑(𝐦 ∫𝟐𝟗𝟖 𝐂𝐩. 𝐝𝐓)𝐞𝐧𝐭𝐫𝐚𝐝𝐚
𝐞 𝐓 𝟐𝟗𝟖 𝟐𝟗𝟖
Σ(m∫𝟐𝟗𝟖 𝐜𝐩. 𝐝𝐭) e = (m∫𝟐𝟗𝟖 𝐜𝐩. 𝐝𝐭)ZnS. + (m∫𝟐𝟗𝟖 𝐜𝐩. 𝐝𝐭)AIRE = 0
298
(m ∫298 Cp. dT) ZnS y AIRE = 0 (Debido a que su temperatura de salida es
298°K
15 de septiembre del 2015
CÁLCULO DE: 𝚺𝚫𝐇𝐑, 𝟐𝟗𝟖°𝐊
ΣΔHR, 298 = ΣH298, PRODUCTOS – ΣH298,REACTANTES
ΣΔHR, 298 = (ΣΔH° ZnO, 298°K + ΣΔH° SO2, 298°K – ΣΔH° ZnS, 298°K – ΣΔH° O2, 298°K)
ΣΔHR, 298 = (-350.6x103 – 296.8x103 + 205.2x103 + 0) KJ
ΣΔHR, 298 = -442.2x103 KJ en un Kmol de ZnS
ΔHR, 298 = 10.309 Kmol ZnS*-442.2x103 KJ
1 Kmol ZnS
ΔHR, 298 = -4558639.80 KJ
𝐞 𝐓
CÁLCULO DE: ∑(𝐦 ∫𝟐𝟗𝟖 𝐂𝐩. 𝐝𝐓)𝐬𝐚𝐥𝐢𝐝𝐚
𝒔𝑻 𝟏𝟏𝟕𝟑 𝟏𝟏𝟕𝟑
Σ(m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)S = (m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)calcina + (m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)gases
𝟏𝟏𝟕𝟑 𝟏𝟏𝟕𝟑
(m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)calcina = (m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)ZnO
1173 1173
(m∫298 𝑐𝑝. 𝑑𝑡) calcina = (10.309) x ∫298 (49 + 5.1 ∗ 10−3 𝑇 − 9.12 ∗ 105 𝑇 −2 )𝑑𝑇
𝟏𝟏𝟕𝟑
(m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕) calcina = 452 366.09 KJ
𝟏𝟏𝟕𝟑 𝟏𝟏𝟕𝟑 𝟏𝟏𝟕𝟑 𝟏𝟏𝟕𝟑
(m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)gases = (m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)𝑶𝟐 + (m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)𝑵𝟐 + (m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)𝑺𝑶𝟐
1173 1173
(m∫298 𝑐𝑝. 𝑑𝑡)𝑂2 = (3.866) x ∫298 (29.96 + 4.18 ∗ 10−3 𝑇 − 1.67 ∗ 105 𝑇 −2 )𝑑𝑡
𝟏𝟏𝟕𝟑
(m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)𝑶𝟐 = 110 130.97 KJ
1173 1173
(m∫298 𝑐𝑝. 𝑑𝑡)𝑁2 = 72.720 x ∫298 (27.87 + 4.27 ∗ 10−3 𝑇)𝑑𝑡
𝟏𝟏𝟕𝟑
(m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)𝑵𝟐 = 1 973 203.53 KJ
1173 1173
(m∫298 𝑐𝑝. 𝑑𝑡)𝑆𝑂2 = 10.309*∫298 (43.43 + 10.63 ∗ 10−3 𝑇 − 5.94 ∗ 105 𝑇 −2 )𝑑𝑡
𝟏𝟏𝟕𝟑
(m∫𝟐𝟗𝟖 𝒄𝒑. 𝒅𝒕)𝑺𝑶𝟐 = 446 951.08 KJ
𝐞 𝐓
∑(𝐦 ∫𝟐𝟗𝟖 𝐂𝐩. 𝐝𝐓)𝐒𝐀𝐋𝐈𝐃𝐀 = (452 366.09 +110 130.97 +1 973 203.53 +446 951.08) KJ
𝐓𝐞
∑(𝐦 ∫ 𝐂𝐩. 𝐝𝐓)𝐒𝐀𝐋𝐈𝐃𝐀 = 𝟐 𝟗𝟖𝟐 𝟔𝟓𝟏. 𝟔𝟕 𝑲𝑱.
𝟐𝟗𝟖
15 de septiembre del 2015
CÁLCULO DE PERDIDAS: π = 3.1416
ΔT
P = −K x A x ΔS
W (−800)ºK
P = − (1.5 ºK) x (11π m2) x
m (0.25 m)
J 1KJ
P = 165 876.48 (3600s)( )
s 1000J
P = 597 155.33 KJ
CÁLCULO DE: CALOR (Q):
𝐓𝐬
𝐓𝐞
𝐐 = ∑(𝐦 ∫ 𝐂𝐩. 𝐝𝐓)𝐬𝐚𝐥𝐢𝐝𝐚 − ∑(𝐦 ∫ 𝐂𝐩. 𝐝𝐓)𝐞𝐧𝐭𝐫𝐚𝐝𝐚 + ∑ ∆𝐇°𝐑 ,𝟐𝟗𝟖°𝐊 +𝐏
𝟐𝟗𝟖
𝟐𝟗𝟖
Q = 2 982 651.67 KJ – 0 + (-4 558 639.80 KJ) + 597 155.33 KJ
Q = -978 832.80 KJ … (EXCESO DE CALOR)
15 de septiembre del 2015
También podría gustarte
- 2° Parte BAL - ENERGIA. TLR ZNS - 2 - LlenoDocumento19 páginas2° Parte BAL - ENERGIA. TLR ZNS - 2 - LlenoJORDAN LEONCIO OLIVARES SEGOVIAAún no hay calificaciones
- Diagrama de Kellog UltimoDocumento11 páginasDiagrama de Kellog UltimoYelitsa RoViAún no hay calificaciones
- Termodinamica de La Tostacion de MineralesDocumento13 páginasTermodinamica de La Tostacion de MineralesChrisber Erikson Fuentes Borda100% (1)
- Minería Las BambasDocumento2 páginasMinería Las BambasSantiago NuñezAún no hay calificaciones
- Balance de Energía Del Proceso de Tostación de Concentrados de Zinc en Un Horno de Lecho Fluidizado o TurbulentoDocumento8 páginasBalance de Energía Del Proceso de Tostación de Concentrados de Zinc en Un Horno de Lecho Fluidizado o TurbulentoPatricia Judith Veragara RoldánAún no hay calificaciones
- La Tostación de La PiritaDocumento1 páginaLa Tostación de La PiritaOscar Ticllasuca Meza0% (2)
- Metalurgia General PirometalurgiaDocumento21 páginasMetalurgia General PirometalurgiaLuis Quintanilla100% (1)
- Practica N4 y N5 Tostación de Sulfuros y Tostacion de La PiritaDocumento7 páginasPractica N4 y N5 Tostación de Sulfuros y Tostacion de La PiritaJessica Segovia del Carpio100% (1)
- Ácido Sulfúrico Con Ejercicio ProyectoDocumento15 páginasÁcido Sulfúrico Con Ejercicio ProyectoJean CaguaAún no hay calificaciones
- Ejercicio de CalcinacionDocumento3 páginasEjercicio de CalcinacionnielsAún no hay calificaciones
- Discusion 7 1qesDocumento9 páginasDiscusion 7 1qeserick414141Aún no hay calificaciones
- Tostación de SulfurosDocumento16 páginasTostación de SulfurosBRENDA EMELYC FLORES MUÑOZAún no hay calificaciones
- Determinación de Fe Con K2Cr2O7 - Alquimia - 1620411Documento16 páginasDeterminación de Fe Con K2Cr2O7 - Alquimia - 1620411Rubén Rueda Amaya100% (1)
- MATIFICACIONDocumento6 páginasMATIFICACIONmigel64Aún no hay calificaciones
- Practica #9Documento3 páginasPractica #9Lizet TincutaAún no hay calificaciones
- Lab Siderurgia DavalosDocumento14 páginasLab Siderurgia Davalosrubenmanuel5Aún no hay calificaciones
- Ejemplo Clase Auxiliar No 2Documento3 páginasEjemplo Clase Auxiliar No 2Yeison MaldonadoAún no hay calificaciones
- MINERALOGIADocumento12 páginasMINERALOGIAyaninaAún no hay calificaciones
- Cinética de La Tostación Sulfatante de CalcopiritaDocumento30 páginasCinética de La Tostación Sulfatante de CalcopiritaJonathan Andrés PullasAún no hay calificaciones
- Pirometalurgia de PlomoDocumento20 páginasPirometalurgia de PlomoGerardo PortalesAún no hay calificaciones
- Chavez Lechon Efrain Gualberto SiderDocumento13 páginasChavez Lechon Efrain Gualberto SiderHenry Jesus Saavedra AlvarezAún no hay calificaciones
- Conversión de Matas de CobreDocumento6 páginasConversión de Matas de CobreJuan Andres Vasquez CarrascoAún no hay calificaciones
- Extracción de Zinc Por Fusión y AfinoDocumento6 páginasExtracción de Zinc Por Fusión y AfinoAnonymous ldKWxd1nAún no hay calificaciones
- Examen Parcial de PirometalurgiaDocumento15 páginasExamen Parcial de PirometalurgiaEdsonAún no hay calificaciones
- Trabajo de Solucion de La Tostacion Del Sulfuro de NiquelDocumento20 páginasTrabajo de Solucion de La Tostacion Del Sulfuro de NiquelGhino Xavier Huertas Paico100% (1)
- Informe 7 FisicoquimicaDocumento11 páginasInforme 7 FisicoquimicaMichael Alexander Baltazar CondorAún no hay calificaciones
- Fusion MatificanteDocumento15 páginasFusion MatificanteedgarAún no hay calificaciones
- CALCINACIÓNDocumento11 páginasCALCINACIÓNYulianaMoralesAún no hay calificaciones
- Diagrama de KelloggDocumento11 páginasDiagrama de KelloggalexAún no hay calificaciones
- Ejercicios PrácticosDocumento5 páginasEjercicios PrácticosRobinsonAún no hay calificaciones
- Metalurgia Del ZincDocumento60 páginasMetalurgia Del ZincGERARDOAún no hay calificaciones
- Laboratorio 1 - Balance de Materia y Energía - Hoja CálculoDocumento21 páginasLaboratorio 1 - Balance de Materia y Energía - Hoja Cálculocelia100% (1)
- Datos Calculos y Resultados P9Documento7 páginasDatos Calculos y Resultados P9Torres Mark AntonioAún no hay calificaciones
- 10Documento2 páginas10Abi C. AlanyaAún no hay calificaciones
- Termodinámica de La TostaciónDocumento11 páginasTermodinámica de La Tostaciónericson1425483100% (1)
- Cómo Aplicar La Ley de Hess - El Blog de Un QuímicoDocumento2 páginasCómo Aplicar La Ley de Hess - El Blog de Un Químico1977dianaAún no hay calificaciones
- Lixiviacion de Calcinas de ZincDocumento4 páginasLixiviacion de Calcinas de ZincConnie PetersAún no hay calificaciones
- Problemas Resueltos de La Lección 7Documento7 páginasProblemas Resueltos de La Lección 7Lee HansonAún no hay calificaciones
- Metalurgia 2 Problemas TostaconDocumento45 páginasMetalurgia 2 Problemas TostaconLISYA ANDREINA QUISPE ENRIQUEZ50% (2)
- Termodinámica de La Tostación Pres FinDocumento10 páginasTermodinámica de La Tostación Pres FinGian HornaAún no hay calificaciones
- IntruccionesTrabajoTostacion PDFDocumento6 páginasIntruccionesTrabajoTostacion PDFSantiago Molina HuertasAún no hay calificaciones
- Labortorio Nº4 Electrodeposicion de Cobre Baño AlcalinoDocumento9 páginasLabortorio Nº4 Electrodeposicion de Cobre Baño AlcalinoDante Castillo CisnerosAún no hay calificaciones
- Celdas Electroliticas TallerDocumento5 páginasCeldas Electroliticas Tallerelgordol8779Aún no hay calificaciones
- Primera Práctica Dirigida de Procesos UnitariosDocumento2 páginasPrimera Práctica Dirigida de Procesos UnitariosCarlos Pumachara CasasAún no hay calificaciones
- METALOTERMIADocumento1 páginaMETALOTERMIALuis Angel Polanco VargasAún no hay calificaciones
- Diagrama de Kellogg - Ana AncietaDocumento1 páginaDiagrama de Kellogg - Ana AncietaluiguiAún no hay calificaciones
- Electrodeposición Del EstañoDocumento14 páginasElectrodeposición Del EstañoElizabeth MontejanoAún no hay calificaciones
- Informe - Tiempo de EscurrimientoDocumento66 páginasInforme - Tiempo de EscurrimientoElizabeth EscalanteAún no hay calificaciones
- Diagrama de KelloggDocumento7 páginasDiagrama de Kelloggsalome_uc_2013Aún no hay calificaciones
- Piro CobreDocumento71 páginasPiro CobreEver Renso Cama ValdiviaAún no hay calificaciones
- Problemas de Balance de MasaDocumento9 páginasProblemas de Balance de MasamexalurgiaAún no hay calificaciones
- EhhhhDocumento6 páginasEhhhhdiomedesAún no hay calificaciones
- Informe Celdas GalvanicasDocumento9 páginasInforme Celdas GalvanicasGrace M. AlvarezAún no hay calificaciones
- ZincDocumento30 páginasZincJorgeWashiHuamanChjutalliAún no hay calificaciones
- Tostacion PiritaDocumento42 páginasTostacion PiritaMarco Antonio Ojeda Prado100% (3)
- Tarea 2Documento24 páginasTarea 2Ronald Jhonatan Calvimontes RodriguezAún no hay calificaciones
- Hidrometalurgia Del Zinc-Antonio MoyaDocumento16 páginasHidrometalurgia Del Zinc-Antonio MoyaAntonio Moya SanchezAún no hay calificaciones
- Asignación 25Documento9 páginasAsignación 25rubiAún no hay calificaciones
- S10.s1 MaterialDocumento23 páginasS10.s1 MaterialTapita del pasoAún no hay calificaciones
- Resolucion Pr01Documento9 páginasResolucion Pr01ManuelAún no hay calificaciones
- Las Artes Visuales en La Historia EducativaDocumento3 páginasLas Artes Visuales en La Historia EducativaJose CarlosAún no hay calificaciones
- Metodos (Ingeniera)Documento9 páginasMetodos (Ingeniera)Jose CarlosAún no hay calificaciones
- Compañía Minera Poderosa SDocumento4 páginasCompañía Minera Poderosa SJose CarlosAún no hay calificaciones
- Compañía Minera Poderosa SDocumento4 páginasCompañía Minera Poderosa SJose CarlosAún no hay calificaciones
- Balance de Energía Del Proceso de Tostación de Concentrados de Sulfuro de Zinc 1Documento19 páginasBalance de Energía Del Proceso de Tostación de Concentrados de Sulfuro de Zinc 1Jose CarlosAún no hay calificaciones
- Nomenc Form Inorg 03Documento34 páginasNomenc Form Inorg 03Nuri Tasilla UcedaAún no hay calificaciones
- SelenioDocumento6 páginasSelenioVictorAún no hay calificaciones
- Unidad 1 - Fórmula Empírica y Fórmula Molecular - Ejercicios de AplicaciónDocumento5 páginasUnidad 1 - Fórmula Empírica y Fórmula Molecular - Ejercicios de AplicaciónDanny CachimuelAún no hay calificaciones
- Ciclos BiogeoquímicosDocumento11 páginasCiclos BiogeoquímicosSokey0120Aún no hay calificaciones
- Final Biologia UNMDPDocumento50 páginasFinal Biologia UNMDPCarla RasmussenAún no hay calificaciones
- FT Acido Eficaz - LimkitDocumento2 páginasFT Acido Eficaz - LimkitCristhiam Montalvan CoronelAún no hay calificaciones
- Manual Quimica General Corregido Practicas de LaboratorioDocumento54 páginasManual Quimica General Corregido Practicas de LaboratorioMaria del Pilar Leal GamboaAún no hay calificaciones
- Precios de Suministros SMC - 2022 - 2021Documento2 páginasPrecios de Suministros SMC - 2022 - 2021cinthiaraaAún no hay calificaciones
- Estequiometria Ii-Problemas-Unac-2023aDocumento3 páginasEstequiometria Ii-Problemas-Unac-2023asaid lopezAún no hay calificaciones
- Norma Técnica Colombiana 1398Documento6 páginasNorma Técnica Colombiana 1398ras110477100% (1)
- Materiales InorgánicosDocumento2 páginasMateriales InorgánicosMildred Sánchez JaraAún no hay calificaciones
- 9 Secuencia 4 QuímicaDocumento10 páginas9 Secuencia 4 QuímicaHoratio SmithAún no hay calificaciones
- QUIMICA 4to AÑO II MOMENTO 2022Documento14 páginasQUIMICA 4to AÑO II MOMENTO 2022daniel david herrera alvarezAún no hay calificaciones
- Cuadernillo Semana 12Documento2 páginasCuadernillo Semana 12mishellAún no hay calificaciones
- COMPUESTOS BINARIOS FinalDocumento14 páginasCOMPUESTOS BINARIOS FinalUlises EstigarribiaAún no hay calificaciones
- Quimica-2do-Tema 2...Documento6 páginasQuimica-2do-Tema 2...Marcelo RodolfoAún no hay calificaciones
- Gomas Y Pectinas.Documento19 páginasGomas Y Pectinas.Christopher Daniel Flores HernándezAún no hay calificaciones
- Procesos de Tierras RarasDocumento13 páginasProcesos de Tierras RarasFEDERACION BENIAún no hay calificaciones
- AB 3 - EsDocumento6 páginasAB 3 - EsJuan Bedolla FloresAún no hay calificaciones
- Taller de Potencial Ionización y Electronegatividad SGDocumento4 páginasTaller de Potencial Ionización y Electronegatividad SGSebastian GutierrezAún no hay calificaciones
- EstequiometriaDocumento32 páginasEstequiometriacristianAún no hay calificaciones
- Problemas de EstequiometríaDocumento3 páginasProblemas de EstequiometríaYos CoconiAún no hay calificaciones
- HDS Hipoclorito de CalcioDocumento3 páginasHDS Hipoclorito de Calcioviviana castilloAún no hay calificaciones
- 2.3. Reacciones de Aldehídos y CetonasDocumento28 páginas2.3. Reacciones de Aldehídos y CetonasIveth RiquelmeAún no hay calificaciones
- Programa de Materiales PeligrososDocumento5 páginasPrograma de Materiales PeligrososJose Robles Quispe100% (1)
- Tema 1: BioelementosDocumento4 páginasTema 1: Bioelementosfayza elhamriAún no hay calificaciones
- Lámparas de Cátodo Hueco PDFDocumento3 páginasLámparas de Cátodo Hueco PDFEdgardo Javier Astocaza RebattaAún no hay calificaciones
- Word Informe Quimica 1, Semana 5Documento20 páginasWord Informe Quimica 1, Semana 5Segundo Soto TerronesAún no hay calificaciones
- Informe N°5Documento13 páginasInforme N°5FABIAN DIAZ DIAZAún no hay calificaciones
- Manual de Laboratorio Esc Ing. Ind. Quimica Organica Vilma Dianderas - Rossana JuarezDocumento58 páginasManual de Laboratorio Esc Ing. Ind. Quimica Organica Vilma Dianderas - Rossana JuarezHADY JAMILEE RAMOS MAMANIAún no hay calificaciones