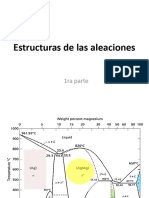
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
18 SolucionesSolidas AS Smith PDF
18 SolucionesSolidas AS Smith PDF
Cargado por
Alexis Pacheco Castillo0 calificaciones0% encontró este documento útil (0 votos)
8 vistas3 páginasTítulo original
18_SolucionesSolidas_AS_Smith (1).pdf
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas3 páginas18 SolucionesSolidas AS Smith PDF
18 SolucionesSolidas AS Smith PDF
Cargado por
Alexis Pacheco CastilloCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
Soluciones Slidas
As, el tipo ms sencillo de aleacin es
1. Introduccin el de solucin slida. Una soluci6n
slida es un cristal que consta de dos o
Hemos visto las estructuras cristalinas ms elementos que estn atmicamente
de varios elementos puros (Fe, Cu, C dispersos, formando una nica
diamante, etc.), as como de algunos estructura (fase); este material no tiene
compuestos no metlicos de una composicin nica: por ser una
composicin definida (NaCl, SiO2, solucin, hay un rango de solubilidad.
etc.). Lo que abordaremos ahora son Un caso bsico importante es cuando un
soluciones slidas basadas en elementos elemento (impureza) est disuelto en el
puros, particularmente en elementos cristal (matriz) de un segundo elemento
metlicos. (solucin binaria: de dos elementos).
En relacin con los metales, lo ms Obviamente, la unin entre elementos
frecuente es que se empleen metlicos no se puede hacer a
industrialmente aleaciones metlicas temperatura ambiente por falta de
movilidad atmica; por ello las
(combinacin de elementos metlico aleaciones se preparan preferentemente
preferentemente), ms que metales fundiendo, y luego solidificando y
puros. En esas aleaciones puede haber enfriando. Hay otros procedimientos
varios tipos de fases, y frecuentemente que aprovechan la movilidad atmica al
una de esas fases (que a veces es la estado slido; en este caso hay que
nica presente) es una solucin slida. calentar (sin fundir) o bien hay que
Una fase es una regin de materia deformar muy severamente.
homognea; al estado slido, ella tiene
asociada composicin, estructura 2. Tipos de soluciones slidas
cristalina y propiedades que le son
propias. Ejemplos de metales Las soluciones s6lidas se clasifican en
comercialmente puros que se emplean sustitucionales e intersticiales, ver Figs.
industrialmente son los conductores 1 y 2.
elctricos usuales, normalmente hechos
de Cu o bien de Al. Entre las aleaciones
metlicas simples, constituidas por una
nica fase se encuentra la aleacin de
aluminio 5083; en este caso la fase
presente es esencialmente una solucin
slida de sustitucin de Mg disuelto en
una matriz de Al (CCC); esta aleacin
se emplea, por ejemplo, para fabricar
cascos de lanchas; admite ser
conformada plsticamente y ser
soldada, adems tiene una buena
resistencia a la corrosin. Otro ejemplo Fig. 1 Solucin slida de sustitucin
de solucin slida es el latn utilizado
para fabricar vainillas de municiones,
por embutido profundo (para lo cual se
requiere una gran ductilidad); se trata de
una aleacin de 30% en peso de Zn
disuelto en Cu (CCC). Hay otras
aleaciones muy complejas, como la
superaleacin base nquel denominada
Inconel 718, utilizada en componentes
de motores a reaccin; ella incluye unos
10 elementos en su composici6n
nominal y varios tipos de fases
coexistiendo, algunas de las cuales son
cermicas (no metlicas). Fig. 2 Solucin slida de insercin
2.1 Soluciones slidas de sustitu- de los factores indicados. As es como
cin el Cu y el Ni tienen una solubilidad
En las soluciones slidas de sustitucin, excepcionalmente alta: ellos presentan
los tomos de soluto (impureza) solubilidad total al estado slido. La
sustituyen, en trminos de posicin, a solubilidad del Zn en Cu tambin es
tomos de la matriz (cristal madre o bastante alta (38.3%p.); recurdese que
solvente). Para este tipo de solubilidad
los dos tomos deben ser similares en las estructuras CCC y HC tienen
radio atmico, estructura cristalina, muchas similitudes. Por otra parte, el
electro-negatividad y valencia. tomo de Pb es mucho mayor que el de
Cu; ello explica la baja solubilidad del
En las vecindades de una impureza, Pb en el Cu (o,1%p.). De hecho, en lo
siempre los tomos prximos del cristal policristales de Cu y sus aleaciones, el
madre sern afectados, y habr una
distorsin local de la red. Si esta Pb segrega a los bordes de grano,
distorsin fuese muy grande, entonces debilitndolos. La solubilidad del Al en
la disolucin podra no ser posible. el Cu no excede del 9%p., siendo la
Tambin podra ocurrir que se pudiese diferencia de valencia una limitacin de
disolver slo una cantidad limitada de la solubilidad. El tomo de C, que es
soluto pues, al superar dicho nivel, ya la muy pequeo, no forma soluciones
distorsin acumulada podra ser
inaceptable para el equilibrio del slidas de sustitucin con ningn metal.
sistema. En ese momento se alcanzara Solo otra pareja de elementos de la tabla
el lmite de solubilidad de la solucin y, peridica presenta, como el Cu y el Ni,
de seguir agregando impurezas al una excepcional solubilidad total al
sistema podra aparecer, coexistiendo, estado slido: se trata de la pareja de
un segundo cristal, muy diferente de la elementos no metlicos Si y Ge, con
solucin slida inicial.
estructura diamante.
La fraccin de tomos de impureza Tabla 1. Datos de inters, de metales y no
que puede disolverse en un cristal de metales, para la solubilidad de sustitucin
otro elemento, puede entonces variar
desde una fraccin de porcentaje Elem. R[nm] E.C. E- Val.
at6mico hasta el 100%. Las siguientes Cobre 0,128 CCC 1,8 +2
condiciones favorecen una gran Nque1 0,125 CCC 1,8 +2
solubilidad sustitucional de un elemento Zinc 0,133 HC 1,7 +2
en otro, en soluciones metlicas: Alurninio 0,143 CCC 1,5 +3
Plomo 0,175 CCC 1,6 +2, +4
1. Los dimetros de los tomos de Carbono 0,077 Cbica 2,5 +4
los elementos no deben diferir en diamante
mucho ms de un 15 %, Silicio 0,117
Cbica
1,8 +4
aproximadamente. diamante
Cbica
1. Las estructuras cristalinas de los Germanio 0,139
diamante
2,0 +4
dos elementos por separado tienen
que ser las mismas. (Condicin
necesaria para que haya 2.2 Soluciones slidas de insercin
solubilidad total, al 100%)
2. No debe haber diferencias
apreciables en electronegatividades En las soluciones slidas intersticiales,
de los dos elementos, para evitar los tomos de soluto se sitan en los
que se formen compuestos intersticios (espacios) que hay entre los
definidos con facilidad. tomos del cristal matriz. Se pueden
3. Los dos elementos deben tener la formar soluciones slidas intersticiales
misma valencia. solo cuando el tomo de la matriz es
mucho mayor que el otro, de modo que
los intersticios de la matriz sean
suficientemente grandes para el tamao
En la Tabla 1 se observa que el Ni y el del soluto (impureza).
Cu son bastantes similares en trminos
Ejemplos de tomos que, debido a su
pequeo tamao, pueden disolverse
intersticialmente en cristales metlicos,
son: H, C, N y O. Ntese que todos
estos elementos de Z pequeo, son no
metales. Cuando ellos se disuelven en
un cristal metlico, siempre lo hacen en
una concentracin baja, por lo que el
material sigue siendo preponderan-
temente de enlace metlico.
Un ejemplo importante de soluciones
slidas intersticiales son las formadas
por el C disuelto intersticialmente en
Fe (CC, ferrita) y en Fe (CCC,
austenita. En la Fig. 3 se indican los
rangos de temperatura en que existen
estos estados alotrpicos del Fe puro.
Fig. 3 Estructuras cristalinas del Fe
El radio atmico del Fe (CCC) es de puro.
0,129 nm, mientras que el del C es de
0,075 nm, por lo que existe una
diferencia de radios atmicos del 42%p;
todos estos son valores aproximados
que dependen de la temperatura. Sin
embargo, pese a esta diferencia, solo es
posible una solubilidad intersticial
mxima de 2,08 %p.C (y a 1.148 C).
La Fig. 2 ilustra esquemticamente la
distorsin que provocan tomos
intersticiales en una matriz. El radio del
mayor intersticio en el Fe y (CCC) es de
0,053 nm (para el clculo, ver la Figs. 4
y 5). Puesto que el radio del tomo de C
es de 0,075 nm, no es sorprendente que
la solubilidad mxima del C en Fey sea
apenas de 2,08%p.
Fig. 4 Esquema para el clculo del
Por otra parte, el cristal Fea (CC) es tamao r de los espacios intersticiales
menos denso que el cristal Fey (CCC), y en un cristal CCC.
la solubilidad intersticial del C es
menor en el cristal menos denso (Fey,
CCC). Sin embargo, para la solubilidad,
lo que interesa es el tamao de los
intersticios especficos donde se ubicar
el C y no la densidad global de la
matriz, ver Fig. 5. En el Fea (CC), el
radio del mayor intersticio es solamente
de 0,036 nm, por lo que, por debajo de
723 C, apenas un 0,025%p.C puede
disolverse intersticialmente en el Fe.
Fig. 5 La distorsin del C intersticial es
Fuente principal: texto de W.F. Smith, menor en el cristal Fey (CCC),
Cap. 4. izquierda, que en el cristal Fea (CC),
derecha.
También podría gustarte
- Solidificación e Imperfecciones CristalinasDocumento54 páginasSolidificación e Imperfecciones CristalinasahsimAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Diferencia Entre Trabajo en Frio y Trabajo en CalienteDocumento5 páginasDiferencia Entre Trabajo en Frio y Trabajo en Calienteadolfo soto100% (1)
- ponentesMAYORITARIOS PDFDocumento32 páginasponentesMAYORITARIOS PDFAnonymous GzZzZqAún no hay calificaciones
- MóduloII. Principios Básicos de Metalurgia (Modo de Compatibilidad)Documento74 páginasMóduloII. Principios Básicos de Metalurgia (Modo de Compatibilidad)Ahora Con Todo PepitoAún no hay calificaciones
- Metales y AleacionesDocumento19 páginasMetales y AleacionesLuis MendozaAún no hay calificaciones
- Materiales Metalicos No FerrososDocumento6 páginasMateriales Metalicos No FerrososJuan Pablo Escobar De La TorreAún no hay calificaciones
- Soluciones Solidas As SmithDocumento3 páginasSoluciones Solidas As SmithLizbeth Huerta LarumbeAún no hay calificaciones
- Transformación de Fases - SolidificaciónDocumento40 páginasTransformación de Fases - SolidificaciónLUIS ANTHONY SALAS ARISTAAún no hay calificaciones
- Capitulo II Recuperado - NewDocumento30 páginasCapitulo II Recuperado - NewMárilyn GaiborAún no hay calificaciones
- Aleaciones 2014-1Documento23 páginasAleaciones 2014-1Luis OroscoAún no hay calificaciones
- Aleacion Cu-PbDocumento8 páginasAleacion Cu-PbRomina QuispeAún no hay calificaciones
- Trabajo Práctico N2 .OcxDocumento11 páginasTrabajo Práctico N2 .OcxJoaquín MaliziaAún no hay calificaciones
- Clase 5 25-04-07I Constitución de Aleaciones. Soluciones Sólidas 3Documento14 páginasClase 5 25-04-07I Constitución de Aleaciones. Soluciones Sólidas 3Anonymous mToOYXvcThAún no hay calificaciones
- Clase Diagramas de Fases MF IDocumento56 páginasClase Diagramas de Fases MF IMiguel RojasAún no hay calificaciones
- A4 CAPÍTULO II 85a137 SISTEMAS BINARIOSDocumento53 páginasA4 CAPÍTULO II 85a137 SISTEMAS BINARIOSNegro YepezAún no hay calificaciones
- VacanciasDocumento4 páginasVacanciasArlez HernandezAún no hay calificaciones
- Solidificación e Imperfecciones en SólidosDocumento4 páginasSolidificación e Imperfecciones en SólidosJose RAún no hay calificaciones
- Elemntos de MetalurgiaDocumento5 páginasElemntos de MetalurgiahAún no hay calificaciones
- Lue Clase 5.1Documento28 páginasLue Clase 5.1AleeFloresAún no hay calificaciones
- Ciencia de Los Materiales Semana 8Documento13 páginasCiencia de Los Materiales Semana 8Ivan Dante Zarauz CastilloAún no hay calificaciones
- Aleaciones y Diagramas de FaseDocumento36 páginasAleaciones y Diagramas de FaseDianira Apaza100% (1)
- Ciencia de Los Materiales Ultima PracticaDocumento5 páginasCiencia de Los Materiales Ultima PracticaIvan Dante Zarauz CastilloAún no hay calificaciones
- Soluciones SòlidasDocumento36 páginasSoluciones SòlidasLuis Miguel LluenAún no hay calificaciones
- Capitulo 4 de Ciencia, Ingenieria y ManufacturaDocumento94 páginasCapitulo 4 de Ciencia, Ingenieria y ManufacturaHector IbarraAún no hay calificaciones
- PPTXDocumento55 páginasPPTXApaza Suyo EdsonAún no hay calificaciones
- 8-Fases CristalinasDocumento34 páginas8-Fases Cristalinasoswaldo6220Aún no hay calificaciones
- Latona DoDocumento8 páginasLatona DoGean Paul Bueno FernándezAún no hay calificaciones
- Aleaciones Del Cobre y Sus Propiedades EspecíficasDocumento6 páginasAleaciones Del Cobre y Sus Propiedades EspecíficasVeLuisAún no hay calificaciones
- Unidad 3 AlvaradoalvarezDocumento13 páginasUnidad 3 AlvaradoalvarezJESUS ANGEL ALVARADO ALVAREZAún no hay calificaciones
- Escuela Superior Politécnica de ChimborazoDocumento97 páginasEscuela Superior Politécnica de ChimborazoFausto HaroAún no hay calificaciones
- Universidad Pedagogica y Tecnologica de Colombi1Documento13 páginasUniversidad Pedagogica y Tecnologica de Colombi1Brigitte PorezAún no hay calificaciones
- Al Eaci OnesDocumento9 páginasAl Eaci OnesDarwin Stalin Alcaciega PilcoAún no hay calificaciones
- Gran Resumen de Materiales MetálicosDocumento39 páginasGran Resumen de Materiales MetálicosjanotkutnAún no hay calificaciones
- Amalgama DentalDocumento16 páginasAmalgama DentalChristopher Tomás CataláAún no hay calificaciones
- Clase 6 Soluciones SólidaDocumento17 páginasClase 6 Soluciones SólidaMackenzie Aguilar SanzAún no hay calificaciones
- TEMA 9 Solidos Covalentes No MolecularesDocumento17 páginasTEMA 9 Solidos Covalentes No MolecularesTAMARAAún no hay calificaciones
- Aleaciones MetalicasDocumento6 páginasAleaciones Metalicasely.bayasAún no hay calificaciones
- Fabricacion de Aleaciones Binarias PB - SBDocumento10 páginasFabricacion de Aleaciones Binarias PB - SBMiguel Arguz100% (1)
- Diagramas de Fases-2Documento44 páginasDiagramas de Fases-2jose leonAún no hay calificaciones
- Unidad 3 - Consulta - CIENCIA E INGENIERIA DE LOS MATERIALESDocumento46 páginasUnidad 3 - Consulta - CIENCIA E INGENIERIA DE LOS MATERIALESvictorzuniga014Aún no hay calificaciones
- Ciencia de Los Materiales Practica 3Documento6 páginasCiencia de Los Materiales Practica 3Ivan Dante Zarauz CastilloAún no hay calificaciones
- 04 Defectos e Imperfecciones Red CristalinaDocumento9 páginas04 Defectos e Imperfecciones Red CristalinaMCano8921Aún no hay calificaciones
- 3 Fases de Los Materiales MetálicosDocumento19 páginas3 Fases de Los Materiales MetálicosDavid GrauAún no hay calificaciones
- Unidad 2Documento39 páginasUnidad 2Daniel FerminAún no hay calificaciones
- RESUMEN Cap 4Documento9 páginasRESUMEN Cap 4RikardoAún no hay calificaciones
- 04 AleacionesDocumento27 páginas04 AleacionesPérez Domm EsaúAún no hay calificaciones
- Reglas de Home RotheryDocumento8 páginasReglas de Home RotheryJuan Mejia BriseñoAún no hay calificaciones
- Defectos CristalinosDocumento11 páginasDefectos CristalinosjalomazAún no hay calificaciones
- Estructuras de Los MetalesDocumento11 páginasEstructuras de Los MetalesRoberto Laguna100% (4)
- 07 Materiales PDFDocumento44 páginas07 Materiales PDFCamilo EstradaAún no hay calificaciones
- 1 EXPO AleacionesDocumento25 páginas1 EXPO AleacionesAngelo Causa AyalaAún no hay calificaciones
- FCM I - Estructura de Las Aleaciones - 1ra Parte - 2017Documento31 páginasFCM I - Estructura de Las Aleaciones - 1ra Parte - 2017Ramiro BritoAún no hay calificaciones
- Diagrama de Fase 2020Documento27 páginasDiagrama de Fase 2020GEORGE DIEGO TRELLES YUCRAAún no hay calificaciones
- Resumen MetálicosDocumento31 páginasResumen MetálicosSebaLinardiAún no hay calificaciones
- DIAGRAMAS DE FASESexDocumento47 páginasDIAGRAMAS DE FASESexYhonatan Santiago GonzalezAún no hay calificaciones
- Propiedades Generales de Los Metales Del Bloque DDocumento11 páginasPropiedades Generales de Los Metales Del Bloque DJessica Acosta FigueroaAún no hay calificaciones
- 2201-Mendoza Rodriguez-Tecmatdiagrama de Fases de Hierro CarbonoDocumento31 páginas2201-Mendoza Rodriguez-Tecmatdiagrama de Fases de Hierro CarbonoAlexis Mendoza RodriguezAún no hay calificaciones
- Clase n2. Ciencia de Materiales 22Documento80 páginasClase n2. Ciencia de Materiales 22sfAún no hay calificaciones