Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Laboratorio Sobre PH y Soluciones Buffer
Cargado por
erickDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Laboratorio Sobre PH y Soluciones Buffer
Cargado por
erickCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL
SANTIAGO ANTNEZ DE MAYOLO
FACULTAD DE CIENCIAS DEL AMBIENTE
Escuela Profesional de Ingeniera Ambiental
TITULO:
LABORATORIO SOBRE PH Y SOLUCIONES
BUFFER
CURSO:
FISICOQUIMICA
DOCENTE: DR. YUPANQUI TORRES EDSON GILMAR
ALUMNO: LOLI GUERRERO ERICK YOVER
HUARAZ - 2016 - PER
PH Y SOLUCIONES BUFFER
I. Objetivos
Conocer el fundamento de la medicin de pH.
Medir el pH de diferentes soluciones y fluidos biolgicos.
Preparar soluciones amortiguadoras a pH definido.
Demostrar mediante experimentos, la importancia de los sistemas buffer
en fluidos biolgicos.
II. Marco terico
La gran mayora de las molculas orgnicas que se encuentran en los
organismos vivos existen en forma inica. Dependiendo de la naturaleza de la
carga, stas pueden ser aniones (cargada negativamente), cationes (cargados
positivamente) o anfolitos (con cargas positivas y negativas). La concentracin
a la cual estas molculas se encuentran en los tejidos y/o fluidos biolgicos es
de singular importancia, puesto que esto determina las posibilidades que
determinadas reacciones ocurran o no. Estas concentraciones son utilizadas en
clnica para el diagnstico de ciertas condiciones fisiolgicas o patolgicas.
La carga neta de las biomolculas orgnicas en solucin est determinada por
la concentracin de hidrogeniones [H+] en el medio, comnmente expresado
como pH.
El trmino pH fue introducido en 1909 por Sorensen, quien defini el pH como
el logaritmo negativo de la concentracin de iones hidrgeno:
Los valores de pH estn representados en una escala que abarca desde el 0
hasta 14. Los valores inferiores a 7,0 corresponden a concentraciones
elevadas de H+ (soluciones cidas) y los valores superiores a 7,0, equivalen a
concentraciones bajas de H+ (soluciones bsicas). El pH 7,0 es el valor de las
soluciones neutras.
Para calcular el pH de una solucin se debe realizar lo siguiente:
1. Calcular la concentracin de iones hidrgeno [H+]. Para esto debe
considerarse si se trata de un cido o base y stos son fuertes o dbiles.
Si se trata de un cido fuerte [H+] = [cido]; base fuerte [OH-] = [Base]
Si se trata de un cido dbil [H+] = Ka x [cido] ;
si es una base dbil [OH-] = Kb x [Base]
2. Para los cidos calcular el pH como el logaritmo negativo de [H+]
3. Para las bases calcular el pOH como el logaritmo negativo de [OH-] y luego
calcular el pH a partir de la expresin: pH = 14 - pOH
A nivel del laboratorio podemos medir el pH de diferentes soluciones con el
empleo del pHmetro o potencimetro o con el uso de tiras indicadoras.
PH metros
El pH de soluciones puede determinarse ms exactamente, por mediciones del
potencial de ciertos electrodos, que con el uso de tiras indicadoras. Los
instrumentos utilizados con tal fin, se conocen como pH-metros y estn
constituidos generalmente por un sistema potencimetro de dos electrodos.
Uno de los electrodos, construido generalmente de calomel, funciona como
electrodo de referencia (Er). El electrodo analtico puede ser de hidrgeno (Eh)
o de vidrio (Ev). Por razones prcticas es ms comnmente utilizado el
electrodo de vidrio. Modernamente ambos electrodos han sido integrados en
una unidad, conocida como electrodo integrado vidrio-clomen.
El potencimetro mide diferencia de potencial o fuerza electromotriz entre
ambos electrodos. En uno de los electrodos (Er) las condiciones son
constantes, mientras en el electrodo de vidrio (Ev) las condiciones son
variables, por cuanto es variable la [H+] de la solucin puesta en contacto con
l.
Para comprender los principios fundamentales del anlisis electromtrico o
potenciomtrico del pH, es necesario conocer las partes constituyentes del
electrodo de vidrio y la exacta relacin matemtica entre pH y la diferencia de
potencial entre el electrodo de referencia (Er) y el electrodo de vidrio (Ev).
Por equivalencia de unidades, los instrumentos de medida del pH, estn
diseados en tal forma que pueda hacerse la lectura directa del pH, sin
necesidad de conocer la diferencia de potencial.
En la prctica, se calibra el instrumento frente a un amortiguador o una serie de
amortiguadores de pH conocido y luego se procede a realizar la lectura del pH
en la solucin que se desea medir.
Soluciones Buffer
Son aquellas soluciones tambin llamadas soluciones amortiguadoras que se
oponen a los cambios bruscos de pH y estn constituidas por un cido o base
dbil y su par conjugado.
Debido al control que el pH ejerce sobre las biomolculas orgnicas en
solucin, es lgico pensar que los organismos vivos deben mantener un control
riguroso sobre cambios excesivos en el pH intra y extra celular (pH fisiolgico).
El pH fisiolgico es mantenido en un valor aproximado de 7,0 mediante la
accin de sistemas buffer biolgicos como H2CO3/ HCO3 - ;H2PO4 -/ HPO4 -2
y otros.
Este efecto puede ser demostrado en la prctica preparando un sistema buffer
(cido + base conjugada) y midiendo el pH de la solucin amortiguadora a
medida que se agrega un cido o una base fuerte, observndose el poder
amortiguador de la misma, obtenindose la llamada curva de titulacin.
Si se desea amortiguar una solucin a un pH determinado, se debe usar un
cido o base dbil cuyo pK no estn alejados a ms de 2 unidades de dicho
pH. Esto con la finalidad de que la capacidad amortiguadora de la solucin sea
la mayor posible.
En vista de la efectividad de los sistemas buffer en el mantenimiento del Ph
fisiolgico se hace necesario el estudio de los principales sistemas buffer que
se encuentran en los organismos vivos, entre los cuales se pueden mencionar
el
buffer
bicarbonato/cido
carbnico,
fosfato/cido
fosfrico,
protenas/proteinato, etc.
III. Materiales, equipo, soluciones y reactivos.
Bureta de 50 mL
Cilindro graduado de 50 mL
3 Erlenmeyers de 50 mL
Agitador magntico y plancha de agitacin
Potencimetro
Vaso de precipitado 100 mL
cido actico 0,1 N
NaOH 0,1 N
cido clorhdrico 0,1 M
Agua destilada
Plasma de bovino
Buffer fosfato pH 7,4
IV.Procedimiento experimental
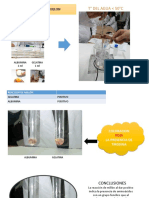
Experimento N 1
Clculo y determinacin del pH en soluciones cidas y bsicas.
Calcule y mida el pH de las siguientes soluciones con la ayuda de tiras
indicadoras o papel pH y el potencimetro. Anote los resultados para posterior
discusin.
Experimento N 2
Preparacin de un sistema amortiguador a partir de soluciones valoradas.
Utilizando soluciones de cido actico 0,1 M e hidrxido de sodio 0,1 M realice
los clculos para preparar 50 mL de una solucin amortiguadora de acetato 0,1
M pH 5 (pKa=4,74). Medir el pH (pH inicial) a 25 mL de agua, plasma,
amortiguador acetato (preparado por su equipo de trabajo) y buffer fosfato.
Luego agregar 1 mL de HCl 1 M a cada solucin y medir nuevamente el pH (pH
final). Registre los resultados en la tabla anexa e interprtelos.
VII. Cuestionario
1. Defina los siguientes trminos:
a. pH
b. Solucin cida.
c. Solucin alcalina.
d. Solucin amortiguadora.
2. Explique la funcin de un indicador cido-base.
3. Defina que es un buffer y como est constituido.
4. Calcule el pH de las siguientes soluciones
a. HCl 0,0003 M.
b. CH3COOH 7x10-5 M
c. NaOH 3x10 -2 M
5. Calcule el pH de una mezcla de iguales volmenes de cido actico 0,25 M y
acetato de sodio 0,1 M. El pKa del cido actico es 4,76
También podría gustarte
- Práctica 2Documento3 páginasPráctica 2Nazareth LucianaAún no hay calificaciones
- Práctica N°4 - EQUILIBRIO EN SISTEMAS ÁCIDO - BASE Y EN SOLUCIONES REGULADORASDocumento10 páginasPráctica N°4 - EQUILIBRIO EN SISTEMAS ÁCIDO - BASE Y EN SOLUCIONES REGULADORASJORGE LUIS BASTIAS BARRETOAún no hay calificaciones
- Preparación de Soluciones BufferDocumento17 páginasPreparación de Soluciones BufferLisa RobinsonAún no hay calificaciones
- Informe Soluciones Buffer IIDocumento6 páginasInforme Soluciones Buffer IIAndres Felipe Rojas RodriguezAún no hay calificaciones
- Soluciones Buffer o SolucionesDocumento4 páginasSoluciones Buffer o SolucionesAlejandro SalinasAún no hay calificaciones
- PH y Soluciones Amortiguadoras 1Documento10 páginasPH y Soluciones Amortiguadoras 1JESUS MEDARDO MONTENEGRO URREAAún no hay calificaciones
- Soluciones AmortiguadorasDocumento14 páginasSoluciones AmortiguadorasCristian Pozo100% (1)
- Tampones Fisiologicos Practica 02 EnzimologíaDocumento11 páginasTampones Fisiologicos Practica 02 EnzimologíaGianella AFAún no hay calificaciones
- Soluciones BufferDocumento9 páginasSoluciones BufferRoque Raycitho Elvis100% (1)
- PH y Soluciones Amortiguadoras. QuimicaDocumento4 páginasPH y Soluciones Amortiguadoras. QuimicaestebanAún no hay calificaciones
- Monografia Soluciones BuferDocumento16 páginasMonografia Soluciones Buferjuan100% (1)
- Determinación de PH y Soluciones AmortiguadorasDocumento3 páginasDeterminación de PH y Soluciones AmortiguadorasBrayan MejíaAún no hay calificaciones
- Práctica 5 Ácidos y BasesDocumento6 páginasPráctica 5 Ácidos y BasesChantal EspinalAún no hay calificaciones
- Informe 1 Soluciones BufferDocumento6 páginasInforme 1 Soluciones BufferMichael erazoAún no hay calificaciones
- Informe de Soluciones ReguladorasDocumento5 páginasInforme de Soluciones ReguladorasDarwin Montaño100% (1)
- Definición y Uso de PH y pOHDocumento4 páginasDefinición y Uso de PH y pOHVictor A H A.Aún no hay calificaciones
- Semana Clase de Flavonoides 2020Documento115 páginasSemana Clase de Flavonoides 2020caroline leguiaAún no hay calificaciones
- Soluciones Amortiguadoras o Buffers 1Documento6 páginasSoluciones Amortiguadoras o Buffers 1Benny LinaresAún no hay calificaciones
- Titulación Del HCL y NaOHDocumento13 páginasTitulación Del HCL y NaOHmgc176Aún no hay calificaciones
- Volumetría de NeutralizaciónDocumento4 páginasVolumetría de NeutralizaciónGabriel PérezAún no hay calificaciones
- Titulación de Ácidos Débiles Con Bases FuertesDocumento14 páginasTitulación de Ácidos Débiles Con Bases FuertesAlvaro EtcheverryAún no hay calificaciones
- annotated-PRE-INFORME TITULACION POTENCIOMETRIADocumento9 páginasannotated-PRE-INFORME TITULACION POTENCIOMETRIAJef Aguirre CalderonAún no hay calificaciones
- INFORME 6 - DETERMINACIÓN DE PH y Poh - SOLUCIONES AMORTIGUADORASDocumento3 páginasINFORME 6 - DETERMINACIÓN DE PH y Poh - SOLUCIONES AMORTIGUADORASNaomi BlasAún no hay calificaciones
- Informe BufferDocumento5 páginasInforme BufferNicole AHAún no hay calificaciones
- Titulacion Potenciometrica de HalurosDocumento7 páginasTitulacion Potenciometrica de HalurosCamilo DiazAún no hay calificaciones
- Reporte Practica 10. Determinacion Del Calor de Neutralizacion Del Acido Clorhidrico Con Hidroxido de Sodio. 224081Documento6 páginasReporte Practica 10. Determinacion Del Calor de Neutralizacion Del Acido Clorhidrico Con Hidroxido de Sodio. 224081Judith RomoAún no hay calificaciones
- EQUILIBRIO QUíMICO I 3 LaboratorioDocumento9 páginasEQUILIBRIO QUíMICO I 3 LaboratorioCamilo Duarte ChaparroAún no hay calificaciones
- Laboratorio de Acido BaseDocumento9 páginasLaboratorio de Acido BaseJose Gabriel Caamaño100% (1)
- BioquimicaDocumento11 páginasBioquimicaBertha Felix TarazonaAún no hay calificaciones
- Guia Fisicoquimica 2016 230 0Documento50 páginasGuia Fisicoquimica 2016 230 0Gerald MayaAún no hay calificaciones
- Determinación de Ácido Cítrico en Bebidas ComercialesDocumento3 páginasDeterminación de Ácido Cítrico en Bebidas ComercialesDani MoralesAún no hay calificaciones
- Sexto Informe. Reacciones de Acidos Carboxilicos y DerivadosDocumento9 páginasSexto Informe. Reacciones de Acidos Carboxilicos y DerivadosVíctorMoralesAún no hay calificaciones
- Analitica Laboratorio 8Documento10 páginasAnalitica Laboratorio 8Anonymous VcB5hZAún no hay calificaciones
- FenolftaleínaDocumento8 páginasFenolftaleínaRichardDiazChucosAún no hay calificaciones
- Soluciones, Acido-Katherine GarciaDocumento9 páginasSoluciones, Acido-Katherine GarciaIvane MolinaAún no hay calificaciones
- Soluciones AmortiguadorasDocumento28 páginasSoluciones AmortiguadorasNisha MarroquínAún no hay calificaciones
- Informe Quimica9Documento6 páginasInforme Quimica9Pepe Rojas YachasAún no hay calificaciones
- Practica No 13Documento2 páginasPractica No 13Nata SilvaAún no hay calificaciones
- Reconocimiento de ProteinasDocumento6 páginasReconocimiento de ProteinasEver LeonardoAún no hay calificaciones
- Presentación 8Documento5 páginasPresentación 8Luis EzequielAún no hay calificaciones
- Informe de PH en Alimentos, 1Documento12 páginasInforme de PH en Alimentos, 1Jarumy Palomino OrtizAún no hay calificaciones
- Informe de Soluciones Ácidas, Básicas y Neutras.Documento12 páginasInforme de Soluciones Ácidas, Básicas y Neutras.alejandraAún no hay calificaciones
- Determinacion Cuantitativa de ProteinasDocumento6 páginasDeterminacion Cuantitativa de ProteinasLenny Dayana España FdezAún no hay calificaciones
- Practica 2 Soluciones BufferDocumento10 páginasPractica 2 Soluciones BufferAlexandra LópezAún no hay calificaciones
- Curva de Titulacion..... Acido Debil - Base FuerteDocumento14 páginasCurva de Titulacion..... Acido Debil - Base FuerteGeovi Condori CortezAún no hay calificaciones
- Imforme 10Documento8 páginasImforme 10DIEGO FERNANDO CHECA INTIAún no hay calificaciones
- Acidos Polipróticos - 26042010Documento9 páginasAcidos Polipróticos - 26042010Tuti Lopez0% (1)
- Práctica 5Documento11 páginasPráctica 5Yesenia FloresAún no hay calificaciones
- Volumetría Con Formación de ComplejosDocumento5 páginasVolumetría Con Formación de ComplejosAndresFelipeChinguadObandoAún no hay calificaciones
- PRACTICA 4 FuncionalDocumento18 páginasPRACTICA 4 FuncionalMary PC100% (1)
- Funcional Practica 15Documento6 páginasFuncional Practica 15maria100% (2)
- Lab. BioquinicaDocumento11 páginasLab. BioquinicaManuel BustamanteAún no hay calificaciones
- Equilibrio Quimico 8Documento5 páginasEquilibrio Quimico 8SOLEDADAún no hay calificaciones
- Informe Química VIDocumento9 páginasInforme Química VIChristian Navarro TamayoAún no hay calificaciones
- 2 - PH Curvas de Titulacion y Soluciones BufferDocumento7 páginas2 - PH Curvas de Titulacion y Soluciones Bufferstephanie esther escobar sotoAún no hay calificaciones
- Medidas Potenciometricas de PHDocumento27 páginasMedidas Potenciometricas de PHSandra Nancy Ccama MamaniAún no hay calificaciones
- Informe12 Determinacion Potenciometrica Del PHDocumento9 páginasInforme12 Determinacion Potenciometrica Del PHJeslin Alvino FabianAún no hay calificaciones
- PH Informe 12Documento14 páginasPH Informe 12Joselyn Matias BrañezAún no hay calificaciones
- Informe Valoraciones PotenciometricasDocumento22 páginasInforme Valoraciones PotenciometricasJuan Diego Jiménez FornoAún no hay calificaciones
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- 04 Ley Sinagerd y El Planagerd PDFDocumento20 páginas04 Ley Sinagerd y El Planagerd PDFJuan Jose CamarenaAún no hay calificaciones
- Matriz Oms MineriaDocumento2 páginasMatriz Oms MineriaerickAún no hay calificaciones
- ProcedimientoDocumento14 páginasProcedimientoerickAún no hay calificaciones
- Metodo AciDocumento9 páginasMetodo AcierickAún no hay calificaciones
- Iso 45001Documento9 páginasIso 45001erickAún no hay calificaciones
- MatricesDocumento2 páginasMatriceserick100% (1)
- Laboratorio 2 Etapa 2Documento16 páginasLaboratorio 2 Etapa 2erickAún no hay calificaciones
- Quim. Mario Leyva CollasDocumento74 páginasQuim. Mario Leyva CollaserickAún no hay calificaciones
- Informe AguasDocumento28 páginasInforme AguaserickAún no hay calificaciones
- Fundicion Del PlomoDocumento47 páginasFundicion Del Plomotyson75% (4)
- AnualidadesDocumento11 páginasAnualidadesSelene Monserrat G. MartínezAún no hay calificaciones
- Planeación y Control de Inventarios de Una EmpresaDocumento11 páginasPlaneación y Control de Inventarios de Una EmpresaerickAún no hay calificaciones
- Clase 4 - Metabolismo MicrobianoDocumento54 páginasClase 4 - Metabolismo MicrobianoerickAún no hay calificaciones
- Informe AguasDocumento28 páginasInforme AguaserickAún no hay calificaciones
- Actividad MineraDocumento67 páginasActividad MineraerickAún no hay calificaciones
- Accion Geologica Del MarDocumento20 páginasAccion Geologica Del MarerickAún no hay calificaciones
- TicDocumento11 páginasTicerickAún no hay calificaciones
- Investigación CientíficaDocumento23 páginasInvestigación CientíficaerickAún no hay calificaciones
- Problema de InvestigaciónDocumento4 páginasProblema de InvestigaciónerickAún no hay calificaciones
- TGS Toma de DecisionesDocumento7 páginasTGS Toma de DecisioneserickAún no hay calificaciones
- Edafología 5Documento13 páginasEdafología 5erickAún no hay calificaciones
- Edafología 1Documento9 páginasEdafología 1lizbethAún no hay calificaciones
- Problema de InvestigaciónDocumento4 páginasProblema de InvestigaciónerickAún no hay calificaciones
- Recombinacion Genética 7-0Documento7 páginasRecombinacion Genética 7-0erickAún no hay calificaciones
- Especies en Extinción en El PeruDocumento25 páginasEspecies en Extinción en El PeruerickAún no hay calificaciones
- Estadística y ProbabilidadDocumento28 páginasEstadística y ProbabilidaderickAún no hay calificaciones
- Maquina RiaDocumento2 páginasMaquina RiaerickAún no hay calificaciones
- Estacion ChuquicaraDocumento9 páginasEstacion ChuquicaraerickAún no hay calificaciones
- Prueba de ChiDocumento5 páginasPrueba de ChiGonzalo Chauca AguirreAún no hay calificaciones
- LMP Efluentes Minero MetalurgicosDocumento4 páginasLMP Efluentes Minero MetalurgicosGustavo Cesar VazquezAún no hay calificaciones
- DD072 Herramientas Inform Ticas de Gesti N de ProyectosDocumento4 páginasDD072 Herramientas Inform Ticas de Gesti N de Proyectosalvaro villamizarAún no hay calificaciones
- Cert 1461 Act5 IC60N 2022Documento68 páginasCert 1461 Act5 IC60N 2022Francisco Ordoñez MuñozAún no hay calificaciones
- Tumbes Taller ViiDocumento86 páginasTumbes Taller ViijessicabeAún no hay calificaciones
- ¿Matemático, Yo ¡Claro Que Sí! (Parte 2) 11-11-2020Documento5 páginas¿Matemático, Yo ¡Claro Que Sí! (Parte 2) 11-11-2020Noelia CarrilloAún no hay calificaciones
- La Sagrada FamiliaDocumento6 páginasLa Sagrada FamiliaNella VelazcoAún no hay calificaciones
- Notas de Anexos AmuayDocumento532 páginasNotas de Anexos Amuayluis100% (1)
- Caso 6. Excel Automotriz - 30506Documento21 páginasCaso 6. Excel Automotriz - 30506carlosAún no hay calificaciones
- Metodo de AndersonDocumento8 páginasMetodo de AndersonLucy Elida Sánchez mallmaAún no hay calificaciones
- Criptomonedas La Caída Del Imperio de Las CriptomonedasDocumento40 páginasCriptomonedas La Caída Del Imperio de Las CriptomonedasMaira RivasAún no hay calificaciones
- FAO Nutrición y Sistemas Alimentarios Cap 1Documento25 páginasFAO Nutrición y Sistemas Alimentarios Cap 1FrancoIgnacioLópezFerradaAún no hay calificaciones
- Metodos NumericosDocumento15 páginasMetodos NumericosYARELYAún no hay calificaciones
- Examen Unidad 1Documento7 páginasExamen Unidad 1MARTHA MARTINEZ100% (1)
- Descriptores de Cargo - 2018Documento3 páginasDescriptores de Cargo - 2018Pablo Painen GonzalezAún no hay calificaciones
- Acumulación Por Desposesión David Harvey Concept - Pesquisa GoogleDocumento2 páginasAcumulación Por Desposesión David Harvey Concept - Pesquisa GooglecareAún no hay calificaciones
- Acerca de La Entrevista ClinicaDocumento9 páginasAcerca de La Entrevista ClinicaFelipe FernandezAún no hay calificaciones
- Parte TeoricaDocumento17 páginasParte TeoricaMauricio Medrano MaciasAún no hay calificaciones
- ENCANDILAMIENTODocumento5 páginasENCANDILAMIENTOMario Daniel Alvia ZambranoAún no hay calificaciones
- Taller 4 Semana de Receso Escolar Octubre 2022Documento3 páginasTaller 4 Semana de Receso Escolar Octubre 2022jhoan santiagoAún no hay calificaciones
- Ficha Ped - Emprend 1bgu S5 24 Al 28-10-2022Documento3 páginasFicha Ped - Emprend 1bgu S5 24 Al 28-10-2022James AlfaroAún no hay calificaciones
- Actividad 1 - Mecánica de SuelosDocumento6 páginasActividad 1 - Mecánica de SuelosAndy Fernando Medina ValenciaAún no hay calificaciones
- Examen de Tasaciones y Peritaciones PDFDocumento2 páginasExamen de Tasaciones y Peritaciones PDFchicopreuAún no hay calificaciones
- Informe Topografico Poligonal AbiertaDocumento9 páginasInforme Topografico Poligonal AbiertaRoyman RamírezAún no hay calificaciones
- PLAN DE CUENTAS EN BASE A LAS NC VacioDocumento6 páginasPLAN DE CUENTAS EN BASE A LAS NC VacioNicolás MAún no hay calificaciones
- Pictogram ADocumento2 páginasPictogram ASabadoGrisAún no hay calificaciones
- Autoriz Judicial Disponer Bs Viaje MenorDocumento6 páginasAutoriz Judicial Disponer Bs Viaje MenoreduardoAún no hay calificaciones
- Informe de RiesgoDocumento10 páginasInforme de RiesgoJose GregorioAún no hay calificaciones
- Timpanis MoDocumento52 páginasTimpanis MoCris MartinezAún no hay calificaciones
- Elementos de La Pre LecturaDocumento1 páginaElementos de La Pre LecturaFernando YzfAún no hay calificaciones
- Cuestionario MicroDocumento2 páginasCuestionario MicroYaki MoyaAún no hay calificaciones
- AP07-EV04 - Taller Sobre Preposiciones y Vocabulario Exhibición ComercialDocumento6 páginasAP07-EV04 - Taller Sobre Preposiciones y Vocabulario Exhibición ComercialTawanda PetersonAún no hay calificaciones