Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Espectrofotometria de Absorcion Molecular
Cargado por
angus a.Descripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Espectrofotometria de Absorcion Molecular
Cargado por
angus a.Copyright:
Formatos disponibles
Qumica Analtica Instrumental 63.
15
Espectrofotometra de Absorcin Molecular
1-
Los iones titanio y vanadio forman peroxo-complejos coloreados en presencia de H2O2, y
sus concentraciones se pueden determinar por espectrofotometra. Los datos de
absorbancia para las dos especies y para una muestra que contiene a ambos, medidas en
una celda de 1,00 cm de camino ptico, se presentan en el siguiente cuadro:
Peroxo-complejo de
g/mL de cada ion
Ti
V
Muestra
40,0
120,0
?
Absorbancia
410 nm
460 nm
0,608
0,410
0,444
0,600
0,849
0,755
Calcular las concentraciones de titanio y de vanadio en la muestra.
R:
2-
Ti = 38,1 g/mL V = 72,9 g/mL
Las absorbancias medidas a 220 nm, de una serie de soluciones patrones de NO3-, usando
una celda de 1,00 cm, son las siguientes:
NO3- [mg/mL]
0,0040 0,015 0,025 0,035 0,040 0,050 0,060 0,070
Absorbancia
0,097
0,208 0,347 0,450 0,553 0,620 0,668 0,688
La absorbancia de una muestra de agua de ro tomada cerca de una planta qumica es
0,642, medida a la misma longitud de onda y en la misma celda. Qu concentracin de
NO3-, en mg/mL, hay en el ro?
R:
3-
0,0565 mg/mL
Una solucin 7,50 x 10-5 M de KMnO4 tiene una absorbancia de 0,658 medida en una
celda de 1,50 cm a 525 nm.
a) Calcular la absortividad molar () para tal solucin en las condiciones de la medicin.
b) Calcular la absortividad (a) en las mismas condiciones, pero expresando la
concentracin de KMnO4 en ppm.
c) Calcular el porcentaje de transmitancia (%T) de la solucin indicada, si la medicin
hubiera sido realizada en una celda de 1,00 cm.
Datos: Mr (KMnO4) = 158,04
R:
a) = 5,85 x 103 lmol-1cm-1
b) a = 3,70 x 10-2 lmg-1cm-1
c) %T = 36,4 %
Qumica Analtica Instrumental 63.15
4-
Una muestra de 1,000 g de acero se disolvi en cido ntrico y el manganeso se oxid a
permanganato con peryodato de potasio. Se llev a 100 mL en matraz aforado. Se midi la
absorbancia de una alcuota de esta solucin y se encontr que tena una absorbancia 2,50
veces mayor que la de una solucin patrn 0,0020 M de KMnO4, leda en las mismas
condiciones. Calcular el %m/m de Mn en el acero. Qu suposicin est usando?
Datos: Ar (Mn) = 54,94
R:
5-
2,747 %m/m
La cantidad de un contaminante X en una muestra de agua de lago se determin por
espectrometra de absorcin. Se prepararon 4 soluciones y se midi la transmitancia de
cada una usando la misma celda de 1,00 cm a la misma longitud de onda. Los resultados
se muestran en la siguiente tabla:
Solucin N
1
2
3
4
Composicin
Agua destilada
Agua destilada ms todas las especies (excepto X) del agua
del lago, en las mismas concentraciones del agua del lago
Solucin 2 ms 5,00 ppm de X
1,00 mL de agua del lago diluida a 100,0 mL con solucin 2
%T
100,0
72,5
12,4
32,7
Cul es la concentracin de X (en ppm) en el agua del lago?
R:
6-
225 ppm
Muestras de sangre, orina y soluciones de acetona se analizaron por espectrofotometra
usando la misma celda y a la misma longitud de onda. Excepto por una correccin por
"blanco" del instrumento de A = 0,045, solamente la acetona absorbe a la longitud de onda
elegida. Los datos de las soluciones de acetona se muestran en la tabla:
Cacetona [mg/100
mL]
Absorbancia
0,500
1,000
2,000
4,000
6,000
8,000
0,057
0,068
0,091
0,137
0,183
0,229
Los registros de las muestras de sangre y orina de una persona normal y de un paciente
que sufre cetosis (niveles de acetona anormalmente altos) fueron:
A orina = 0,097
Persona normal:
A sangre = 0,068
A orina (dilucin 1/ 25) = 0,198
Paciente:
A sangre = 0,189
Calcule el nivel de acetona en mg/100 mL de fluido para las 4 muestras.
R:
Normal: cetona sangre = 0,992 mg/100 mL
Paciente:
cetona orina = 2,26 mg/100 mL
cetona sangre = 6,26 mg/100 mL
cetona orina = 166 mg/100 mL
Qumica Analtica Instrumental 63.15
7-
Un cido dbil, HX, tiene una ka = 2,50 x 10-5. Slo HX absorbe a 450 nm. Se agregan
0,0100 mmol de HX a 100 mL de una solucin buffer de pH 4,000. La absorbancia de esta
solucin a 450 nm, medida en una celda de 1,00 cm, es de 0,360. Determinar:
a) HX a 450 nm; b) la absorbancia de la solucin en una celda de 1,00 cm a 450 nm, si se
agregan 0,0100 mmol de HX a 100 mL de HCl 0,100 M; c) la absorbancia si se agregan
20,00 mmol de NaX a 100 mL de una solucin buffer de pH 9,000.
R:
8-
a) 4,50 x 103 lmol-1cm-1
b) A = 0,450
c) A = 0,036
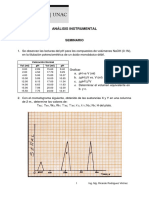
Dado el espectro de absorcin de la figura (registrado con un espectrofotmetro con ancho
de banda = 1 nm), dibuje y justifique la forma de los siguientes grficos, que obtendr
midiendo % T en un espectrofotmetro de ancho de banda fijo = 20 nm.
A
a)
b)
c)
d)
e)
vs
T vs
vs C a 1 y 3
A vs C a 1, 2 y 3
T vs C a 3
Justifique claramente sus respuestas
9-
El Rojo de Fenol (HR) y su anin (R-) de pKa = 7,0 presentan los espectros de absorcin
que muestra la figura.
Dibuje en un solo grfico:
a) A a 400 nm vs C (concentracin analtica) en solucin regulada a pH = 4.
b) A a 400 nm vs C en solucin regulada a pH = 9.
c) A a 400 nm vs C sin regular pH.
d) A a 480 nm vs C sin regular pH.
e) A a 600 nm vs C en solucin regulada a pH = 9.
Comente sus resultados en cuanto al cumplimiento de la ley de Beer en cada caso.
Justifique con ecuaciones (admita que dispone de un equipo de ancho de banda lo
suficientemente pequeo como para no considerar los efectos de policromaticidad).
3
Qumica Analtica Instrumental 63.15
Considerar Concentracin C en moles de HR disueltos/litro.
Ayuda: HR es un cido dbil, por lo tanto, su grado de disociacin aumenta con la
dilucin
Coeficiente de
Absorcion Molar
(cm-1 M-1)
R-
HR
400 480
600
Longitud de
onda (nm)
También podría gustarte
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- InstrumentalDocumento9 páginasInstrumentaldavidAún no hay calificaciones
- Practica 2 Curva Tipo - 1Documento4 páginasPractica 2 Curva Tipo - 1Jesus LopezAún no hay calificaciones
- Ejercicios de Calibración 2.2Documento8 páginasEjercicios de Calibración 2.2v.cttor003Aún no hay calificaciones
- Guia N 1Documento4 páginasGuia N 1Daniel Alfonso Céspedes PerezAún no hay calificaciones
- Guia Ejercicios Analisis Instrumental N°2-2022Documento4 páginasGuia Ejercicios Analisis Instrumental N°2-2022ChasconaAún no hay calificaciones
- Analisis de Sodio Por EEADocumento13 páginasAnalisis de Sodio Por EEAJose FarfanAún no hay calificaciones
- Practica 5 Metodos de CalibracionDocumento9 páginasPractica 5 Metodos de CalibracionBladimir Alex Quispe Rocha100% (1)
- Emisión AtómicaDocumento28 páginasEmisión Atómicasheylaquispe199Aún no hay calificaciones
- Practica 6 Metodos OpticosDocumento11 páginasPractica 6 Metodos OpticosBladimir Alex Quispe RochaAún no hay calificaciones
- Tarea EspectrofotometriaDocumento4 páginasTarea EspectrofotometriaJahuey UnalescoAún no hay calificaciones
- AI EJ Métodos Ópticos 20Documento3 páginasAI EJ Métodos Ópticos 20Karla A. Rodríguez0% (2)
- Emulsiones2 5453Documento8 páginasEmulsiones2 5453ANDRADE0% (1)
- Analitica ProblemasDocumento6 páginasAnalitica Problemasmartin11_91Aún no hay calificaciones
- Qué Indica La Ley de BeerDocumento5 páginasQué Indica La Ley de BeerConambiente S.A.SAún no hay calificaciones
- Fotocolorimetria 2Documento9 páginasFotocolorimetria 2Germán Guerra Fernández0% (1)
- Quimica AnaliticaDocumento11 páginasQuimica AnaliticaLwizFernissTkmVrsAún no hay calificaciones
- Problemas Tema 12Documento2 páginasProblemas Tema 12Ale VazquezAún no hay calificaciones
- Practico N°10 - Espectroscopia - 2023Documento3 páginasPractico N°10 - Espectroscopia - 2023ivan RicaldezAún no hay calificaciones
- Guiade EjerciciosdeespectrofotometriaDocumento2 páginasGuiade EjerciciosdeespectrofotometriaDiego RuizAún no hay calificaciones
- Diagrama de Analisis QuimicoDocumento3 páginasDiagrama de Analisis QuimicoMeagan Gordon100% (1)
- RESUMENDocumento7 páginasRESUMENCamila Herrera VillarAún no hay calificaciones
- Espectrofotometria 2012 IIDocumento36 páginasEspectrofotometria 2012 IIJhimmy Saucedo CercadoAún no hay calificaciones
- Ejercicios FisicaDocumento7 páginasEjercicios FisicaVentas TupperwareAún no hay calificaciones
- Determinación de Hierro en Alimentos Por Espectroscopía de Ultravioleta - VisibleDocumento6 páginasDeterminación de Hierro en Alimentos Por Espectroscopía de Ultravioleta - VisibleLuisaGordon100% (1)
- Seminario 14Documento4 páginasSeminario 14Vanesa GallardoAún no hay calificaciones
- Practica Numero 3.0Documento13 páginasPractica Numero 3.0Angel Vargas ArizapanaAún no hay calificaciones
- Ejercicios Análisis InstrumentalDocumento4 páginasEjercicios Análisis InstrumentalMarcos JimenezAún no hay calificaciones
- Ejercicios Uv. Vis. 2021 BDocumento3 páginasEjercicios Uv. Vis. 2021 BDAVID ISRAEL MARTINEZ HERNANDEZAún no hay calificaciones
- Preparación Soluciones y Recta Calibrado en InstrumentalesDocumento20 páginasPreparación Soluciones y Recta Calibrado en InstrumentalesSherilyn RuizAún no hay calificaciones
- Quimica 2Documento8 páginasQuimica 2Manuel DGcAún no hay calificaciones
- Seminario de Problemas para Examen Final PDFDocumento4 páginasSeminario de Problemas para Examen Final PDFCarlos Baca SanchezAún no hay calificaciones
- Practico 5 Eaa EeaDocumento6 páginasPractico 5 Eaa Eeapablo.cea2201Aún no hay calificaciones
- 1014Documento3 páginas1014Jhoan RiveraAún no hay calificaciones
- Banco de Reactivos para Examen de Medio Ciclo de Análisis InstrumentalDocumento4 páginasBanco de Reactivos para Examen de Medio Ciclo de Análisis InstrumentalHector AriasAún no hay calificaciones
- Informe de SaliciatosDocumento9 páginasInforme de SaliciatosAriana MuñozAún no hay calificaciones
- Ejercicios Química Analítica D Cap. 5 y 6 2014-IIDocumento4 páginasEjercicios Química Analítica D Cap. 5 y 6 2014-IIJohn Dennis Tadeo FloresAún no hay calificaciones
- Concentracion de HierroDocumento11 páginasConcentracion de HierroJOSE ABADAún no hay calificaciones
- Hoja 2 ProblemasDocumento5 páginasHoja 2 ProblemasHernán Huaman CamposAún no hay calificaciones
- Calibración de Métodos Instrumentales PDFDocumento5 páginasCalibración de Métodos Instrumentales PDFCintia MartínezAún no hay calificaciones
- Ejercicios (Maylee Ramos)Documento17 páginasEjercicios (Maylee Ramos)Arthur GalianoAún no hay calificaciones
- PROBLEMAS AnaliticaDocumento11 páginasPROBLEMAS Analiticagato1992100% (1)
- DEBER DE ESPECTROFOTM. UV-VISIBLE BQF 4to. NIVEL ABRIL - SEPT. 2020Documento4 páginasDEBER DE ESPECTROFOTM. UV-VISIBLE BQF 4to. NIVEL ABRIL - SEPT. 2020Maryel MuñozAún no hay calificaciones
- Ejercicios de Espectroscopia PDFDocumento4 páginasEjercicios de Espectroscopia PDFvev patAún no hay calificaciones
- Fotometria UvvisDocumento8 páginasFotometria UvvismaximoramalloAún no hay calificaciones
- Absorción AtómicaDocumento64 páginasAbsorción AtómicaJoseluis Campean Sedano100% (1)
- Desviaciones A La Ley de BeerDocumento13 páginasDesviaciones A La Ley de BeerAlvaro Etcheverry0% (1)
- Problemas Cromatografía 2015-2 PDFDocumento5 páginasProblemas Cromatografía 2015-2 PDFsofia amelia salvadorAún no hay calificaciones
- 3 Fluorescencia MolecularDocumento8 páginas3 Fluorescencia MolecularIgnacio CostillaAún no hay calificaciones
- Ejercicios de Afii Espectroscopia de Absorción Molecular Uv-Visible1Documento8 páginasEjercicios de Afii Espectroscopia de Absorción Molecular Uv-Visible1Alexis Eduardo Peña RangelAún no hay calificaciones
- AmonioDocumento4 páginasAmoniostephanny julieth benitez obregonAún no hay calificaciones
- Problemas de Espectroscopia UVDocumento9 páginasProblemas de Espectroscopia UVPablo Barrios100% (1)
- Desplazamiento de Bandas y Determinación Espectrofotométrica Del Pka de Un IndicadorDocumento17 páginasDesplazamiento de Bandas y Determinación Espectrofotométrica Del Pka de Un IndicadorKaysser Alberto Villar CaleroAún no hay calificaciones
- Deber de Espectrometria Uv-Visible Sept. - Febrero 2020Documento3 páginasDeber de Espectrometria Uv-Visible Sept. - Febrero 2020Daniel CapelloAún no hay calificaciones
- Taller TermodinamicaDocumento15 páginasTaller TermodinamicaCarolina LeonAún no hay calificaciones
- Caracterización química, morfológica y estructural de materialesDe EverandCaracterización química, morfológica y estructural de materialesAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- AM3 Murmis - Campo de Velocidades y Potencial Complejo PDFDocumento12 páginasAM3 Murmis - Campo de Velocidades y Potencial Complejo PDFangus a.Aún no hay calificaciones
- Descripcion de Hornos Metalurgicos PDFDocumento30 páginasDescripcion de Hornos Metalurgicos PDFangus a.Aún no hay calificaciones
- PotenciometriaDocumento3 páginasPotenciometriaangus a.Aún no hay calificaciones
- Simulacion de Planta de Gas UTNDocumento4 páginasSimulacion de Planta de Gas UTNangus a.Aún no hay calificaciones
- Lista de Organismos NormalizadoresDocumento4 páginasLista de Organismos Normalizadoresangus a.Aún no hay calificaciones
- Descripcion de Hornos Metalurgicos PDFDocumento30 páginasDescripcion de Hornos Metalurgicos PDFangus a.Aún no hay calificaciones
- Seleccion-De-Materiales Empleados en La Industria Quimica PDFDocumento34 páginasSeleccion-De-Materiales Empleados en La Industria Quimica PDFangus a.Aún no hay calificaciones
- Técnicas AtómicasDocumento22 páginasTécnicas Atómicasangus a.Aún no hay calificaciones
- CromatografíaDocumento29 páginasCromatografíaangus a.Aún no hay calificaciones
- Lista de Organismos NormalizadoresDocumento4 páginasLista de Organismos Normalizadoresangus a.Aún no hay calificaciones
- Técnica ElectroquímicasDocumento47 páginasTécnica Electroquímicasangus a.Aún no hay calificaciones
- Aproximación de Born-OppenheimerDocumento20 páginasAproximación de Born-Oppenheimerangus a.Aún no hay calificaciones
- Examen EspectroscopíaDocumento7 páginasExamen Espectroscopíaangus a.Aún no hay calificaciones
- Interpolación y AproximaciónIII PDFDocumento2 páginasInterpolación y AproximaciónIII PDFangus a.Aún no hay calificaciones
- Capitulos 1,2y3 PDFDocumento64 páginasCapitulos 1,2y3 PDFangus a.Aún no hay calificaciones
- INTEGRADOR Algebra FiubaDocumento10 páginasINTEGRADOR Algebra Fiubaangus a.Aún no hay calificaciones
- INTEGRADOR FiubaDocumento2 páginasINTEGRADOR Fiubaangus a.Aún no hay calificaciones
- INTEGRADOR Algebra FiubaDocumento2 páginasINTEGRADOR Algebra Fiubaangus a.Aún no hay calificaciones