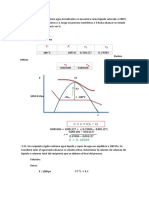
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Hibridaciones Sp3 Sp2 SP
Hibridaciones Sp3 Sp2 SP
Cargado por
Miriam SánchezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Hibridaciones Sp3 Sp2 SP
Hibridaciones Sp3 Sp2 SP
Cargado por
Miriam SánchezCopyright:
Formatos disponibles
Tema 4 Orbtales Moleculares
Orbital atmico s, p (d y f)
hibridacin
orbitales hbridos sp
3
, sp
2
y sp
Los orbitales atmicos se mezclan
para formar nuevos orbitales hbridos
Se altera la forma y orientacin
de los orbitales atmicos pero
el nmero permanece constante
o hibridizacin
Hibridacin
Hibridacin de orbitales.
En algunas molculas se presenta el problema de explicar cmo a partir de
orbitales atmicos diferentes se pueden formar enlaces idnticos. Hay que suponer
que durante la reaccin se produce un proceso de hibridacin o recombinacin de
orbitales atmicos puros, resultando unos nuevos orbitales atmicos hbridos.
Dichos orbitales se caracterizan por:
1. Se produce el mismo nmero de orbitales hbridos que orbitales atmicos de
partida.
2. Son todos iguales, energticamente y formalmente. Slo se diferencian en su
orientacin espacial.
3. Para que pueda existir hibridacin, la energa de los orbitales atmicos de
partida debe ser muy similar.
4. Los ngulos entre ellos son iguales.
Puede haber diferentes combinaciones de orbitales atmicos
Esa simbologa indica el nmero de orbitales atmicos puros que
se estn combinando y el tipo de cada uno de ellos.
sp significa que se combina un orbital s con un p
sp
2
significa que se combina un orbital s con dos p
sp
3
significa que se combina un orbital s con tres p
sp
3d
significa que se combina un orbital s tres p y un d
sp
3
d
2
significa que se combina un orbital s tres p y dos d
Formas geomtricas
Formacin de la hibridacin sp
3
s
p
x
p
y
p
z
orbitales atmicos
2s
2p
hibridacin
sp
3
geometra tetradrica
X
109.5
o
cuatro orbitales
Formacin de la hibridacin sp
2
s
p
x
p
y
p
z
120
o
orbitales atmicos
2s
2p
hibridacin
sp
2
orbital vaco
2p
geometra planar
tres orbitales
Formacin de la hibridacin sp
s
p
x
p
y
p
z
180
o
orbitales atmicos
2s
2p
hibridacin
sp
dos orbitales
vacos 2p
geometra lineal
dos orbitales
C C
H H
etino o acetileno
Hibridaciones sp
3
, sp
2
y sp
B N C
Be
O
Cl
Br
I
3A 4A 5A 6A 7A
2A
sp
sp
2
sp
3
sp
2
sp
sp
3
sp
3
sp
2
sp
tipo y nmero de enlaces
sp
3
sp
2
sp
4 enlaces sencillos
un enlace doble y dos sencillos
un enlace triple y un sencillo
sp
2
sp
3
sp
3
sp
3
Combinacin de orbitales atmicos. Orbitales (sigma) y (pi):
enlace sigma formado por
dos orbitales sp3 - sp3
enlace sigma formado por
dos orbitales sp3 - sp3
Enlace sencillo formado por un enlace en la molcula de etano
Doble enlace formado por un enlace y un enlace en la molcula de eteno (etileno)
Ejemplos de hibridacin sp
3
molcula de metano
CH
4
C
H
H
H
H
metano
CH
3
- CH
2
- CH
3
Propano
sp
3
sp3
sp3
Molcula de agua (geometra tetradrica)
H O H
H
2
O
NH
3
N
H
H
H
Molcula de amoniaco (geometra tetradrica)
Molcula de BF
3
(geometra trigonal planar)
F
F
F
B
orbitales 2p del Fluor
tres orbitales
sp
2
del boro
BF
3
B F
F
F
Molcula de BeCl
2
(geometra lineal)
BeCl
2
Be Cl Cl
Molcula de dixido de carbono (geometra lineal)
C
orbital sp
orbitales p
O
orbital p orbitales p
orbitales sp
2 orbitales sp
2
O
enlace sigma
enlace sigma
enlace pi
enlace pi
par de e
-
CO
2
Enlaces pi
Enlaces sigma
La molcula CO
Contiene 10 electrones de valencia que forman una distribucin electrnica de
octetos: Un enlace triple y un par de electrones solitarios tanto en C como en
O. Esto requiere que ambos tomos sufran una hibridacin sp.
El enlace triple consiste entonces de un sigma formado por los spde ambos
tomos y dos enlaces pi productos del recubrimiento de los orbitales 2p tanto en
C como en O . La molcula es forzosamente lineal.
2s
2p
estado
basal
promocin de
un electrn
4 orbitales sp
3
2s
2p
promocin de
un electrn
3 orbitales sp
2
y un orbital p
2s
2p
promocin de
un electrn
2 orbitales sp y 2 orbitales p
Hibridaciones del carbono, mostrando los electrones de valencia
s + 3 p 4 sp
3
s + 2 p 3 sp
2
+ 1 p
s + p 2 sp + 2 p
Hibridaciones del nitrgeno, mostrando los electrones de valencia
2s
2p
estado basal
promocin de
un orbital
4 orbitales sp
3
2s
2p
3 orbitales sp
2
y un orbital p
2s
2p
2 orbitales sp
y 2 orbitales p
promocin de
un orbital
promocin de
un orbital
Hibridacin: sp
3
d = s + 3 p + d 5 sp
3
d + 4 d
Geometra = bipiramidal Ejemplo: PCl
5
Hexafluoruro de azufre (SF
6
); hibridacin sp
3
d
2
:
El Azufre tiene de nmero atmico Z = 16 y su estructura electrnica es:
tiene dos electrones desapareados y puede formar dos enlaces. As es su
configuracin cuando acta con valencia 2. Pero, al tener los orbitales 3d una energa
similar a la de los 3s y 3p, con un poco ms de energa, desaparea todos sus electrones
adquiriendo la configuracin:
Los seis enlaces que puede formar son iguales, producindose una
homogeneizacin de un orbital s, tres p y dos d, es decir, se forman seis orbitales
hbridos sp
3
d
2
:
La molcula de hexafluoruro de azufre
tiene una estructura espacial octodrica.
También podría gustarte
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosDe EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosAún no hay calificaciones
- AsertividadDocumento19 páginasAsertividadalma glez100% (1)
- Encuesta Sobre La Sensibilización y Prevención de La Drogadicción para Estudiantes BachilleratoDocumento3 páginasEncuesta Sobre La Sensibilización y Prevención de La Drogadicción para Estudiantes BachilleratoNatalia StefaniaAún no hay calificaciones
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- HibridaciónDocumento7 páginasHibridaciónLordvaako103Aún no hay calificaciones
- HibridaciónDocumento4 páginasHibridaciónsabineAún no hay calificaciones
- Hibridación Del CarbonoDocumento6 páginasHibridación Del Carbonojhonjis100% (1)
- Hibridacion Del Nitrogeno Y OxigenoDocumento9 páginasHibridacion Del Nitrogeno Y OxigenoDecoRoom Chimbote50% (2)
- Caracterización química, morfológica y estructural de materialesDe EverandCaracterización química, morfológica y estructural de materialesAún no hay calificaciones
- Hibridacion y EjemplosDocumento11 páginasHibridacion y EjemplosManuel Pérez Nango67% (3)
- Solucionario Del Ejercicios HibridacionDocumento6 páginasSolucionario Del Ejercicios HibridaciondilitzaAún no hay calificaciones
- Orbitales Atómicos HibridaciónDocumento17 páginasOrbitales Atómicos HibridaciónEdinson LaraAún no hay calificaciones
- Hibridación Del CarbonoDocumento4 páginasHibridación Del CarbonoGilberto Diaz MonroyAún no hay calificaciones
- Taller # 1 Hibridaciòn Átomo de CarbonoDocumento6 páginasTaller # 1 Hibridaciòn Átomo de CarbonoLuis CifuentesAún no hay calificaciones
- Psicopatología y DelincuenciaDocumento46 páginasPsicopatología y DelincuenciaMilkha Josefina Puma ChacónAún no hay calificaciones
- Atomo de CarbonoDocumento60 páginasAtomo de Carbonoalberto100% (1)
- La Hibridación Consiste en Una Mezcla de Orbitales Puros en Un Estado Excitado para Formar Orbitales Hibridos Equivalentes Con Orientaciones Determinadas en El EspacioDocumento7 páginasLa Hibridación Consiste en Una Mezcla de Orbitales Puros en Un Estado Excitado para Formar Orbitales Hibridos Equivalentes Con Orientaciones Determinadas en El EspacioYamil ValenciaAún no hay calificaciones
- Hibridación de Carbono QuimicaDocumento12 páginasHibridación de Carbono QuimicaChoco jimenezAún no hay calificaciones
- Geometría MolecularDocumento24 páginasGeometría MolecularEduardo AbadAún no hay calificaciones
- Moléculas PoliatómicasDocumento3 páginasMoléculas PoliatómicasIvan Harrys Herrera LanderosAún no hay calificaciones
- Configuración Electrónica e Hibridación de OrbitalesDocumento29 páginasConfiguración Electrónica e Hibridación de OrbitalesVICTORIA ISABEL AYTA CRUZAún no hay calificaciones
- Hibridación QuímicaDocumento4 páginasHibridación QuímicaLuis Angel De La Rosa JimenezAún no hay calificaciones
- Hibridación Del Átomo d Carbono y Geometría Molecular_105908Documento7 páginasHibridación Del Átomo d Carbono y Geometría Molecular_105908mutazzaoriAún no hay calificaciones
- Hibridación (Química)Documento5 páginasHibridación (Química)jesusorcheAún no hay calificaciones
- Hibridaciones Del CarbonoDocumento5 páginasHibridaciones Del CarbonoAlejandro SanabriaAún no hay calificaciones
- Hibridaciones Del CarbonoDocumento2 páginasHibridaciones Del CarbonoJhoanna ValenciaAún no hay calificaciones
- RUBRICASDocumento11 páginasRUBRICASYessenia Severino SanchezAún no hay calificaciones
- Hibridaciones Del CarbonoDocumento20 páginasHibridaciones Del CarbonomanvelscAún no hay calificaciones
- Hibridación Del CarbonoDocumento5 páginasHibridación Del CarbonorusselAún no hay calificaciones
- Hibridación Del CarbonoDocumento5 páginasHibridación Del CarbonorusselAún no hay calificaciones
- Hibridacion Del CarbonoDocumento12 páginasHibridacion Del Carbonodeseret31Aún no hay calificaciones
- Hibridacion Del Atomo de CarbonoDocumento12 páginasHibridacion Del Atomo de CarbonoLuis DiazAún no hay calificaciones
- Hibridacion Del Atomo de CarbonoDocumento12 páginasHibridacion Del Atomo de CarbonoArlington MartinezAún no hay calificaciones
- HibridaciónDocumento33 páginasHibridaciónLautaro LarcherAún no hay calificaciones
- Investigacion Quimica OrganicaDocumento8 páginasInvestigacion Quimica OrganicaSandy KikeyAún no hay calificaciones
- Hibridación Del CarbonoDocumento5 páginasHibridación Del Carbonoalfredovictorgonzalez1808Aún no hay calificaciones
- TareitaaaaaDocumento9 páginasTareitaaaaagersonAún no hay calificaciones
- HibridacionDocumento43 páginasHibridacionDaniela Galdames PendolaAún no hay calificaciones
- 14 TEV e HibridaciónDocumento48 páginas14 TEV e Hibridaciónjaviera.munoz.oAún no hay calificaciones
- Hibridaciones Del CarbonoDocumento9 páginasHibridaciones Del CarbonoWendy GutierrezAún no hay calificaciones
- Construcción de OrbialesDocumento5 páginasConstrucción de Orbialeshechicera2104Aún no hay calificaciones
- Hibridacion ClaseDocumento5 páginasHibridacion ClaseElizaAún no hay calificaciones
- Clase 1 QO-I PDFDocumento42 páginasClase 1 QO-I PDFOrtiz Torres Fredy100% (1)
- Enlace Covalente IIDocumento32 páginasEnlace Covalente IIMaycol Blas VegaAún no hay calificaciones
- 61-Ejercicios de Enlace Quimico Con SolucionDocumento10 páginas61-Ejercicios de Enlace Quimico Con SolucionYanina Soledad PerezAún no hay calificaciones
- Hibridacion CO2Documento9 páginasHibridacion CO2Carmen María López Martínez100% (1)
- Hibridación y Geometrhibridacion y Geometria Molecularía Molecular & Energia ReticularDocumento6 páginasHibridación y Geometrhibridacion y Geometria Molecularía Molecular & Energia ReticularWilliam ArianaAún no hay calificaciones
- Quimica Fase 3Documento6 páginasQuimica Fase 3DIANA CAROLINA SANCHEZ ROJASAún no hay calificaciones
- Geometria MolecularDocumento37 páginasGeometria MolecularJavieraNaomiMercadoEsquivelAún no hay calificaciones
- Practica de Lab Modelos Moleculares e HibridacionDocumento6 páginasPractica de Lab Modelos Moleculares e HibridacionHernan Mauricio Rivera Escobar100% (2)
- Tipos de HibridacionDocumento4 páginasTipos de HibridacionYair RamírezAún no hay calificaciones
- Q.I - Hibridación de OrbitalesDocumento9 páginasQ.I - Hibridación de OrbitalesaddymoshAún no hay calificaciones
- Hibridaciones Del CarbonoDocumento9 páginasHibridaciones Del CarbonoSanti ChamorroAún no hay calificaciones
- 2009 02 Hibridacion, Enlace C-C y Grupos Funcionales1Documento20 páginas2009 02 Hibridacion, Enlace C-C y Grupos Funcionales1josseline adriana rivera revolloAún no hay calificaciones
- Hibridacion Carbono d2Documento21 páginasHibridacion Carbono d2LunaAún no hay calificaciones
- Hibridación QUIMICADocumento4 páginasHibridación QUIMICALuis Enrique Sanchez GodoyAún no hay calificaciones
- 01.06teoría Hibridación Del Átomo de CarbonoDocumento12 páginas01.06teoría Hibridación Del Átomo de CarbonoNicole de la RosaAún no hay calificaciones
- Hibridación SPDocumento7 páginasHibridación SPSulmy Olivera zeladaAún no hay calificaciones
- Lenguaje CorporalDocumento113 páginasLenguaje CorporalLuis Reynaga JimenezAún no hay calificaciones
- Actividad Física y Deportes - UABDocumento14 páginasActividad Física y Deportes - UABRoberto Carlos León RamirezAún no hay calificaciones
- Ds 40Documento18 páginasDs 40Marco MartinezAún no hay calificaciones
- Practica para Procesos Farmaceuticos, Esterilizacion, 2020-21Documento2 páginasPractica para Procesos Farmaceuticos, Esterilizacion, 2020-21RMAún no hay calificaciones
- Perfil-Molino de Martillos para Granos para PresentarDocumento26 páginasPerfil-Molino de Martillos para Granos para PresentarCristian AquinoAún no hay calificaciones
- PSP InformeDocumento3 páginasPSP InformeKarly GómezAún no hay calificaciones
- Informe de La Harina de Banano VerdeDocumento25 páginasInforme de La Harina de Banano VerdeBRYAN100% (2)
- Qué Es El Acoso EscolarDocumento4 páginasQué Es El Acoso EscolarCARLOS ALEXIS TORRES PEDRAZAAún no hay calificaciones
- Curiosidades de Los ReptilesDocumento2 páginasCuriosidades de Los ReptilesSandra PinedaAún no hay calificaciones
- Feliz NavidadDocumento15 páginasFeliz NavidadDanna MendozaAún no hay calificaciones
- Salud MentalDocumento13 páginasSalud MentalEzequiel CuevasAún no hay calificaciones
- Hoja de Impresión de Pavlova de Mango, Frambuesas y Salsa de Fruta de La PasiónDocumento2 páginasHoja de Impresión de Pavlova de Mango, Frambuesas y Salsa de Fruta de La PasiónPatricia Moreno HernandezAún no hay calificaciones
- Caso Clínico Real para El Cálculo de Un Inyección Con Ecuaciones Diferenciales OrdinariasDocumento17 páginasCaso Clínico Real para El Cálculo de Un Inyección Con Ecuaciones Diferenciales OrdinariasJinhichi Molero RodriguezAún no hay calificaciones
- Tesis CompletaDocumento140 páginasTesis Completajon TorresAún no hay calificaciones
- TeSys GV2 - GV2ME10Documento3 páginasTeSys GV2 - GV2ME10Eduardo GallegosAún no hay calificaciones
- Sesión #14 - S. Reproductor FemeninoDocumento33 páginasSesión #14 - S. Reproductor FemeninoYuleni SantaCruz UgazAún no hay calificaciones
- Sso Expo PDFDocumento25 páginasSso Expo PDFMarcelo Marcial Valerio QuispeAún no hay calificaciones
- Actividad 2Documento6 páginasActividad 2YEICY NORELLY DAZA ESTRADAAún no hay calificaciones
- La Parte Del Cerebro Que Se Enciende Cuando Escuchamos Música-1Documento13 páginasLa Parte Del Cerebro Que Se Enciende Cuando Escuchamos Música-1Diana PortilloAún no hay calificaciones
- Actividad Final PE Juan Miguel BastidasDocumento2 páginasActividad Final PE Juan Miguel BastidasJuan Miguel BastidasAún no hay calificaciones
- DMT Clasificacion MorrisonDocumento21 páginasDMT Clasificacion Morrisonjeanne marieAún no hay calificaciones
- Condiciones Generales Adeslas Plena VitalDocumento23 páginasCondiciones Generales Adeslas Plena VitalpepitoAún no hay calificaciones
- Reabsorción DentariaDocumento34 páginasReabsorción DentariaCicse RondanelliAún no hay calificaciones
- Relacion de Profesionales Destacados de Establecimientos de Salud A Otras Unidades EjecutorasDocumento18 páginasRelacion de Profesionales Destacados de Establecimientos de Salud A Otras Unidades Ejecutorasrosalyn alejandraAún no hay calificaciones
- Glosario N°1 Riesgo EléctricoDocumento10 páginasGlosario N°1 Riesgo Eléctricojoselyn cerceñoAún no hay calificaciones
- Dormancia en PlantasDocumento14 páginasDormancia en PlantasRip Van Winkle ArrowsAún no hay calificaciones
- HIELODocumento6 páginasHIELOAlexander Guerrero PichardoAún no hay calificaciones