Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Modelos Atomicos (Gloria Peñuela)
Cargado por
Gloria LizarazoDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Modelos Atomicos (Gloria Peñuela)
Cargado por
Gloria LizarazoCopyright:
Formatos disponibles
GLORIA PEÑUELA LIZARAZO
COD. 2019216062
QUIMICA GENERAL G. N° 1
MODELO FUNDAMENTOS GRAFICA
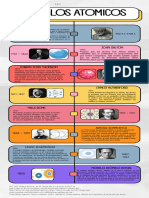
En 1808, John Dalton publicó su teoría atómica, que retomaba las antiguas ideas de Leucipo y Demócrito.
Según la teoría de Dalton:
1) Los elementos están formados por partículas discretas, diminutas e indivisibles, llamadas átomos, que
no se alteran en los cambios químicos.
DALTON
2) Los átomos de un mismo elemento son todos iguales entre sí en masa, tamaño y en el resto de las
(1803) propiedades físicas o químicas. Por el contrario, los átomos de elementos diferentes tienen distinta masa y
propiedades.
3) Los compuestos se forman por la unión de átomos de los correspondientes elementos según una
relación numérica sencilla y constante. Por ejemplo, el agua está formada por 2 átomos del elemento
hidrógeno y 1 átomo del elemento oxígeno.
Propuesto por el científico británico J.J. Thomson en 1897, se basa en la idea de que un átomo está
compuesto por electrones distribuidos en una nube negativa, similar a pasas en un pudín, incrustados en
una masa positiva uniforme. Thomson postuló que los electrones negativos se mantenían en equilibrio con
THOMSON
la carga positiva, lo que resultaba en un átomo eléctricamente neutro. Este modelo sugirió por primera vez
(1904) que los átomos tenían una estructura interna, marcando un avance en la comprensión de la naturaleza
subatómica de la materia. Sin embargo, este modelo fue reemplazado posteriormente por el modelo de
Rutherford, que describía un núcleo central con electrones orbitando a su alrededor.
Propuesto por Ernest Rutherford en 1911, sugiere que un átomo está compuesto principalmente por
espacio vacío y un núcleo central extremadamente pequeño y denso que contiene la mayor parte de la
RUTHERFORD
masa del átomo. Los electrones orbitan alrededor del núcleo en órbitas definidas. Este modelo revolucionó
(1911) nuestra comprensión de la estructura atómica al reemplazar la idea anterior de un átomo "plum pudding"
con una estructura nuclear definida.
Propuesto por Niels Bohr en 1913, postula que los electrones en un átomo ocupan órbitas cuantizadas
alrededor del núcleo. Estas órbitas están relacionadas con niveles de energía discretos. Los electrones
BOHR
pueden saltar entre estas órbitas emitiendo o absorbiendo energía en forma de fotones. Este modelo
(1913) explicó de manera efectiva las líneas espectrales del hidrógeno y sentó las bases para la comprensión de la
estructura atómica y la cuantización de la energía en la mecánica cuántica.
Se basa en la mecánica cuántica y describe el comportamiento de los electrones en un átomo. En lugar de
órbitas fijas, como en el modelo de Bohr, Schrödinger propuso que los electrones se encuentran en
SCHRODINGER regiones llamadas orbitales, donde la probabilidad de encontrar un electrón es mayor. Estos orbitales se
(1926) caracterizan por números cuánticos que definen sus propiedades. El modelo de Schrödinger es
fundamental para comprender la estructura y comportamiento de los átomos de manera más precisa y
detallada que los modelos anteriores.
Este término no se asocia comúnmente con un modelo específico, ya que la mecánica cuántica,
ATOMO CUANTICO desarrollada por varios científicos, como Schrödinger, Heisenberg, Max Born y Louis de Broglie,
(1930) proporciona el marco teórico para comprender la estructura atómica en términos de niveles de energía
cuantizados y funciones de onda.
LA NUBE ELECTRONICA Propuesto por Linus Pauling, este modelo visualiza los electrones como una nube de carga negativa
(1930) alrededor del núcleo en lugar de órbitas definidas.
También podría gustarte
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Modelos AtómicosDocumento14 páginasModelos Atómicossseb@ss95% (44)
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Qui MicaDocumento235 páginasQui MicaJupiter GonzalezAún no hay calificaciones
- Fisicoquímica II: Materia, electricidad y magnetismo. Fuerzas y camposDe EverandFisicoquímica II: Materia, electricidad y magnetismo. Fuerzas y camposAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 4.5 de 5 estrellas4.5/5 (2)
- Ensayo Modelos AtómicosDocumento4 páginasEnsayo Modelos AtómicosJiménez Buelvas Andrés67% (3)
- Modelo Atomico1Documento2 páginasModelo Atomico1ArturoYapuchura100% (1)
- Historia Del ÁtomoDocumento3 páginasHistoria Del ÁtomoLourdes Garza100% (1)
- El ÁtomoDocumento7 páginasEl Átomocaflo100% (2)
- Actividades Repaso Unidad 2Documento4 páginasActividades Repaso Unidad 2Carolina100% (1)
- Cruz Garritz Amp Chamizo Estructura Atomica Un Enfoque Quimico PDFDocumento824 páginasCruz Garritz Amp Chamizo Estructura Atomica Un Enfoque Quimico PDFLucia Díaz100% (1)
- Modelo AtomicoDocumento1 páginaModelo AtomicoGloria LizarazoAún no hay calificaciones
- Taller 2 Unidad IIDocumento4 páginasTaller 2 Unidad IIGloria LizarazoAún no hay calificaciones
- Taipe Chachayma Edith Sesión 5Documento14 páginasTaipe Chachayma Edith Sesión 5Edith Rosmery Taipe ChachaymaAún no hay calificaciones
- Hernández Cruz Frida Pamela - Modelos Átomicos - 551Documento3 páginasHernández Cruz Frida Pamela - Modelos Átomicos - 551ho liAún no hay calificaciones
- Actividad 03 U1 Cuadro Comparativo - Gustavo Rubio RafaelDocumento3 páginasActividad 03 U1 Cuadro Comparativo - Gustavo Rubio RafaelGustavo RubioAún no hay calificaciones
- Modelo AtómicoDocumento12 páginasModelo AtómicoVanesa PaniaguaAún no hay calificaciones
- RazonesDocumento2 páginasRazonesCecil MorenoAún no hay calificaciones
- Linea de Tiempo Modelos AtomicosDocumento1 páginaLinea de Tiempo Modelos AtomicosMARCO ANTONIO RAMIREZ REYESAún no hay calificaciones
- Teoría AtómicaDocumento16 páginasTeoría AtómicaManuel SanchezAún no hay calificaciones
- Los Modelos Atomicos y Su HistoriaDocumento5 páginasLos Modelos Atomicos y Su HistoriaKennia Rivera GuapulemaAún no hay calificaciones
- Estructura Atómica 2Documento29 páginasEstructura Atómica 2u20231212683Aún no hay calificaciones
- Clase 10 Modelos AtomicosDocumento19 páginasClase 10 Modelos AtomicosSandy Torres carhuallanquiAún no hay calificaciones
- Jose Ceballos Trabajo de AtomosDocumento17 páginasJose Ceballos Trabajo de AtomosMercedes LongaAún no hay calificaciones
- Linea Del Tiempo PDFDocumento1 páginaLinea Del Tiempo PDFFranklin Enmanuel Cordero BobadillaAún no hay calificaciones
- SalinasCarmona Yoselin M14S1 ElatomoDocumento3 páginasSalinasCarmona Yoselin M14S1 ElatomoYoselin Salinas CarmonaAún no hay calificaciones
- InfografíaDocumento1 páginaInfografíaLorena CastroAún no hay calificaciones
- Teoría Atómica de La MateriaDocumento5 páginasTeoría Atómica de La Materiaemiliaprisco04Aún no hay calificaciones
- Modelo Atomico de RutherfordDocumento7 páginasModelo Atomico de RutherfordAlejandro122009Aún no hay calificaciones
- Modelos AtomicosDocumento10 páginasModelos AtomicosErnesto RamosAún no hay calificaciones
- Exposicion Los Modelos AtomicosDocumento9 páginasExposicion Los Modelos Atomicoslarasaranatalia51Aún no hay calificaciones
- Explicación de Los Modelos Atómicos 3Documento8 páginasExplicación de Los Modelos Atómicos 3Angel Gael BlancoAún no hay calificaciones
- Modelos Atomicos Clase GuiaDocumento18 páginasModelos Atomicos Clase GuiaPedro OlivarezAún no hay calificaciones
- Teorias de Modelos Atómicos y AntecedentesDocumento13 páginasTeorias de Modelos Atómicos y Antecedentesquitoquito2012Aún no hay calificaciones
- Atomos 5Documento5 páginasAtomos 5Yesmin GomezAún no hay calificaciones
- Modelos AtomicosDocumento17 páginasModelos AtomicosRubenAún no hay calificaciones
- Modelos AtomicosDocumento10 páginasModelos AtomicosSebastian ValderramaAún no hay calificaciones
- Evolucion Del AtomoDocumento8 páginasEvolucion Del AtomoAlex BolañoAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosSantiago San MiguelAún no hay calificaciones
- Teorias AtomicasDocumento2 páginasTeorias AtomicasEl RISASAún no hay calificaciones
- Historia de Los Modelos Atomicos Copia 2Documento22 páginasHistoria de Los Modelos Atomicos Copia 2griselda cruz perezAún no hay calificaciones
- T-4 Modelos AtomicosDocumento8 páginasT-4 Modelos AtomicosMax Perez LealAún no hay calificaciones
- Historia Del Átomo.Documento2 páginasHistoria Del Átomo.SantyAún no hay calificaciones
- Infografía Línea Del Tiempo Timeline Historia Moderno Creativo MulticolorDocumento3 páginasInfografía Línea Del Tiempo Timeline Historia Moderno Creativo MulticolorRosannksAún no hay calificaciones
- Linea Del Tiempo Ma - QuimicaDocumento2 páginasLinea Del Tiempo Ma - QuimicaFranco Rincón GiselleAún no hay calificaciones
- Boson FermionDocumento5 páginasBoson FermionInformatica Municipalidad de ZacapaAún no hay calificaciones
- Historia Modelo AtomicoDocumento3 páginasHistoria Modelo Atomicopocholo9415Aún no hay calificaciones
- Modelo Atómico de DaltonDocumento3 páginasModelo Atómico de Daltonpokemon gonAún no hay calificaciones
- Modelos AtómicosDocumento8 páginasModelos AtómicosLuciano Pizaña ZamoraAún no hay calificaciones
- Quimica General e Inorganica Clase 3Documento56 páginasQuimica General e Inorganica Clase 3Edwin Pomatanta PlasenciaAún no hay calificaciones
- El Modelo Atómico de Dalton1 Surgido en El Contexto de La QuímicaDocumento6 páginasEl Modelo Atómico de Dalton1 Surgido en El Contexto de La QuímicaMariaElizabeth14Aún no hay calificaciones
- Modelos AtomicosDocumento15 páginasModelos AtomicosLópez García Axel UrielAún no hay calificaciones
- Resumen Modelos AtómicosDocumento6 páginasResumen Modelos Atómicosyour.worst.nightmare79417873Aún no hay calificaciones
- Tema 3. Teoría Atómica 2x1Documento25 páginasTema 3. Teoría Atómica 2x1tatinconcoca23Aún no hay calificaciones
- Estructura AtomicaDocumento18 páginasEstructura AtomicaOscar S. HernandezAún no hay calificaciones
- Modelo Atómico de Niels BohrDocumento8 páginasModelo Atómico de Niels BohrAmbar ReyesAún no hay calificaciones
- Modelos AtómicosDocumento15 páginasModelos AtómicosCarlosAún no hay calificaciones
- Taller 1, UNIDAD I, Generalidades y Nociones Fundamentales, 2021-2Documento3 páginasTaller 1, UNIDAD I, Generalidades y Nociones Fundamentales, 2021-2Gloria LizarazoAún no hay calificaciones
- Ejemplo ProyeccionesDocumento5 páginasEjemplo ProyeccionesGloria LizarazoAún no hay calificaciones
- Enlaces QuimicosDocumento11 páginasEnlaces QuimicosGloria LizarazoAún no hay calificaciones
- Laboratorio 5 QuimicaDocumento18 páginasLaboratorio 5 QuimicaGloria LizarazoAún no hay calificaciones
- Laboratorio 2 QuimicaDocumento15 páginasLaboratorio 2 QuimicaGloria LizarazoAún no hay calificaciones
- Laboratorio 5 QuimicaDocumento18 páginasLaboratorio 5 QuimicaGloria LizarazoAún no hay calificaciones
- GUÍA 3. Determinación de Masa, Volumen y Tratamientos de DatosDocumento6 páginasGUÍA 3. Determinación de Masa, Volumen y Tratamientos de DatosGloria LizarazoAún no hay calificaciones
- DocxDocumento10 páginasDocxGloria LizarazoAún no hay calificaciones
- Laboratorio 2Documento15 páginasLaboratorio 2Gloria LizarazoAún no hay calificaciones
- GUÍA 4. Determinación de Densidad de Sólidos y LiquidosDocumento4 páginasGUÍA 4. Determinación de Densidad de Sólidos y LiquidosGloria LizarazoAún no hay calificaciones
- FT 725550 Bota Jumbo AntiestaticaDocumento1 páginaFT 725550 Bota Jumbo AntiestaticaGloria LizarazoAún no hay calificaciones
- FT 209580 Bota Mundial GrabadaDocumento1 páginaFT 209580 Bota Mundial GrabadaGloria LizarazoAún no hay calificaciones
- Laboratorio Iii Segunda Ley de Newton G - 06Documento13 páginasLaboratorio Iii Segunda Ley de Newton G - 06Gloria LizarazoAún no hay calificaciones
- Ejercicios Enfoque de Probabilidad 1Documento3 páginasEjercicios Enfoque de Probabilidad 1Gloria LizarazoAún no hay calificaciones
- Preguntas de Dinamica G.6 2020IIDocumento3 páginasPreguntas de Dinamica G.6 2020IIGloria LizarazoAún no hay calificaciones
- 2 Taller Cal Integ 2020-2Documento1 página2 Taller Cal Integ 2020-2Gloria LizarazoAún no hay calificaciones
- Taller 1 Resuelto Brian CastañoDocumento3 páginasTaller 1 Resuelto Brian CastañoGloria LizarazoAún no hay calificaciones
- La Teoría Atómica Unidad 2Documento3 páginasLa Teoría Atómica Unidad 2Luis Manuel Garcia de la CruzAún no hay calificaciones
- PLANIFICACION Naturaleza 2014 8VODocumento21 páginasPLANIFICACION Naturaleza 2014 8VOparaisoAún no hay calificaciones
- Quimica I Modelos AtomicosDocumento14 páginasQuimica I Modelos AtomicosPriscila Cantoran CoronadoAún no hay calificaciones
- Modelo AtomicoDocumento6 páginasModelo AtomicoKatia NinaAún no hay calificaciones
- Diagrama de MoellerDocumento4 páginasDiagrama de Moellernoha yahya abdellaouiAún no hay calificaciones
- (Química) .Doc Contenido CurricularDocumento13 páginas(Química) .Doc Contenido CurricularMara Campos FebresAún no hay calificaciones
- Historia Del Atomo para Primer Grado SecundariaDocumento4 páginasHistoria Del Atomo para Primer Grado SecundariaJeremy jair Santamaria culquiAún no hay calificaciones
- Modelos AtomicosDocumento14 páginasModelos Atomicosjoseluis251168Aún no hay calificaciones
- U5 La Teoria AtomicaDocumento13 páginasU5 La Teoria AtomicaKeila LopezAún no hay calificaciones
- Evolución de La Teoria Atómica: 430 A.C. - DemócritoDocumento1 páginaEvolución de La Teoria Atómica: 430 A.C. - DemócritoSara ZapataAún no hay calificaciones
- Historia Del AtomoDocumento9 páginasHistoria Del AtomodAnIeLAún no hay calificaciones
- Hoja de Trabajo Teoria AtomicaDocumento3 páginasHoja de Trabajo Teoria AtomicaGuillermo SicanAún no hay calificaciones
- Unidad 2 2022Documento127 páginasUnidad 2 2022AleAún no hay calificaciones
- Cantidad de Sustancias PurasDocumento39 páginasCantidad de Sustancias PurasJulio FriasAún no hay calificaciones
- Infografia de Teorias AtomicasDocumento1 páginaInfografia de Teorias AtomicasJavier Isaac Ordoñez MartinezAún no hay calificaciones
- Unidad 02 Estructura AtómicaDocumento17 páginasUnidad 02 Estructura AtómicajoelquimicoAún no hay calificaciones
- DaltonDocumento6 páginasDaltonGaby BurbanoAún no hay calificaciones
- Unidad 02 Estructura AtómicaDocumento17 páginasUnidad 02 Estructura AtómicaJoel Hurtado MarchenaAún no hay calificaciones
- Mapa Conceptual de Todos Los Temas de QuimicaDocumento4 páginasMapa Conceptual de Todos Los Temas de QuimicaChino LoqiyoAún no hay calificaciones
- Trabajo Modelo AtomicoDocumento16 páginasTrabajo Modelo Atomicovicner escalonaAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosLenin TorresAún no hay calificaciones
- ASINCRONA Actividad-04Documento14 páginasASINCRONA Actividad-04Papirriqui RMAún no hay calificaciones
- Thoery On The Best Test 94Documento6 páginasThoery On The Best Test 94Just WonderAún no hay calificaciones
- Historia Del ÁtomoDocumento5 páginasHistoria Del ÁtomoDanna Irais Ramírez PérezAún no hay calificaciones
- T3 Romo FransDocumento7 páginasT3 Romo FransFRANS ROMOAún no hay calificaciones
- Ciencia y AmbienteDocumento68 páginasCiencia y AmbienteAnonymous nLtkVIEAún no hay calificaciones
- Teoría AtómicaDocumento16 páginasTeoría AtómicaManuel SanchezAún no hay calificaciones