Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Segunda Ley de La Termodinámica (Ciclo de Carnot)
Cargado por
ALEXIS GAEL REBOLLEDO VALENCIATítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Segunda Ley de La Termodinámica (Ciclo de Carnot)
Cargado por
ALEXIS GAEL REBOLLEDO VALENCIACopyright:
Formatos disponibles
SEGUNDA LEY DE LA TERMODINÁMICA (Ciclo de Carnot)
En 1824, el ingeniero francés Sadi Carnot
investigó los principios físicos para la
transformación de energía calorífica en
energía mecánica. Su estudio derivó en la
construcción de un proceso cíclico, conocido
como el ciclo de Carnot.
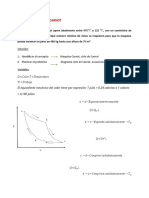
Como se ve en el diagrama P vs V, el ciclo de
Carnot está constituido por cuatro etapas
consecutivas que proceden de manera
reversible. Las primeras dos etapas son
procesos en el que el sistema se expande, para
posteriormente ser comprimido en dos etapas
subsecuentes y regresar al estado inicial.
De manera intercalada el ciclo de Carnot contiene etapas isotérmicas y adiabáticas. Ya
que, si el proceso sólo estuviera constituido por etapas isotérmicas o adiabáticas, este no
sería un ciclo, ya que las isotermas o las líneas adiabáticas no intersecan entre sí.
Una máquina térmica es un dispositivo que opera cíclicamente entre dos fuentes térmicas
de diferente valor, utilizando procesos termodinámicos consecutivos (isotérmicos y
adiabáticos), a través de los cuales la máquina absorbe calor de una fuente térmica, para
posteriormente transformar esta energía en trabajo mecánico hacia los alrededores.
A continuación, se describe cada una de las etapas involucradas en el Ciclo de Carnot:
SEGMENTO A→B
La primera etapa del ciclo de Carnot consiste en una etapa de expansión de VA a VB a
temperatura constante (T1). Para ello, el sistema es sumergido en una fuente térmica
externa. Dado que es una etapa de expansión, el sistema pierde energía al realizar el
trabajo sobre los alrededores, por tanto, WAB es negativo. La ec. para determinar WAB es:
𝑽
𝑾𝑨𝑩 = −𝒏𝑹𝑻𝟏 ∙ 𝑳𝒏 ( 𝑩 ) ….. ec. (1)
𝑽𝑨
Por otro lado, al ser una etapa isotérmica, para un gas ideal, UAB y HAB son cero debido
a que no hay un gradiente de temperatura. Por tanto, la primera ley de la termodinámica
indica que el calor en esta etapa debe de ser el menos trabajo ejecutado, por tanto, el
sistema gana energía en forma de calor (QAB = +) para compensar lo perdido en la
expansión y así mantener la temperatura constante.
J. Arturo Mendoza Nieto Facultad de Química, UNAM 1/7
Resumiendo:
Etapa Proceso W Q U
A→B Expansión isotérmica WAB = - QAB = + UAB = 0 → QAB =- WAB
En esta etapa el sistema absorbe el calor (QAB) que se desea transformar en trabajo
mecánico (WAB).
SEGMENTO B→C
En la segunda etapa del ciclo de Carnot, el sistema es removido de la fuente térmica y
colocada una pared adiabática en su lugar. Así, el ciclo continúa expandiéndose de VB
a VC a través de un proceso adiabático, en donde no hay transferencia de calor entre
sistema y alrededores debido a la presencia de la pared adiabática, por tanto, QBC = 0. En
el diagrama P vs V, se observa que esta etapa permite unir a las dos isotermas en las que
trabaja la máquina térmica.
Para esta etapa, la primera ley de la Termodinámica muestra que toda la energía interna
del sistema es debida únicamente al trabajo ejecutado hacia los alrededores. Dado que es
una expansión, la temperatura del sistema disminuye de T1 a T2, por lo que el trabajo y U
deben de ser negativos. De acuerdo con lo explicado en el tema de proceso adiabático, la
ecuación para calcular ambas propiedades es:
∆𝑼𝑩𝑪 = 𝑾𝑩𝑪 = 𝒏 ∙ ̅̅̅̅
𝑪𝑽 ∙ (𝑻𝟐 − 𝑻𝟏 ) ….. ec. (2)
̅̅̅̅
∆𝑯𝑩𝑪 = 𝒏 ∙ 𝑪𝑷 ∙ (𝑻𝟐 − 𝑻𝟏 ) ….. ec. (3)
Resumiendo:
Etapa Proceso W Q U
B→C Expansión adiabática WBC = - QBC = 0 UBC = WBC
SEGMENTO C→D
J. Arturo Mendoza Nieto Facultad de Química, UNAM 2/7
La tercera etapa del ciclo contempla una etapa de compresión de VC a VD a temperatura
constante (T2). Para ello, la pared adiabática es removida y el sistema es sumergido en
una fuente térmica de menor valor que la utilizada en el primer segmento del ciclo. Dado
que es una etapa de compresión, el sistema gana energía al realizarse el trabajo mecánico
de alrededores al sistema, por tanto, WCD es positivo. La ecuación para determinar WCD es:
𝑽
𝑾𝑪𝑫 = −𝒏𝑹𝑻𝟐 ∙ 𝑳𝒏 ( 𝑫 ) ….. ec. (4)
𝑽𝑪
Por otro lado, al ser una etapa isotérmica, para un gas ideal, UCD y HCD son cero debido
a que no hay un gradiente de temperatura. Por tanto, la primera ley de la termodinámica
indica que el calor en esta etapa debe de ser el menos trabajo ejecutado, por tanto, el
sistema pierde energía en forma de calor (QCD = -) para compensar lo ganado en la
compresión y así mantener la temperatura constante.
Resumiendo:
Etapa Proceso W Q U
C→D Compresión isotérmica WCD = + QCD = - UCD = 0 → QCD =- WCD
En esta etapa, el sistema libera el calor (QCD) que la máquina no pudo transformar en trabajo
mecánico. Se desea que el calor disipado hacia los alrededores sea el menor posible, ya
que este no es aprovechado.
SEGMENTO D→A
En el último segmento del ciclo de Carnot, el sistema se comprime de VD a VA durante un
proceso adiabático al colocarse de nueva cuenta una pared adiabática. Al igual que en el
segundo segmento del ciclo, en esta etapa tampoco hay transferencia de calor entre
sistema y alrededores, por tanto, QDA = 0. En el diagrama P vs V, se observa que esta etapa
permite regresar al estado inicial, con el objetivo de comenzar un nuevo ciclo.
También en esta etapa, la primera ley de la Termodinámica muestra la energía interna del
sistema es igual al trabajo ejecutado desde los alrededores. Dado que es una compresión,
la temperatura del sistema aumenta de T2 a T1, por lo que el trabajo y U deben de ser
positivos. La ecuación para calcular la energía interna y el trabajo es:
∆𝑼𝑫𝑨 = 𝑾𝑫𝑨 = 𝒏 ∙ ̅̅̅̅
𝑪𝑽 ∙ (𝑻𝟏 − 𝑻𝟐 ) ….. ec. (5)
∆𝑯𝑫𝑨 = 𝒏 ∙ ̅̅̅̅
𝑪𝑷 ∙ (𝑻𝟏 − 𝑻𝟐 ) ….. ec. (6)
J. Arturo Mendoza Nieto Facultad de Química, UNAM 3/7
Resumiendo:
Etapa Proceso W Q U
D→A Compresión adiabática WDA = + QDA = 0 UDA = WDA
CICLO
Para el ciclo, las funciones de estado, UCiclo y HCiclo son cero debido a que el inicio y
final del ciclo son el mismo estado A. Por tanto, la primera ley de la termodinámica para el
ciclo indica que el calor y el trabajo deben de ser igual en magnitud, pero de signo contrario.
Partiendo del hecho que una máquina térmica es aquella que absorbe calor para
transformarlo en trabajo mecánico, entonces para el ciclo, el calor debe de ser positivo
(QCiclo = +) y el trabajo negativo (WCiclo = -), respectivamente.
El calor y trabajo del ciclo pueden ser calculados como la suma de las cuatro etapas del
ciclo, de tal forma que:
𝑸𝑪𝒊𝒄𝒍𝒐 = ∑ 𝑸𝒊 = 𝑸𝑨𝑩 + 𝑸𝑪𝑫 ….. ec. (7)
𝑾𝑪𝒊𝒄𝒍𝒐 = ∑ 𝑾𝒊 = 𝑾𝑨𝑩 + 𝑾𝑩𝑪 + 𝑾𝑪𝑫 + 𝑾𝑫𝑨 ….. ec. (8)
Resumiendo todo lo anterior:
Etapa Proceso W Q U
A→B Expansión isotérmica WAB = - QAB = + UAB = 0 → QAB =- WAB
B→C Expansión adiabática WBC = - QBC = 0 UBC = WBC
C→D Compresión isotérmica WCD = + QCD = - UCD = 0 → QCD =- WCD
D→A Compresión adiabática WDA = + QDA = 0 UDA = WDA
Ciclo WCiclo = - QCiclo = + UCiclo = 0 → QCiclo =- WCiclo
NOTAS:
1. Dado que a la máquina térmica se le suministra calor, el calor absorbido (Q AB) siempre
será mayor en magnitud en comparación con el calor cedido durante la tercera etapa del
ciclo (QCD), de tal forma que: |QAB| > |QCD|.
2. Considerado que el objetivo de una máquina térmica es que realice un trabajo, los
segmentos que aportarán para que esto suceda serán las etapas de expansión, ya que
tienen un signo negativo que simboliza el trabajo realizado hacia los alrededores, por
tanto es deseable que en magnitud: |WAB + WBC| > | WCD + WDA|.
3. Una forma de relacionar a los cuatro estados del ciclo de Carnot es a través de los dos
procesos adiabáticos. Recordando lo visto en la clase de proceso adiabático, se tiene la
siguiente expresión para relacionar al estado inicial y final de un proceso adiabático:
𝑇1 𝑉1 𝛾−1 = 𝑇2 𝑉2 𝛾−1
Adaptando la expresión anterior a los segmentos adiabáticos (BC y DA), se tiene:
Segmento BC: 𝑻𝟏 𝑽𝑩 𝜸−𝟏 = 𝑻𝟐 𝑽𝑪 𝜸−𝟏 ….. ec. (9)
Segmento DA: 𝑻𝟐 𝑽𝑫 𝜸−𝟏 = 𝑻𝟏 𝑽𝑨 𝜸−𝟏 ….. ec. (10)
J. Arturo Mendoza Nieto Facultad de Química, UNAM 4/7
Dividiendo ecuación 9 entre la ecuación 10, se tiene:
𝑇1 𝑉𝐵 𝛾−1 𝑇2 𝑉𝐶 𝛾−1
= , simplificando:
𝑇1 𝑉𝐴 𝛾−1 𝑇2 𝑉𝐷 𝛾−1
𝑉𝐵 𝛾−1 𝑉𝐶 𝛾−1
(𝑉 ) =( ) , simplificando:
𝐴 𝑉 𝐷
𝑽𝑩 𝑽𝑪
= ….. ec. (11)
𝑽𝑨 𝑽𝑫
La ecuación 11 relaciona a los cuatro volúmenes que el sistema recorre para un ciclo.
4. Otra forma de determinar el trabajo total realizado por la máquina es sustituyendo las
ecuaciones 1, 2, 4 y 5 en la ecuación 8:
𝑽𝑩 𝑽𝑫
𝑾𝑪𝒊𝒄𝒍𝒐 = −𝒏𝑹𝑻𝟏 ∙ 𝑳𝒏 ( ̅̅̅̅
) + 𝒏𝑪 𝑽 (𝑻𝟐 − 𝑻𝟏 ) − 𝒏𝑹𝑻𝟐 ∙ 𝑳𝒏 (
̅̅̅̅
) + 𝒏𝑪 𝑽 (𝑻𝟏 − 𝑻𝟐 )
𝑽𝑨 𝑽𝑪
El segundo y cuarto término son opuestos y por tanto se anulan. Además, se cambió el
signo negativo del tercer término por uno positivo, a consecuencia de haber invertido la
posición del numerador y denominador, de tal forma que:
𝑉𝐵 𝑉𝐶
𝑊𝐶𝑖𝑐𝑙𝑜 = −𝑛𝑅𝑇1 ∙ 𝐿𝑛 ( ) + 𝑛𝑅𝑇2 ∙ 𝐿𝑛 ( )
𝑉𝐴 𝑉𝐷
Sustituyendo el cociente VC/VD de la ecuación 11, se tiene que:
𝑉 𝑉
𝑊𝐶𝑖𝑐𝑙𝑜 = −𝑛𝑅𝑇1 ∙ 𝐿𝑛 ( 𝐵) + 𝑛𝑅𝑇2 ∙ 𝐿𝑛 ( 𝐵) , factorizando:
𝑉𝐴 𝑉𝐴
𝑽
𝑾𝑪𝒊𝒄𝒍𝒐 = −𝒏𝑹(𝑻𝟏 − 𝑻𝟐 ) ∙ 𝑳𝒏 ( 𝑩 ) ….. ec. (12)
𝑽𝑨
La ecuación 12 permite determinar el trabajo del ciclo únicamente a través de conocer los
volúmenes de la etapa de expansión isotérmica.
5. Una manera de determinar si una máquina térmica es funcional o no, es a través de
determinar su eficiencia (η). La primera expresión de eficiencia se determina a través de
conocer cuál es la relación entre el calor absorbido por la máquina (Q AB) y el trabajo
mecánico ejecutado por la máquina al término del ciclo (WCiclo):
𝑉𝐵
|𝑾𝑪𝒊𝒄𝒍𝒐 | 𝑛𝑅(𝑇1 − 𝑇2 ) ∙ 𝐿𝑛 ( 𝑉𝐴 )
𝜼= =
𝑸𝑨𝑩 𝑉
𝑛𝑅𝑇1 ∙ 𝐿𝑛 ( 𝐵 )
𝑉𝐴
Dado que la eficiencia es una cantidad positiva, se toma el valor absoluto del trabajo del
ciclo, ya que este es negativo. Por otro lado, en la descripción del segmento A→B, se
estableció que QAB = -WAB. Simplificando la expresión anterior, se tiene:
J. Arturo Mendoza Nieto Facultad de Química, UNAM 5/7
𝑻𝟏 −𝑻𝟐 𝑻𝟐
𝜼= =𝟏− ….. ec. (13)
𝑻𝟏 𝑻𝟏
La expresión 13, muestra que la eficiencia es una cantidad adimensional que oscila entre
cero y uno. Donde uno, corresponde a la máxima eficiencia de la máquina para el caso
en el que calor absorbido por la máquina fue transformado en su totalidad en trabajo
mecánico. El valor de uno o cien por ciento es un caso ideal, ya que máquinas térmicas
como el automóvil, tienen eficiencias de alrededor del 70 %, lo que indica que el 30% del
calor absorbido no fue transformado en trabajo mecánico, ya que fue disipado hacia los
alrededores en la tercera etapa del ciclo de Carnot.
Otra forma de expresar la eficiencia es a través de la relación obtenida en la sección donde
se analizó al ciclo. Se estableció que el WCiclo = -QCiclo = -(QAB + QCD), por tanto:
|𝑊𝐶𝑖𝑐𝑙𝑜 | 𝑄𝐴𝐵 + 𝑄𝐶𝐷
𝜂= =
𝑄𝐴𝐵 𝑄𝐴𝐵
𝑸𝑪𝑫
𝜼=𝟏+ ….. ec. (14)
𝑸𝑨𝑩
NOTA: Recordar que el calor cedido (QCD) es una cantidad negativa.
6. Al restar las ecuaciones 14 y 13:
𝑄𝐶𝐷 𝑇2
𝜂 − 𝜂 = (1 + ) − (1 − )
𝑄𝐴𝐵 𝑇1
𝑄𝐶𝐷 𝑇2
0= + , reacomodando la expresión:
𝑄𝐴𝐵 𝑇1
𝑄𝐶𝐷 𝑄𝐴𝐵 𝑸𝑨𝑩 𝑸𝑪𝑫
=− por tanto: + = 𝟎 ….. ec. (15)
𝑇2 𝑇1 𝑻𝟏 𝑻𝟐
La ecuación anterior muestra la suma de los cocientes Qi/Ti bajo los cuales la
máquina térmica opera a lo largo del ciclo de Carnot. Si es una suma de términos,
la forma diferencial de la ecuación 15 aplicada al ciclo es:
đ𝑸𝒓𝒆𝒗
∮ =𝟎 ….. ec. (16)
𝑻
Recordando que para un ciclo sólo las funciones de estado son igual con cero, entonces
la ecuación 16 debe de ser la expresión para otra función de estado. A esta función se le
denomino entropía (S), de tal forma que la expresión 16 queda expresada como:
𝑆
2 đ𝑄𝑟𝑒𝑣
∫𝑆 𝑑𝑆 = ∮ 𝑇
=0 donde: đ 𝑒𝑠 𝑢𝑛𝑎 𝑑𝑖𝑓𝑒𝑟𝑒𝑛𝑐𝑖𝑎𝑙 𝑖𝑛𝑒𝑥𝑎𝑐𝑡𝑎
1
𝑑 𝑒𝑠 𝑢𝑛𝑎 𝑑𝑖𝑓𝑒𝑟𝑒𝑛𝑐𝑖𝑎𝑙 𝑒𝑥𝑎𝑐𝑡𝑎
đ𝑸𝒓𝒆𝒗
De forma general: 𝚫𝑺 = ∮
𝑻
J. Arturo Mendoza Nieto Facultad de Química, UNAM 6/7
Nota que el subíndice del calor es para indicar que en el caso del ciclo de Carnot todas
las etapas son reversibles y que por otro lado el término 𝒹𝑄𝑟𝑒𝑣 es una diferencial inexacta,
pero al ser dividida entre la temperatura se convierte en una diferencial exacta en conjunto.
La entropía de manera general es una función de estado que a nivel macroscópico indica
si un proceso ocurre de manera espontánea o no. Si S es positiva, se establece que un
proceso es espontáneo y ocurre en las condiciones estudiadas; por el contrario, si S
es una cantidad negativa estará asociada a un proceso NO espontáneo.
La segunda ley de la Termodinámica plantea que el proceso cíclico más simple para
producir un trabajo sobre los alrededores debe involucrar al menos dos fuentes de energía
calorífica a diferentes temperaturas (T1 y T2). La máquina diseñada por Carnot opera en
un ciclo reversible y debido a su simplicidad es el prototipo de las máquinas térmicas. De
tal forma, que la segunda ley de la Termodinámica establece que no es posible operar
cíclicamente una máquina térmica conectada únicamente a una reserva de energía
para producir un trabajo sobre los alrededores. Este enunciado es un equivalente
del postulado hecho por Lord Kelvin en 1850, cuando propuso su escala de
temperatura con base en el estudio de las máquinas reversibles.
Tarea Moral
1
1. Demuestra que para un proceso físico se cumple la siguiente relación: Δ𝑈 = Δ𝐻.
𝛾
2. Explique si la eficiencia de la máquina térmica aumenta o disminuye cuando:
a. Se aumenta T1, manteniendo fija T2.
b. Se disminuye T2, manteniendo fija T1.
3. Si se recorre el ciclo en el sentido opuesto (A→D→C→B→A), ¿a qué tipo de
máquina se hace referencia?
4. Si el siguiente ciclo de Carnot es
recorrido por un gas monoatómico y la
presión disminuye 40 % en el segmento
B→C, calcula:
a. El volumen, presión y temperatura
faltantes en cada estado del ciclo.
Considera que la temperatura está
expresada en K.
b. La cantidad de gas utilizada en
mol.
c. La eficiencia de la máquina térmica
en porcentaje y explica este
resultado.
J. Arturo Mendoza Nieto Facultad de Química, UNAM 7/7
También podría gustarte
- Primera Ley - Sistemas CerradosDocumento10 páginasPrimera Ley - Sistemas Cerradosrobertsan282843% (7)
- Ejercicio 1 y 2 Ciclos y SistemasDocumento5 páginasEjercicio 1 y 2 Ciclos y SistemasLaura RiosAún no hay calificaciones
- Grupos FuncionalesDocumento2 páginasGrupos FuncionalesALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Electrónica Básica Practica 4Documento8 páginasElectrónica Básica Practica 4Jose Starlin100% (1)
- Diagrama de Smith (Recuperado Automáticamente)Documento7 páginasDiagrama de Smith (Recuperado Automáticamente)Juan CastroAún no hay calificaciones
- 2º y 3º Ley de La Termodinamica PDFDocumento30 páginas2º y 3º Ley de La Termodinamica PDFkuro_usagi92Aún no hay calificaciones
- Segunda Ley de La TermodinámicaDocumento33 páginasSegunda Ley de La TermodinámicaKamila MartinezAún no hay calificaciones
- Entropía y Maquina TérmicaDocumento9 páginasEntropía y Maquina TérmicaJunior JesusAún no hay calificaciones
- 3-Sistemas CerradosDocumento20 páginas3-Sistemas CerradosLuciana Martinez BovierAún no hay calificaciones
- Problema TerdodinamicaDocumento5 páginasProblema TerdodinamicaPablo QuispeAún no hay calificaciones
- Enunciado de KelvinDocumento6 páginasEnunciado de KelvinYonaiker MorlesAún no hay calificaciones
- Ciclo de CarnotDocumento8 páginasCiclo de CarnotAaron100% (1)
- C04cl03ter1 PDFDocumento8 páginasC04cl03ter1 PDFNatalia ArrietaAún no hay calificaciones
- Tema 4 Primera Ley de TermodinámicaDocumento26 páginasTema 4 Primera Ley de TermodinámicaLAURA LYNCOLN ARUCUTIPA LLAVEAún no hay calificaciones
- Actividad Nº1-Unidad Nº4. Primer Principio de La TermodinàmicaDocumento6 páginasActividad Nº1-Unidad Nº4. Primer Principio de La TermodinàmicaGABRIELA DO SANTOSAún no hay calificaciones
- Tema 2. Balances de EnergiaDocumento6 páginasTema 2. Balances de EnergiaKarlisAún no hay calificaciones
- Segundo Principio de La TermodinamicaDocumento41 páginasSegundo Principio de La TermodinamicaGastón Berríos100% (1)
- Ciclo de Carnot Laboratorio FIIDocumento4 páginasCiclo de Carnot Laboratorio FIIEdgar Huapaya CamachoAún no hay calificaciones
- Investigacion Unidad 5 y 6Documento96 páginasInvestigacion Unidad 5 y 6Luis de la TorreAún no hay calificaciones
- Ciclo de CarnotDocumento11 páginasCiclo de CarnotLuis AliagaAún no hay calificaciones
- Ciclos OTTO C.P.Documento6 páginasCiclos OTTO C.P.Wiñay RecordsAún no hay calificaciones
- Laboratorio 5 Experimento VirtualDocumento5 páginasLaboratorio 5 Experimento VirtualFabrizioAún no hay calificaciones
- Ejercicios Actividad 3 Fisica Calor y OndasDocumento9 páginasEjercicios Actividad 3 Fisica Calor y OndasRaquel ChiquilloAún no hay calificaciones
- Ciclo de CarnotDocumento4 páginasCiclo de CarnotCrazyxbuccAún no hay calificaciones
- Ciclo de CarnotDocumento4 páginasCiclo de CarnotHans MedinaAún no hay calificaciones
- IQA211 Taller 5 - Resolución (2021-1)Documento9 páginasIQA211 Taller 5 - Resolución (2021-1)Paula Uribe BozzoAún no hay calificaciones
- 2º y 3º Ley de La TermodinamicaDocumento30 páginas2º y 3º Ley de La Termodinamicaahsim100% (1)
- Solución E1 2017-IIDocumento5 páginasSolución E1 2017-IILeibniz FourierAún no hay calificaciones
- Actividad 3 Julieth Alvis 6 - G4 - SolDocumento8 páginasActividad 3 Julieth Alvis 6 - G4 - SolJulieth Alvis100% (2)
- El Ciclo de Carnot y El Teorema de ClausiusDocumento6 páginasEl Ciclo de Carnot y El Teorema de ClausiusAndrésAlfaroCerazoAún no hay calificaciones
- Examen Termodinamica UNED Feb2013Documento8 páginasExamen Termodinamica UNED Feb2013Pere PauAún no hay calificaciones
- Ciclo OTTODocumento9 páginasCiclo OTTOcdoniguianAún no hay calificaciones
- Trabajo Fisicoquímica IDocumento38 páginasTrabajo Fisicoquímica ICristian DiazAún no hay calificaciones
- Ejercicios Resueltos Ciclos-2Documento6 páginasEjercicios Resueltos Ciclos-2DonGatoAún no hay calificaciones
- Ciclo de Carnot Fisica IIDocumento4 páginasCiclo de Carnot Fisica IIJavier Escalante VillanuevaAún no hay calificaciones
- Resueltos 2015-13y14Documento7 páginasResueltos 2015-13y14JoacoAún no hay calificaciones
- Trabajo Académico 4Documento5 páginasTrabajo Académico 4Vladimir Williams Velasquez PaucarAún no hay calificaciones
- Ejercicios EntropiaDocumento13 páginasEjercicios Entropiaquimicocad9891Aún no hay calificaciones
- Proceso Politropico (Huatangare)Documento10 páginasProceso Politropico (Huatangare)Gilbert Baique CamachoAún no hay calificaciones
- (Sem 005) Usmp - TermodinamicaDocumento29 páginas(Sem 005) Usmp - TermodinamicaFiorella Alessandra Flores Gama0% (1)
- Ef Termodinámica Grupo#10Documento9 páginasEf Termodinámica Grupo#10AYUDA.COMAún no hay calificaciones
- Primer Ejercicios FelderDocumento13 páginasPrimer Ejercicios Feldermarlont197100% (1)
- 5.2 Ciclo de CarnotDocumento10 páginas5.2 Ciclo de CarnotTotoAún no hay calificaciones
- La Termodinámica Es Una Ciencia Que Describe Sistemas Con Tal Número de Partículas Que Es Imposible Usar Solo La Mecánica Clásica para EstudiarlosDocumento29 páginasLa Termodinámica Es Una Ciencia Que Describe Sistemas Con Tal Número de Partículas Que Es Imposible Usar Solo La Mecánica Clásica para EstudiarlosJEFFERSON DAITON GOMEZ SHUPINGAHUAAún no hay calificaciones
- Ciclo Joule BraytonDocumento17 páginasCiclo Joule BraytonJunior Jonathan Castillo CuadraAún no hay calificaciones
- Ciclo de Carnot, ImprimirDocumento10 páginasCiclo de Carnot, ImprimirrocioAún no hay calificaciones
- Balance de Energia ClaseDocumento53 páginasBalance de Energia ClaseLluvia Linnett Martínez ReséndizAún no hay calificaciones
- Maquinas TermicasDocumento31 páginasMaquinas TermicasBrayanLlanosAún no hay calificaciones
- 9 HGDocumento25 páginas9 HGCarlos Angel Vilcapaza Caceres100% (1)
- Ciclo de CarnotDocumento11 páginasCiclo de CarnotIsaac ValdiviezoAún no hay calificaciones
- Ciclo de Carnot y Rankine 2Documento13 páginasCiclo de Carnot y Rankine 2Osvaldo AmadorAún no hay calificaciones
- Segunda Ley de La Termodiamica BNBNNBMMDocumento31 páginasSegunda Ley de La Termodiamica BNBNNBMMsalvayopsAún no hay calificaciones
- Segunda Ley de La TermodinámicaDocumento18 páginasSegunda Ley de La TermodinámicaLuis martinez estradaAún no hay calificaciones
- Ciclo de Carnot y RankineDocumento13 páginasCiclo de Carnot y RankineOsvaldo AmadorAún no hay calificaciones
- Problemas Abril 2009Documento9 páginasProblemas Abril 2009María Milagros Irenesther Ríos MendozaAún no hay calificaciones
- Ciclo de Carnott y Ciclo de OttoDocumento15 páginasCiclo de Carnott y Ciclo de OttoShirley Ayala100% (2)
- Guia de Maquinas Termicas y Ciclos TermodinamicosDocumento5 páginasGuia de Maquinas Termicas y Ciclos Termodinamicossaul coyAún no hay calificaciones
- Ciclo de CarnotDocumento4 páginasCiclo de CarnotDanitzaAún no hay calificaciones
- Ciclo de OttoDocumento8 páginasCiclo de OttoGere ValeAún no hay calificaciones
- Clase7 280917Documento16 páginasClase7 280917CLAUDIO ALONSO MADRIDAún no hay calificaciones
- Practica 4 Compresion en 2etapasDocumento6 páginasPractica 4 Compresion en 2etapasMagali CarolinaAún no hay calificaciones
- Bases de La Terapia de Grupo Diaz Portillo, Isabel. Editorial PaxDocumento202 páginasBases de La Terapia de Grupo Diaz Portillo, Isabel. Editorial PaxPedro Enrique SanchezAún no hay calificaciones
- Cuestionario previo 1 QIDocumento2 páginasCuestionario previo 1 QIALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Oxidación de Metales y Propiedades PeriódicasDocumento10 páginasOxidación de Metales y Propiedades PeriódicasFaKe M1XAún no hay calificaciones
- Fuerza y Campo MagneticoDocumento6 páginasFuerza y Campo MagneticoALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Dependencia de La Entalpía Con La TemperaturaDocumento8 páginasDependencia de La Entalpía Con La TemperaturaALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Proceso Adiabático: Caso 0Documento7 páginasProceso Adiabático: Caso 0ALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Tarea MezclasDocumento16 páginasTarea MezclasALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Diagrama Practica 4 TermoDocumento1 páginaDiagrama Practica 4 TermoALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Tarea ComposicionDocumento2 páginasTarea ComposicionALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Tarea IsotoposDocumento12 páginasTarea IsotoposALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Tarea MolDocumento2 páginasTarea MolALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Reporte Practica 1 TermoDocumento6 páginasReporte Practica 1 TermoALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Tarea MateriaDocumento10 páginasTarea MateriaALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Practica 8Documento4 páginasPractica 8ALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Practicas de Laboratorio 10-11Documento15 páginasPracticas de Laboratorio 10-11ALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- El Papel Del Trabajo en La Transformación Del Mono en Hombre PDFDocumento2 páginasEl Papel Del Trabajo en La Transformación Del Mono en Hombre PDFALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- TareasAlgebraSuperior2021 2Documento2 páginasTareasAlgebraSuperior2021 2ALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Practica 8 LaboratorioDocumento7 páginasPractica 8 LaboratorioALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Reporte de Laboratorio. Práctica No. 7 Reacciones ReversiblesDocumento4 páginasReporte de Laboratorio. Práctica No. 7 Reacciones ReversiblesALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- MedidasDocumento2 páginasMedidasALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Práctica Laboratorio 6Documento4 páginasPráctica Laboratorio 6ALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Numeros ComplejosDocumento2 páginasNumeros ComplejosALEXIS GAEL REBOLLEDO VALENCIAAún no hay calificaciones
- Curso Reología AplicadaDocumento97 páginasCurso Reología AplicadaandresAún no hay calificaciones
- P1 Orellana MenjivarDocumento13 páginasP1 Orellana MenjivarArmando OrellanaAún no hay calificaciones
- Motor UniversalDocumento7 páginasMotor UniversalDarwin QuitoAún no hay calificaciones
- Informe 10Documento12 páginasInforme 10nik alimber apaza sanchezAún no hay calificaciones
- Transmisores InfografíaDocumento1 páginaTransmisores InfografíaLuisa Fernanda Hernández CamarilloAún no hay calificaciones
- Experimento Aplicación No.2Documento8 páginasExperimento Aplicación No.2Edwin Alexander Ospina PennaAún no hay calificaciones
- Aislamiento en Maquinas RotatoriasDocumento4 páginasAislamiento en Maquinas Rotatoriasariel jaldinAún no hay calificaciones
- Leyes Fundamentales de Las Reacciones Químicas: Leyes Ponderales: Relacionadas Con La MasaDocumento16 páginasLeyes Fundamentales de Las Reacciones Químicas: Leyes Ponderales: Relacionadas Con La MasaAnibalGTXAún no hay calificaciones
- 7.2.2. Procedimiento Estandarización y Validación de MétodosDocumento12 páginas7.2.2. Procedimiento Estandarización y Validación de MétodosDaniela Ojeda BarreraAún no hay calificaciones
- Lab 6 FisicaDocumento4 páginasLab 6 FisicaAnónimoxdAún no hay calificaciones
- Motores Eléctricos TechtopDocumento84 páginasMotores Eléctricos TechtopanfernbAún no hay calificaciones
- 2do Parcial ElectrotecniaDocumento8 páginas2do Parcial ElectrotecniaCamila PiraneoAún no hay calificaciones
- Infome NCH 1116 1117 1239Documento18 páginasInfome NCH 1116 1117 1239Claudio PiresAún no hay calificaciones
- Informe N°3Documento14 páginasInforme N°3Sandra Amajaya MAún no hay calificaciones
- La EnergíaDocumento13 páginasLa Energíacecilia del pinoAún no hay calificaciones
- Informe Puntos Geodesico1Documento29 páginasInforme Puntos Geodesico1RaulAlejandroMaldonadoPeñaAún no hay calificaciones
- Módulo - 1 - Motores y ProtecciónDocumento492 páginasMódulo - 1 - Motores y ProtecciónAxel Rodriguez AAún no hay calificaciones
- Serie3 TDocumento4 páginasSerie3 TDavid Barnard GonzálezAún no hay calificaciones
- Probabilidad y Estadistica 9na Edicion-Pages-41-46Documento6 páginasProbabilidad y Estadistica 9na Edicion-Pages-41-46Sam OakAún no hay calificaciones
- Unidad 1 - EjerciciosDocumento9 páginasUnidad 1 - EjerciciosKevin Damián Morocho PorrasAún no hay calificaciones
- Taller 4 ContaminacionDocumento3 páginasTaller 4 ContaminacionDirceo Bravo MosqueraAún no hay calificaciones
- Tercero de BachilleratoDocumento8 páginasTercero de BachilleratoMirella MedinaAún no hay calificaciones
- Apunte - Dinamica de ParticulasDocumento8 páginasApunte - Dinamica de ParticulasEdgardo NovoaAún no hay calificaciones
- FormularioDocumento1 páginaFormulariohecor miguelAún no hay calificaciones
- Diseño de Un Convertidor CC-CC ElevadorDocumento8 páginasDiseño de Un Convertidor CC-CC ElevadorSebastian Ospina VictoriaAún no hay calificaciones
- Ejercicios de Termodinámica para Cuarto Grado de SecundariaDocumento4 páginasEjercicios de Termodinámica para Cuarto Grado de Secundariajose almonacidAún no hay calificaciones
- Laboratorio #5Documento4 páginasLaboratorio #5Jose AntonioAún no hay calificaciones
- Informe Bomba CentrifugaDocumento46 páginasInforme Bomba CentrifugaMarite EnriquezAún no hay calificaciones