Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Qué Es Concentración Química
Cargado por
Lucesita LuxzTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Qué Es Concentración Química
Cargado por
Lucesita LuxzCopyright:
Formatos disponibles
Qué es concentración química
La concentración química determina la cantidad de soluto y solvente en una solución química.
La concentración química es la proporción de las sustancias que se disuelven (solutos) en relación con la cantidad total
de la solución. En este sentido, la cantidad de soluto siempre será menor al solvente para que se considere una solución.
La preparación de una solución química requiere de calcular las medidas de soluto y solvente. Esto determinará la
concentración de la solución y el tipo de solución. Las concentraciones de las soluciones se expresan
por molaridad, molalidad o fracción molar, entre otros.
Medidas y fórmulas de concentración química
Las medidas de concentración de soluciones químicas son determinadas por unidades físicas y unidades químicas de
concentración.
Por un lado, las unidades físicas son aquellas que definen la proporción entre el soluto y el solvente en masa, volumen o
sus partes.
Las unidades químicas, por otro lado, definen la concentración de la solución por moles o equivalentes químicos que
presenta el solvente.
Unidades físicas de concentración de soluciones
Las unidades físicas de concentración de soluciones expresan la proporción de soluto en peso, volumen o partes. Esta
proporción se calcula siempre con respecto a la cantidad total de la solución.
Las fórmulas para calcular el porcentaje en masa o peso, o sea, su concentración, divide la cantidad de soluto por la de la
solución. Finalmente, el resultado se suele multiplicar por 100.
Las medidas físicas de las concentraciones químicas y sus fórmulas son las siguientes:
Masa sobre masa
Masa sobre masa (%m/m), o también peso sobre peso (%p/p) expresa el porcentaje de masa o peso de soluto en
relación con a la masa o peso de solución.
Volumen sobre volumen
Volumen por volumen (%v/v) indica la proporción del volumen del soluto en el volumen total de la solución.
Masa sobre volumen
Masa sobre volumen (%m/v), o peso sobre volumen (%p/v), representa la masa o peso del soluto respecto al volumen
de la solución.
Partes por millón
Partes por millón (ppm) calcula los miligramos de soluto por kilogramos de solución. En este caso, el resultado se
multiplica por un millón.
Unidades químicas de concentración de soluciones
Las unidades químicas de concentración de soluciones calculan la cantidad de moles o de equivalentes químicos de un
soluto en una solución.
Las medidas químicas de concentración y sus respectivas fórmulas son:
Molaridad
La molaridad es el número de moles de soluto en litros de solución. Un mol es una cantidad de átomos de carbono
expresado en la constante de Avogadro.
Para determinar el número de moles del soluto, es necesario conocer la masa molar de los elementos. Para ello, basta
consultar una tabla periódica. La masa molar que se encuentra debajo del símbolo químico del elemento y también es
conocida como masa atómica.
Molalidad
Para calcular la molalidad, se utiliza la siguiente fórmula:
Para el cálculo de moles de un soluto se busca la masa atómica o masa molar que se encuentra debajo de cada elemento
químico de la tabla periódica.
Normalidad
La normalidad es el número de equivalentes químicos (EQ) en un gramo de soluto contenido en un litro de solución. Los
equivalentes químicos son la cantidad de sustancia que reacciona para producir un mol de producto.
La normalidad también es conocida como concentración normal y se calcula usando la siguiente fórmula:
Para calcular el equivalente químico (EQ) de un soluto se debe tener en cuenta si el soluto es un ácido o un hidróxido
(OH) y el uso de las siguientes fórmulas según el soluto que corresponda.
También podría gustarte
- Qué Es Concentración QuímicaDocumento3 páginasQué Es Concentración QuímicaLuis HernándezAún no hay calificaciones
- Unidades Físicas de ConcentraciónDocumento7 páginasUnidades Físicas de ConcentraciónPaula GordillpAún no hay calificaciones
- Concentración QuímicaDocumento5 páginasConcentración QuímicaALEJANDRA AMAYA RAMOSAún no hay calificaciones
- Concentración QuimicaDocumento5 páginasConcentración QuimicaVictor Mayorga TapieroAún no hay calificaciones
- EstequiometriaDocumento5 páginasEstequiometriaDark EsmeraldAún no hay calificaciones
- Concentración QuímicaDocumento19 páginasConcentración QuímicaJean Carlos Velasquez ZamoraAún no hay calificaciones
- 9ead6a40 Deber Quimica EstequiometriaDocumento2 páginas9ead6a40 Deber Quimica EstequiometriaMiky BorjaAún no hay calificaciones
- Solubilidad Concentracion de Las SolucionesDocumento9 páginasSolubilidad Concentracion de Las SolucionesAngie LopezAún no hay calificaciones
- Importancia de la concentración químicaDocumento4 páginasImportancia de la concentración químicavictoria fragaAún no hay calificaciones
- Concentración QuímicaDocumento4 páginasConcentración QuímicanicoAún no hay calificaciones
- QuimicaDocumento7 páginasQuimicaHeider yesid Ortiz cordobaAún no hay calificaciones
- Informe de Laboratorio - TitulacionesDocumento33 páginasInforme de Laboratorio - Titulacionesdaniela varelaAún no hay calificaciones
- Unidades de Concentracion de SolucionesDocumento18 páginasUnidades de Concentracion de Solucionesalvaro alvarez palaciosAún no hay calificaciones
- Quimica Inorganica (Bryan Flores)Documento5 páginasQuimica Inorganica (Bryan Flores)JHOEL LLANOS ALVARADOAún no hay calificaciones
- PRACTICA #6 TERMINADO Ok OkDocumento18 páginasPRACTICA #6 TERMINADO Ok OkScarlett Valverde CastilloAún no hay calificaciones
- Agregado Mi Parte Practica 06Documento19 páginasAgregado Mi Parte Practica 06lisset linaresAún no hay calificaciones
- Soluciones ValoradasDocumento12 páginasSoluciones ValoradasMiguel Ángel Mejía Benito80% (5)
- La MolaridadDocumento2 páginasLa Molaridadkristels190Aún no hay calificaciones
- C. Práctica 3 Preparación de Soluciones (Porcentuales)Documento13 páginasC. Práctica 3 Preparación de Soluciones (Porcentuales)silvia25% (4)
- Definición y propiedades de concentración en solucionesDocumento2 páginasDefinición y propiedades de concentración en solucionesAnthonella FreitesAún no hay calificaciones
- Proyecto de Quimica (2) - (UAE)Documento14 páginasProyecto de Quimica (2) - (UAE)Tabata PumaAún no hay calificaciones
- Soluciones TeoriaDocumento4 páginasSoluciones TeoriaLenin Alfaro VidalAún no hay calificaciones
- 1 Marco Teorico - Docx Andy 23Documento4 páginas1 Marco Teorico - Docx Andy 23Julian SanabriaAún no hay calificaciones
- Concentración de Las DisolucionesDocumento8 páginasConcentración de Las DisolucionesKhrriz CastilloAún no hay calificaciones
- Informe N°1 - Ejercicios para La Preparación de Soluciones Estándares y DilucionesDocumento6 páginasInforme N°1 - Ejercicios para La Preparación de Soluciones Estándares y DilucionesSamy Alejandro AlmeidaAún no hay calificaciones
- Unidad 5Documento6 páginasUnidad 5Anee' GarciaAún no hay calificaciones
- Tarea 22Documento6 páginasTarea 22mariaAún no hay calificaciones
- Quimica 1era Parte y 2da Parte Ejercicio 1 Y2Documento6 páginasQuimica 1era Parte y 2da Parte Ejercicio 1 Y2Carlos RamirezAún no hay calificaciones
- Solubilidad y concentraciónDocumento14 páginasSolubilidad y concentraciónpakormzAún no hay calificaciones
- Soluciones: concentraciones y cálculosDocumento5 páginasSoluciones: concentraciones y cálculosIris Azucena Fernández SalazarAún no hay calificaciones
- Como Se Expresa La Concentracion de Una Solucion en Unidades Fisicas y QuímicasDocumento3 páginasComo Se Expresa La Concentracion de Una Solucion en Unidades Fisicas y QuímicasJuan Fernando Arenas MercadoAún no hay calificaciones
- Guía práctica 7 y 8 II PAC 23Documento14 páginasGuía práctica 7 y 8 II PAC 23Wabs naAún no hay calificaciones
- Concentracion de SolucionesDocumento15 páginasConcentracion de SolucionessilvioAún no hay calificaciones
- 1 Taller de Quimica OrganicaDocumento2 páginas1 Taller de Quimica OrganicaLeyner SalgadoAún no hay calificaciones
- Concentración de Las DisolucionesDocumento20 páginasConcentración de Las DisolucionesValiente Imperator100% (1)
- Soluciones químicas: tipos, componentes y unidades de concentraciónDocumento4 páginasSoluciones químicas: tipos, componentes y unidades de concentracióneduardo rodriguezAún no hay calificaciones
- Anatomia IntroduccionDocumento2 páginasAnatomia Introduccionlizzeth villanueva perezAún no hay calificaciones
- Practica #12Documento7 páginasPractica #12Ana C SimancaAún no hay calificaciones
- Unidades de ConcentracionDocumento2 páginasUnidades de ConcentracionInforlink ImpresionesAún no hay calificaciones
- Concentración de SolucionesDocumento3 páginasConcentración de SolucionesGabriel Torres MAún no hay calificaciones
- IV SolucionesDocumento8 páginasIV SolucionessandracmendozaAún no hay calificaciones
- Concentraciones QuímicasDocumento29 páginasConcentraciones QuímicasdarmarielAún no hay calificaciones
- SolucionesDocumento9 páginasSolucionesJim AvilaAún no hay calificaciones
- Formas de Expresar La ConcentraciónDocumento4 páginasFormas de Expresar La ConcentraciónJuan Antonio Garcia AvalosAún no hay calificaciones
- QuimicaDocumento4 páginasQuimicamariana cabezaAún no hay calificaciones
- Concentraciones de solucionesDocumento3 páginasConcentraciones de solucionesJose Alfredo ParejoAún no hay calificaciones
- Preparación de Soluciones Química.Documento24 páginasPreparación de Soluciones Química.Alejandro LunaAún no hay calificaciones
- Unidades Físicas de ConcentraciónDocumento19 páginasUnidades Físicas de Concentraciónjushina88100% (2)
- Practica 4. Soluciones-1Documento5 páginasPractica 4. Soluciones-1Keiri Tatiana Reyes MelgaresAún no hay calificaciones
- Disolusion ValoradaDocumento3 páginasDisolusion ValoradaMarisa LopezAún no hay calificaciones
- Formas de ExtracciónDocumento4 páginasFormas de ExtracciónJocelyn OHAún no hay calificaciones
- Titulación Ácido Base - EstandarizaciónDocumento6 páginasTitulación Ácido Base - EstandarizaciónLuis PAún no hay calificaciones
- Determinación concentración solución densidadDocumento11 páginasDeterminación concentración solución densidadKEISY CAROLINA MARRIAGA TORRESAún no hay calificaciones
- Guía 5to Parcial Química BásicaDocumento3 páginasGuía 5to Parcial Química BásicaLuis CaguaAún no hay calificaciones
- Exposición de Soluciones ValoradasDocumento14 páginasExposición de Soluciones ValoradasMiguel Ángel Mejía Benito100% (1)
- Informe #1 - Preparación de Soluciones Estandares y DiluidasDocumento7 páginasInforme #1 - Preparación de Soluciones Estandares y DiluidasJenifer AracelyAún no hay calificaciones
- Wa0008.Documento5 páginasWa0008.Alexx SosoAún no hay calificaciones
- Preparación y concentración de soluciones (PrepConcSolDocumento17 páginasPreparación y concentración de soluciones (PrepConcSolCarlos OrtizAún no hay calificaciones
- Formas de Expresar La ConcentraciónDocumento4 páginasFormas de Expresar La ConcentraciónleoespinoAún no hay calificaciones
- Farmacometría:Curvas dosis-respuesta de tipo gradual. Volumen 1De EverandFarmacometría:Curvas dosis-respuesta de tipo gradual. Volumen 1Aún no hay calificaciones
- Evaluación Final y Plan de Sostenibilidad de la Alianza NEO ParaguayDocumento17 páginasEvaluación Final y Plan de Sostenibilidad de la Alianza NEO ParaguaychristhianAún no hay calificaciones
- Aplicación de Código de BarrasDocumento2 páginasAplicación de Código de BarrasAlan Alonso Ramirez AlorAún no hay calificaciones
- Ejeplo de Suma de MatricesDocumento1 páginaEjeplo de Suma de Matricesomar corralAún no hay calificaciones
- ACTADocumento8 páginasACTADANIELA MABEL CHOQUECONDO ASPILCUETAAún no hay calificaciones
- Piojos Liendres IIDocumento2 páginasPiojos Liendres IILis Ensalander100% (1)
- Texto ArgumentativoDocumento3 páginasTexto ArgumentativoCristian CalderonAún no hay calificaciones
- Gaceta: Lineamientos Generales para La Creación de Programas EducativosDocumento20 páginasGaceta: Lineamientos Generales para La Creación de Programas EducativosKevin WilliamsAún no hay calificaciones
- Reglamento Ord 019 MDMQ ConsolidadoDocumento21 páginasReglamento Ord 019 MDMQ ConsolidadoAlanis PaoAún no hay calificaciones
- Las pinturas sobre la pazDocumento4 páginasLas pinturas sobre la pazMauricio MarrufoAún no hay calificaciones
- Cuestionario de PelvisDocumento7 páginasCuestionario de PelvisKatyta JiménezAún no hay calificaciones
- 21 Economia CircularDocumento60 páginas21 Economia CircularAna CalzadoAún no hay calificaciones
- Derivadas Máximos Mínimos PuntosDocumento12 páginasDerivadas Máximos Mínimos PuntoslgmartinezgAún no hay calificaciones
- Practica 8 - Obtencion de ColestenonaDocumento7 páginasPractica 8 - Obtencion de ColestenonaJesus Tacuba Larumbe0% (1)
- Rocool 600 Saneamador Saneamientos Amador Moreno PDFDocumento79 páginasRocool 600 Saneamador Saneamientos Amador Moreno PDFSaneamientos Amador MorenoAún no hay calificaciones
- CMS 7a1Documento1 páginaCMS 7a1john yapuchura100% (1)
- GUIA - U3 - Seminario de InvestigaciónDocumento11 páginasGUIA - U3 - Seminario de InvestigaciónJose Mendoza FalconAún no hay calificaciones
- Respuestas Tema 1Documento8 páginasRespuestas Tema 1Facu Paredes100% (1)
- HBF - Incmnsz - Dolor Ago 2019 FinalDocumento45 páginasHBF - Incmnsz - Dolor Ago 2019 Finaljem bistreAún no hay calificaciones
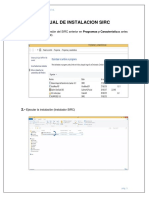
- Manual Instalacion Sirc PDFDocumento6 páginasManual Instalacion Sirc PDFEdgardAsuncionLazaroHuamaniAún no hay calificaciones
- Codificar cuentas y ciclo contableDocumento58 páginasCodificar cuentas y ciclo contableMarco FonsecaAún no hay calificaciones
- Cultivo Del TrigoDocumento79 páginasCultivo Del TrigoRoberto Venado CamposAún no hay calificaciones
- Parte3 1Documento59 páginasParte3 1Nelson PinedaAún no hay calificaciones
- Comunicación Asertiva desde la Inteligencia EmocionalDocumento25 páginasComunicación Asertiva desde la Inteligencia EmocionalMónica Reneé SoriaAún no hay calificaciones
- Manual StrettoDocumento52 páginasManual StrettoMauricio LeonAún no hay calificaciones
- Conclusion Salud MentalDocumento1 páginaConclusion Salud MentalAURA VALDEZ PARRITA0% (1)
- Couma Macrocarpa OsinforDocumento2 páginasCouma Macrocarpa OsinforWilliam Reynaldo Ñahuero JulcarimaAún no hay calificaciones
- Radiación Solar Su Proceso de ConvenciónDocumento17 páginasRadiación Solar Su Proceso de ConvenciónAngeles MedinaAún no hay calificaciones
- Cap 41 Al 46Documento6 páginasCap 41 Al 46Adolfo Apaza CruzAún no hay calificaciones
- Cuadro Comparativo Culturas Mesoamericanas - CompressDocumento4 páginasCuadro Comparativo Culturas Mesoamericanas - CompressKarla Martínez.Aún no hay calificaciones
- Martínez Martínez Luis Enrique - Act3 - U2 - 3C (Corregido)Documento6 páginasMartínez Martínez Luis Enrique - Act3 - U2 - 3C (Corregido)nancyAún no hay calificaciones