Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Semejanzas y Diferencias de Los Modelos Atomicos y Ejercicios Resueltos
Semejanzas y Diferencias de Los Modelos Atomicos y Ejercicios Resueltos
Cargado por
BautiXDD OMGTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Semejanzas y Diferencias de Los Modelos Atomicos y Ejercicios Resueltos
Semejanzas y Diferencias de Los Modelos Atomicos y Ejercicios Resueltos
Cargado por
BautiXDD OMGCopyright:
Formatos disponibles
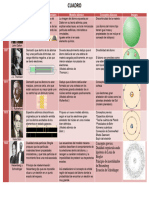
SEMEJANZAS Y DIFERENCIAS DE LOS MODELOS ATÓMICOS
SEMEJANZAS DIFERENCIAS
La materia estaba constituida por Se crea por primera vez la teoría
LEUCIPO
DEMÓCRITO Y
pequeñísimas partículas llamadas atómica por Leucipo
“átomos”.
Aportó la teoría atómica de las Fue el primer modelo con bases
JOHN DALTON
partículas esféricas, no divisibles científicas
iguales entre sí en cada elemento Obtuvo las leyes clásicas de la
químico. química.
La materia está formada por
partículas muy pequeñas llamadas
átomos, que son indivisibles y no se
pueden destruir.
Afirma que el átomo es como una Es una teoría sobre la estructura
N
THOMSO
JHON
JOSEPH ERNEST
esfera de carga positiva en la que atómica
hay inscrustados electrones con No establece la existencia de
carga negativa. orbitales para los electrones
RUTHERFORD
Estableció un nuevo modelo en el Se basó en los resultados
cual el átomo poseía un núcleo o obtenidos en sus experimentos
centro en el cual se concentra la de bombardeo de láminas
masa y la carga positiva. delgadas de metal.
Los electrones se encontraban No se establece si el átomo
girando alrededor del núcleo permanece en su mismo nivel de
manteniéndose éstos gracias a las energía o no.
fuerzas de atracción.
NIELS BOHR
Los elesctrones giran alrededor del Bohr se basó en el átomo de
núcleo hidrógeno para hacer el modelo
que lleva su nombre.
Dice que no sólo existen
protones en el núcleo sino
también neutrones.
El átomo posee niveles y
subniveles bien definidos donde
orbitan los electrones.
A igual que el Modelo atómico de
SOMMERFELD
ARNOLD
Bohr, Los electrones se mueven
alrededor del núcleo en órbitas
circulares o elípticas y a partir del
segundo nivel energético existen
dos o más subniveles en el mismo
nivel.
Es un modelo cuántico no
ERWIN SCHONDINGER
relativista
La ecuación de Schodinger,
representa la versión cuántica,
una cantidad que contiene la
suma de energía cinética y
potencial.
Propuso el modelo atómico
actual también conocido como
ecuación de onda
Planteó que el electrón podría
considerarse como una onda
para explicar su comportamiento
en el átomo.
También podría gustarte
- Los Modelos AtómicosDocumento5 páginasLos Modelos AtómicosMayra Flores Luna71% (7)
- Modelos Atómicos TripticoDocumento5 páginasModelos Atómicos TripticoMayra Flores Luna79% (14)
- Los Postulados de La Teoría Atómica de ThomsonDocumento6 páginasLos Postulados de La Teoría Atómica de ThomsonLechero De Corazon MH50% (2)
- Capitulo 1 - DisolucionesDocumento51 páginasCapitulo 1 - DisolucionesCRISTHIAN ANDREY PINZON ESTEVEZAún no hay calificaciones
- Taller Modelos AtomicosDocumento2 páginasTaller Modelos AtomicosJenny Patricia Mina Balanta0% (1)
- Espectro de Diseño Covenin 1756-2018Documento14 páginasEspectro de Diseño Covenin 1756-2018oswaldo0% (1)
- Teoria AtomicaDocumento3 páginasTeoria AtomicaNeheyler MecatrónicoAún no hay calificaciones
- Anexo No 2 Modelos AtómicosDocumento4 páginasAnexo No 2 Modelos AtómicosLuz Nelly Maya OrtizAún no hay calificaciones
- Taller Modelos AtomicosDocumento2 páginasTaller Modelos AtomicosIsco Yepes MejiaAún no hay calificaciones
- Https9c91d081 E268 4ef1 Bd3e E09b98573a36.usrfiles - Comugd9c91d0 .PDF 2Documento15 páginasHttps9c91d081 E268 4ef1 Bd3e E09b98573a36.usrfiles - Comugd9c91d0 .PDF 2Rocio Fernandez100% (1)
- Actividad 1. Investigación de Modelos AtómicosDocumento1 páginaActividad 1. Investigación de Modelos AtómicosTonantzin Ireri Castro Zavala100% (2)
- Principio de Saint-VenantDocumento8 páginasPrincipio de Saint-VenantJarumi Villalobos CortezAún no hay calificaciones
- Linea Del Tiempo de La Teoria AtomicaDocumento2 páginasLinea Del Tiempo de La Teoria AtomicaMadrid Silva Victor Joshua 1IM11Aún no hay calificaciones
- Modelos Atomicos TripticoDocumento4 páginasModelos Atomicos Tripticomiguel100% (2)
- Linea de Tiempo AlgoritmoDocumento3 páginasLinea de Tiempo AlgoritmoPedro José Ballesteros Cerpa75% (4)
- Modelos AtómicosDocumento1 páginaModelos AtómicosEugenia Ospino100% (2)
- Modelos AtómicosDocumento27 páginasModelos AtómicosMiryam Aguilar Velásquez100% (1)
- Tarea2 B1 ÁtomoDocumento8 páginasTarea2 B1 ÁtomoDaniel AvantesAún no hay calificaciones
- Teoría Atómica y Estructura de La Materia Equipo 3Documento23 páginasTeoría Atómica y Estructura de La Materia Equipo 3lesliemartinezAún no hay calificaciones
- Presentacion Power Point Episodio 4 IIDocumento24 páginasPresentacion Power Point Episodio 4 IIMaría Eugenia García CarralAún no hay calificaciones
- El Átomo Química 3er Año (2020)Documento6 páginasEl Átomo Química 3er Año (2020)Miguel Matías RomeroAún no hay calificaciones
- Cuadro Sinóptico de Estructura y Modelos AtómicosDocumento4 páginasCuadro Sinóptico de Estructura y Modelos Atómicosedith vAún no hay calificaciones
- Semana 02. Teoría Atómica, Estructura Atómica, Unidades Químicas de MasaDocumento7 páginasSemana 02. Teoría Atómica, Estructura Atómica, Unidades Químicas de MasaLeyri DiazAún no hay calificaciones
- Los Modelos Atomicos y Su HistoriaDocumento5 páginasLos Modelos Atomicos y Su HistoriaKennia Rivera GuapulemaAún no hay calificaciones
- Quimica BasicaDocumento2 páginasQuimica BasicaGuillermo Montero HerreraAún no hay calificaciones
- Introducción Química Tarea 2 Enlaces y ConfiguracionesDocumento7 páginasIntroducción Química Tarea 2 Enlaces y ConfiguracionesJeyberAlexanderO.ZAún no hay calificaciones
- La CienciaDocumento1 páginaLa CienciaSanndy GPAún no hay calificaciones
- Quimica de 8 y 9 Modelos AtomicosDocumento9 páginasQuimica de 8 y 9 Modelos AtomicosAlejandra HenaoAún no hay calificaciones
- El ÁtomoDocumento16 páginasEl ÁtomoDaniel OrtuñoAún no hay calificaciones
- Unidad Educativa Si Miao Wei Hua QuimicaaDocumento10 páginasUnidad Educativa Si Miao Wei Hua QuimicaaMelissa FigueroaAún no hay calificaciones
- Estructura Atomica El Etomo - TeoriaDocumento3 páginasEstructura Atomica El Etomo - TeoriaSilvia Esmeralda Atoche MirandaAún no hay calificaciones
- Resumen QuimicaDocumento51 páginasResumen QuimicaVale GárateAún no hay calificaciones
- Unidad 2. El Átomo-2 Canva BEADocumento21 páginasUnidad 2. El Átomo-2 Canva BEAAna Paz GonzálezAún no hay calificaciones
- Tarea 6 QUIMICADocumento6 páginasTarea 6 QUIMICAAnita Morales100% (1)
- Modulo 4 QT 2021Documento7 páginasModulo 4 QT 2021Carina BogadoAún no hay calificaciones
- El Átomo1Documento3 páginasEl Átomo1marinyolanda1954Aún no hay calificaciones
- Linea de TiempoDocumento6 páginasLinea de TiempoYamilet ReyesAún no hay calificaciones
- Teoría AtómicaDocumento2 páginasTeoría AtómicaWilfredo José VallejosAún no hay calificaciones
- Unidad 2. Estructura AtómicaDocumento33 páginasUnidad 2. Estructura AtómicaPhoenix Juegos y masAún no hay calificaciones
- Atividad - Modelos AtómicosDocumento2 páginasAtividad - Modelos AtómicosGab BrielAún no hay calificaciones
- Modelos AtomicosDocumento2 páginasModelos Atomicosmanuelsitotuidolo11Aún no hay calificaciones
- Teoría AtómicaDocumento5 páginasTeoría AtómicaPercy PérezAún no hay calificaciones
- Tarea Evidencias de Estructura AtómicaDocumento5 páginasTarea Evidencias de Estructura Atómicaalanntorres09ctrlAún no hay calificaciones
- TEORÍA ATÓMICA (Parte 1)Documento4 páginasTEORÍA ATÓMICA (Parte 1)Neheyler MecatrónicoAún no hay calificaciones
- Cuadro Comparativo, Ortiz Rondón Rogger Joaquín, C.I 28.650.780, Sección 01Documento3 páginasCuadro Comparativo, Ortiz Rondón Rogger Joaquín, C.I 28.650.780, Sección 01Rogger Rjor100% (1)
- Atomos y Modelos AtomicosDocumento4 páginasAtomos y Modelos AtomicosIgnacio Nuñez FuentesAún no hay calificaciones
- ATOMODocumento2 páginasATOMOjkmedinamkAún no hay calificaciones
- Modelo de Carta Derecho CivilDocumento8 páginasModelo de Carta Derecho CivilWilliam castilloAún no hay calificaciones
- Arvizu Perez Aylin 5im7 Actividad 2 Estructura Atómica Cuadro SinopticoDocumento2 páginasArvizu Perez Aylin 5im7 Actividad 2 Estructura Atómica Cuadro SinopticoArvizú Pérez AylinAún no hay calificaciones
- 1 El AtomoDocumento3 páginas1 El AtomoMâytë TämbøAún no hay calificaciones
- Fusión NuclearDocumento30 páginasFusión NuclearTrapGameAún no hay calificaciones
- Modelos AtómicosDocumento5 páginasModelos AtómicosTrapGameAún no hay calificaciones
- El Átomo Sus Partes y Modelos AtomicosDocumento4 páginasEl Átomo Sus Partes y Modelos AtomicosAura Maria Cruz BernalAún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos Atomicosalansalas34erAún no hay calificaciones
- Modelos Atomicos 2Documento3 páginasModelos Atomicos 2Jhoe Henrriquez0% (1)
- Química 2 Tabla Periódica yDocumento5 páginasQuímica 2 Tabla Periódica yAngelAún no hay calificaciones
- Modelos Atomicos. Tp. Vidarte PatriciaDocumento11 páginasModelos Atomicos. Tp. Vidarte Patriciapatricia vidarteAún no hay calificaciones
- Mapa Conceptual Doodle A Mano MulticolorDocumento1 páginaMapa Conceptual Doodle A Mano MulticolorDamarys April Herrera MancoAún no hay calificaciones
- Modelos AtómicosDocumento15 páginasModelos AtómicosCarlosAún no hay calificaciones
- Química PREDocumento4 páginasQuímica PREVictor Huerta RojasAún no hay calificaciones
- Infografia Historia Del Modelo AtomicoDocumento1 páginaInfografia Historia Del Modelo AtomicoCatalina Almendra Palma PintoAún no hay calificaciones
- Plegable El AtomoDocumento2 páginasPlegable El AtomoJUAN JOSE MUÑOZAún no hay calificaciones
- U2 - S6 - Modelos AtomicosDocumento1 páginaU2 - S6 - Modelos AtomicoshadezffcapristanangeleldonesAún no hay calificaciones
- Taller Modelos AtomicosDocumento3 páginasTaller Modelos AtomicosAleja DiazAún no hay calificaciones
- Cuadro Comparativo de Los Modelos AtomicosDocumento1 páginaCuadro Comparativo de Los Modelos Atomicoslautarobre10Aún no hay calificaciones
- Aca 2 Pensamiento Matematico - CompressedDocumento35 páginasAca 2 Pensamiento Matematico - CompressedPedro José Ballesteros CerpaAún no hay calificaciones
- Aca Matematicas Ultima EntregaDocumento20 páginasAca Matematicas Ultima EntregaPedro José Ballesteros CerpaAún no hay calificaciones
- Acae 3Documento22 páginasAcae 3Pedro José Ballesteros CerpaAún no hay calificaciones
- Mapa Conceptual Explorar para InvestigarDocumento2 páginasMapa Conceptual Explorar para InvestigarPedro José Ballesteros CerpaAún no hay calificaciones
- Actividad FinalDocumento2 páginasActividad FinalPedro José Ballesteros CerpaAún no hay calificaciones
- Problemática Actividad 3 - Evidencia 2Documento3 páginasProblemática Actividad 3 - Evidencia 2Pedro José Ballesteros CerpaAún no hay calificaciones
- Proyecto FORTRANDocumento4 páginasProyecto FORTRANPedro José Ballesteros CerpaAún no hay calificaciones
- Actividad 3 Evidencia 1Documento4 páginasActividad 3 Evidencia 1Pedro José Ballesteros Cerpa100% (1)
- FULLCOMPUDocumento3 páginasFULLCOMPUPedro José Ballesteros CerpaAún no hay calificaciones
- Flujo Magnético y Ley de Gauss para El Campo MagnéticoDocumento5 páginasFlujo Magnético y Ley de Gauss para El Campo MagnéticoJulianAún no hay calificaciones
- Ensayo de Esfuerzo Cortante PDFDocumento15 páginasEnsayo de Esfuerzo Cortante PDFHibett Johana PinzónAún no hay calificaciones
- Media-Luna 1Documento4 páginasMedia-Luna 1Yoo YoooAún no hay calificaciones
- Taller de TiristoresDocumento5 páginasTaller de TiristoresEDWARD ALEXANDER ROMERO GUTIERREZAún no hay calificaciones
- LABORATORIO 5 (Entrega)Documento13 páginasLABORATORIO 5 (Entrega)Yesid RojasAún no hay calificaciones
- Entrenamiento de La Velocidad Charla SabadoDocumento15 páginasEntrenamiento de La Velocidad Charla SabadoManuelAntonioUlloaLuceroAún no hay calificaciones
- Pendulo SimpleDocumento16 páginasPendulo SimpleDavid Sompero MendozaAún no hay calificaciones
- DENIAR Introducción de Compresor Libre de Aceite Tipo Scroll DWW SerieDocumento15 páginasDENIAR Introducción de Compresor Libre de Aceite Tipo Scroll DWW SeriePablo Andres Espin MartinAún no hay calificaciones
- Tarea 2.1 - Carlos QuintalDocumento6 páginasTarea 2.1 - Carlos QuintalCarlos QuintalAún no hay calificaciones
- Examen Segundo Parcial 22lii13 Elecricidad y MagnetismoDocumento4 páginasExamen Segundo Parcial 22lii13 Elecricidad y MagnetismoSalvador RamirezAún no hay calificaciones
- Ecuacion de Kirchhoff (Termodinamica)Documento2 páginasEcuacion de Kirchhoff (Termodinamica)Victor Zuñiga Alegria67% (3)
- Clase 01 Vectores PDFDocumento5 páginasClase 01 Vectores PDFAnthony Ortega JiménezAún no hay calificaciones
- Sylabuss Transferencia de CalorDocumento12 páginasSylabuss Transferencia de CalorANTHONY FREIREAún no hay calificaciones
- Instrumentos CientíficosDocumento7 páginasInstrumentos CientíficosRJ ArkdesignAún no hay calificaciones
- José Alexander - Centurión Guzmán - Ingenieria de Sistemas - Reporte de Difusión Del SSU-VA - RSU VII - Central - GrupoDocumento14 páginasJosé Alexander - Centurión Guzmán - Ingenieria de Sistemas - Reporte de Difusión Del SSU-VA - RSU VII - Central - GrupoAlvaro Urbina EscobarAún no hay calificaciones
- TP4 - Iluminacion de Espacios Interiores y ExterioresDocumento18 páginasTP4 - Iluminacion de Espacios Interiores y ExterioresLaura NeimAún no hay calificaciones
- HUANCHACBAMBADocumento50 páginasHUANCHACBAMBAJASON GAMARRA DUEÑASAún no hay calificaciones
- Modelamiento e Interpretacion de Datos Magneticos y Gravimetricos en La Caracterizacion de Un Deposito PDFDocumento133 páginasModelamiento e Interpretacion de Datos Magneticos y Gravimetricos en La Caracterizacion de Un Deposito PDFJacquelin DiazAún no hay calificaciones
- Guía y Refuerzo A Flexión de Viga Con Fibras de CarbonoDocumento35 páginasGuía y Refuerzo A Flexión de Viga Con Fibras de CarbonoLUIS WILMER NUÑEZ ECHACCAYAAún no hay calificaciones
- Piston Modelo DSBG 250-400Documento21 páginasPiston Modelo DSBG 250-400H Luís DLAún no hay calificaciones
- TEMA 11 Angulos de Referencia y Coterminales 2014Documento26 páginasTEMA 11 Angulos de Referencia y Coterminales 2014J Pomales33% (3)
- 2do Secundaria-MatematicaDocumento5 páginas2do Secundaria-MatematicaLuis RimacheAún no hay calificaciones
- Datasheet SmartSolar Charge Controller MPPT 150 45 Up To 150 100 ESDocumento2 páginasDatasheet SmartSolar Charge Controller MPPT 150 45 Up To 150 100 ESjupalspy9870Aún no hay calificaciones
- Sesión 10. - Paneles Solares PDFDocumento48 páginasSesión 10. - Paneles Solares PDFJosue Manuel Garayar LopezAún no hay calificaciones
- Las 7 Principales Causas de Fallas en Subestaciones EléctricasDocumento5 páginasLas 7 Principales Causas de Fallas en Subestaciones EléctricasYulieth Paola Negrete GutierreAún no hay calificaciones
- Practica 1Documento12 páginasPractica 1Daniel Ramírez AleyAún no hay calificaciones