Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Actividad 1. Investigación de Modelos Atómicos
Cargado por
Tonantzin Ireri Castro ZavalaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Actividad 1. Investigación de Modelos Atómicos
Cargado por
Tonantzin Ireri Castro ZavalaCopyright:
Formatos disponibles
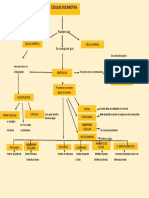
modelos atómicos
CASTRO ZAVALA TONANTZIN IRERI(22220739)
VARILLAS HERNÁNDEZ LEONARDO ADRIAN(22220824)
TAPIA VALENCIA FERNANDO(22220814)
DALTON
Es la primera teoría atómica con carácter científico fue propuesta por el
químico británico Dalton en 1808.
Los átomos de un mismo elemento son iguales en masa y en le resto de
propiedades.
Los átomos de distintos elementos tienen diferentes masas y propiedades
Los compuestos se forman por la unión de los átomos de los
correspondientes elementos según una relación numérica sencilla y
constante.
Toda materia esta constituida por atamos.
En una reacción química, los átomos se reacomodan para formar nuevos
compuestos.
THOMSON
-Demostró, en 1897, que en las descargas eléctricas en gases se producían
partículas con carga eléctrica negativa que eran idénticas para cualquier gas.
-Denominó a estas partículas electrones y concluyó que el electrón era un
constituyente fundamental de átomo.
.-Propuso un modelo de átomo formado por unas partículas con carga eléctrica
negativa (electrones),
-Partiendo del modelo de Thompson y la identificación de la partícula con carga
negativa llamada electrón, fue posible explicar posteriormente cómo se unen los
compuestos que hoy se conocen como enlaces.
RUTHERFORD
En 1911, a través del uso . Determino que el átomo
esta compuesto por un núcleo atómico de carga
positiva ( donde se concentra la mayor parte de su
masa) y los electrones, que giran libremente
alrededor de este núcleo.
BOHR
Estableció que el átomo esta formado por un núcleo, donde están los protones y
neutrones, y forman una corteza donde se encuentran los electrones.
- Los electrones solo se pueden mover en determinadas órbitas. En ellas, aunque
gire, el electrón no emite energía. En cada órbita el electrón tiene cierta energía
que es menor cuanto mas cerca esta del núcleo.
- Cuando el electrón pasa de una órbita a otra, absorbe o emite la energía que
observamos en los espectros atómicos.
SCHRÖDINGER:
Propuesto en 1926 por el físico E. Schrödinger a partir de los estudios de Bohr y
Sommerfeld, estableció el modelo mecano-cuántico del átomo. Establece que
los electrones se encuentran alrededor del Núcleo ocupando posiciones más o
menos probables, pero su posición no se puede predecir con exactitud.
Concebía los electrones como ondulaciones de la materia, lo cual permitió la
formulación posterior de una interpretación probabilística de la función de onda
(magnitud que sirve para describir la probabilidad de encontrar a una partícula
en el espacio)
MODELO ACTUAL:
En un elemento puede tener diversos isótopos, es decir,
átomos con el mismo número de protones y distintos de
neutrones, su masa atómica es la medida ponderada de
todos los isótopos, la cual depende de la abundancia relativa
de cada uno de ellos.
En este modelo se habla de órbitas, sino de orbitales las
cuales tienen distintas formas geométricas.
FUENTES:
Consellería de Cultura, Educación e Universidade |. (s. f.).
https://www.edu.xunta.gal/portal/
Modelos atómicos. (2016, 21 enero). Portal Académico del CCH.
https://e1.portalacademico.cch.unam.mx/alumno/quimica1/u2/
modelos_atomicos/modelosatomicos
Fernandes, A. Z. (2022, 14 septiembre). Todos los modelos
atómicos conocidos: cuántos y cuáles son. Toda Materia.
https://www.todamateria.com/modelos-atomicos/
También podría gustarte
- Mapa Conceptual Óxidos SalinosDocumento1 páginaMapa Conceptual Óxidos SalinosLynBC50% (2)
- Enlace CovalenteDocumento12 páginasEnlace CovalenteAlejandra Tito100% (1)
- Composición Quimica de Los Seres VivosDocumento1 páginaComposición Quimica de Los Seres VivosKiawita Dul100% (1)
- Evolución Del AtomoDocumento1 páginaEvolución Del Atomosofia cortez100% (1)
- Uso Doméstico e Industrial Del PropanoDocumento10 páginasUso Doméstico e Industrial Del PropanoPELIS EJRO100% (1)
- Biomoleculas InorganicasDocumento1 páginaBiomoleculas InorganicasJelen CanchomoniAún no hay calificaciones
- Biomoleculas InorganicasDocumento6 páginasBiomoleculas InorganicasMercedes PpccAún no hay calificaciones
- Oxidos BasicosDocumento1 páginaOxidos Basicosadonay100% (1)
- Ácidos HidrácidosDocumento14 páginasÁcidos HidrácidosJhon Alexander Marquez RuizAún no hay calificaciones
- Historia de La Tabla Periódica para Primer Grado de SecundariaDocumento2 páginasHistoria de La Tabla Periódica para Primer Grado de SecundariaMiriita Ale100% (1)
- AlotroposDocumento2 páginasAlotroposJuan HuaiquilAún no hay calificaciones
- Ejercicios de QuímicaDocumento2 páginasEjercicios de QuímicaDaniel Reyes Velarde0% (1)
- Mapa MentalDocumento1 páginaMapa MentalAbril AranaAún no hay calificaciones
- CLASE 5 - F. HIDRUROS y ÁCIDOSDocumento39 páginasCLASE 5 - F. HIDRUROS y ÁCIDOSMilagros RabanalAún no hay calificaciones
- Mapa Conceptual.....Documento1 páginaMapa Conceptual.....Alvaro Sepulveda Marquez0% (1)
- Lectura No 08 - La Nutricion Dentro Del Area de Educacion FisicaDocumento8 páginasLectura No 08 - La Nutricion Dentro Del Area de Educacion FisicaJluis Vilca ChuquipomaAún no hay calificaciones
- Examen Tanteo 10 2018Documento3 páginasExamen Tanteo 10 2018yaeris camargo100% (1)
- Leyes Ponderales Ejercicios Recopilados Resueltos 2016Documento17 páginasLeyes Ponderales Ejercicios Recopilados Resueltos 2016VictorEPazMaiz0% (1)
- Higiene y Enfermedades Del Sistema DigestivoDocumento3 páginasHigiene y Enfermedades Del Sistema DigestivoAfranio Falcones100% (1)
- Modelo AtomicoDocumento1 páginaModelo AtomicoFacundo TrocheAún no hay calificaciones
- Mapa Conceptual Celula EucariotaDocumento1 páginaMapa Conceptual Celula EucariotaAle 707100% (1)
- Nomenclatura InorgánicaDocumento11 páginasNomenclatura Inorgánicanancy pittiAún no hay calificaciones
- Consulta - Estructura de Lewis - Ley Del Octeto - Metales y No Metales - ValenciaDocumento16 páginasConsulta - Estructura de Lewis - Ley Del Octeto - Metales y No Metales - ValenciaDayann Smith Anteliz RebolledoAún no hay calificaciones
- Los-Recursos-Naturales - Primer-Grado-de-SecundariaDocumento6 páginasLos-Recursos-Naturales - Primer-Grado-de-SecundariaCHIMENG LION AREVALOAún no hay calificaciones
- Ácidos Carboxílicos Éteres y Ésteres para Quinto Grado de SecundariaDocumento5 páginasÁcidos Carboxílicos Éteres y Ésteres para Quinto Grado de Secundariajcso161420Aún no hay calificaciones
- Guía PSU Propiedades PeriódicasDocumento12 páginasGuía PSU Propiedades PeriódicasodipzaAún no hay calificaciones
- FICHA Características de Los Seres VivosDocumento8 páginasFICHA Características de Los Seres VivosAnais TorresAún no hay calificaciones
- PROTEÍNASDocumento2 páginasPROTEÍNASZOILA EUFEMIA CHOC COYAún no hay calificaciones
- Ficha Geometría MolecularDocumento2 páginasFicha Geometría MolecularMario MartinAún no hay calificaciones
- Mapa Conceptual HongosDocumento1 páginaMapa Conceptual HongosSamantha Saint-Hilaire100% (1)
- Adaptaciones de Los AnimalesDocumento5 páginasAdaptaciones de Los AnimalesMauricio Nicolas Campos Salvo100% (1)
- 2022 Cyt ExamenDocumento3 páginas2022 Cyt ExamenFlor Calderón100% (1)
- Mente FactoDocumento1 páginaMente FactoTatita Rojas100% (1)
- Semana 10 IsomeriaDocumento45 páginasSemana 10 Isomeriaangel gálvez gaona100% (1)
- Tarea 1. Organizador Gráfico Sobre La Importancia de La Química InorgánicaDocumento2 páginasTarea 1. Organizador Gráfico Sobre La Importancia de La Química InorgánicaIvana Utreras0% (1)
- Cuadro Compartivo de Quimica de 4toDocumento2 páginasCuadro Compartivo de Quimica de 4tomairamarquinaAún no hay calificaciones
- 03-F.o. Función ÁcidosDocumento23 páginas03-F.o. Función ÁcidosLenin Efio SosaAún no hay calificaciones
- C H o N P SDocumento3 páginasC H o N P SHardBoyAún no hay calificaciones
- TEMA 1 - ENLACES - QUIMICOS - PPTDocumento46 páginasTEMA 1 - ENLACES - QUIMICOS - PPTBRIYITH ESTEFANY LOAIZA HUAMANAún no hay calificaciones
- CicloalquenosDocumento53 páginasCicloalquenosIsaias UrbinaAún no hay calificaciones
- Iones Cationes y Aniones para Sexto de PrimariaDocumento3 páginasIones Cationes y Aniones para Sexto de Primariaibeth rengifoAún no hay calificaciones
- Mapa Mental NitrogenadasDocumento1 páginaMapa Mental NitrogenadasEduardo Sanchez Aquino100% (3)
- Los Electrolitos - LoayzadocxDocumento2 páginasLos Electrolitos - LoayzadocxJoshep Leonardo Santiago RamirezAún no hay calificaciones
- CianobacteriasDocumento1 páginaCianobacteriasAleita Valdez Rodriguez0% (1)
- Lectura Los Gases Nobles Unos Àtomos Muy SolitariosDocumento2 páginasLectura Los Gases Nobles Unos Àtomos Muy SolitariosFreyneth Jaimes100% (1)
- Practica Calificada de Alquenos y AlquinosDocumento2 páginasPractica Calificada de Alquenos y AlquinosManfredy Cortez MantillaAún no hay calificaciones
- Marco Teorico Reaciones QuimicasDocumento5 páginasMarco Teorico Reaciones QuimicasJuliTo Thomas RamirezAún no hay calificaciones
- Hidrocarburos Clásicos y Aromáticos para Cuarto Grado de SecundariaDocumento6 páginasHidrocarburos Clásicos y Aromáticos para Cuarto Grado de Secundariajcso161420100% (1)
- Acidos HidracidosDocumento2 páginasAcidos HidracidosFabian Said Apaza Luna100% (1)
- Taller Teorias AtomicasDocumento2 páginasTaller Teorias AtomicasMichel MorenoAún no hay calificaciones
- Origen y Evolución de Los CocodrilosDocumento22 páginasOrigen y Evolución de Los CocodrilosJulissa O Castillo0% (1)
- Historia Del Descubrimiento de La CelulaDocumento18 páginasHistoria Del Descubrimiento de La CelulaJose Fernando Linares DiazAún no hay calificaciones
- LineaDeTiempo de Modelos AtomicosDocumento2 páginasLineaDeTiempo de Modelos AtomicosMario NoleAún no hay calificaciones
- Atividad - Modelos AtómicosDocumento2 páginasAtividad - Modelos AtómicosGab BrielAún no hay calificaciones
- Atomos y Modelos AtomicosDocumento4 páginasAtomos y Modelos AtomicosIgnacio Nuñez FuentesAún no hay calificaciones
- Actividad 03 U1 Cuadro Comparativo - Gustavo Rubio RafaelDocumento3 páginasActividad 03 U1 Cuadro Comparativo - Gustavo Rubio RafaelGustavo RubioAún no hay calificaciones
- Tarea 6 QUIMICADocumento6 páginasTarea 6 QUIMICAAnita Morales100% (1)
- 2 AtomosDocumento69 páginas2 AtomosErick MegoAún no hay calificaciones
- Cuadro Comparativo Modelos Atomicos.Documento3 páginasCuadro Comparativo Modelos Atomicos.Andres CanoAún no hay calificaciones
- Cuadro Comparativo, Ortiz Rondón Rogger Joaquín, C.I 28.650.780, Sección 01Documento3 páginasCuadro Comparativo, Ortiz Rondón Rogger Joaquín, C.I 28.650.780, Sección 01Rogger Rjor100% (1)
- CURSO PRF Valderrama - Protecciones de Sistemas de Distribución Mayo 2006Documento224 páginasCURSO PRF Valderrama - Protecciones de Sistemas de Distribución Mayo 2006joelAún no hay calificaciones
- Cuántica Sin FórmulasDocumento158 páginasCuántica Sin FórmulasLuis50% (2)
- Taller 5Documento1 páginaTaller 5Entretuymilmares AragonAún no hay calificaciones
- Aprendiendo Sobre Potencial y Energía Eléctrica Eje 2Documento7 páginasAprendiendo Sobre Potencial y Energía Eléctrica Eje 2EFREN LESMES GAITA0% (1)
- Guía Del Ejercicios de Física II LapsoDocumento8 páginasGuía Del Ejercicios de Física II LapsoJose SuarezAún no hay calificaciones
- Ley de FaradayDocumento2 páginasLey de FaradayMariana Isabel Sarabia NavaAún no hay calificaciones
- Bloque FotogramétricoDocumento6 páginasBloque FotogramétricoCristian TacuriAún no hay calificaciones
- RÚBRICA ANALÍTICA DE DESEMPEÑO-2medioDocumento3 páginasRÚBRICA ANALÍTICA DE DESEMPEÑO-2medioRAÚL RAMÍREZ100% (1)
- VRC18Documento2 páginasVRC18TomásEduardoLizanaJeriaAún no hay calificaciones
- Taller Tabla PeriodicaDocumento2 páginasTaller Tabla PeriodicaClaudio OrdonezAún no hay calificaciones
- PROBLEMA 1 Resistencia de Materiales (Torsión)Documento6 páginasPROBLEMA 1 Resistencia de Materiales (Torsión)Miguel Antonio Bula PicónAún no hay calificaciones
- NTC1570 Cinturones de Seguridad - UnlockedDocumento64 páginasNTC1570 Cinturones de Seguridad - UnlockedLORENA ALVARADO100% (1)
- Manual Testo 435 Instrumento de Medicion MultifuncionDocumento28 páginasManual Testo 435 Instrumento de Medicion MultifuncionRaul Alexander Uribe Garcia0% (1)
- Formulas de Derivacion Y Formulas de DiferenciacionDocumento4 páginasFormulas de Derivacion Y Formulas de Diferenciacionnestor_ns_mjhotmailc0% (1)
- Apuntes Mecánica.Documento69 páginasApuntes Mecánica.Juan Carlos Sánchez EspañaAún no hay calificaciones
- El Tractor y Sus PrestacionesDocumento14 páginasEl Tractor y Sus PrestacionesGerman ColmenaresAún no hay calificaciones
- Criterios para La Elaboracion de CroquisDocumento16 páginasCriterios para La Elaboracion de CroquisJenniffer Victoria Del Rio Castro0% (2)
- Ejercicios Parametros Antenas Ago 14Documento9 páginasEjercicios Parametros Antenas Ago 14Diego Difamar ClaymarAún no hay calificaciones
- Análisis Matemático C PDFDocumento1 páginaAnálisis Matemático C PDFgustavorauliAún no hay calificaciones
- Diplomado Sobre Las Flatulencias PEDOS - PpsDocumento22 páginasDiplomado Sobre Las Flatulencias PEDOS - PpsJuan Manuel GarciaAún no hay calificaciones
- SERIGRAFÍADocumento15 páginasSERIGRAFÍAKevin HollandAún no hay calificaciones
- R. 1 Propiedades Mecánicas de La MateriaDocumento8 páginasR. 1 Propiedades Mecánicas de La MateriaGeraldine GirónAún no hay calificaciones
- El Diagrama Hierro CarbonoDocumento4 páginasEl Diagrama Hierro CarbonoVlady100% (1)
- La Parabola 2013 1Documento9 páginasLa Parabola 2013 1AnthOny RodriguezAún no hay calificaciones
- Rodamientos y Seguidores de Leva PDFDocumento128 páginasRodamientos y Seguidores de Leva PDFFabian LopezAún no hay calificaciones
- Tarea 2 - UNIDAD Aplicación 2 Ley de Newton-fricción-mcu-ToRSORDocumento5 páginasTarea 2 - UNIDAD Aplicación 2 Ley de Newton-fricción-mcu-ToRSORVictor Hernandez33% (3)
- Proyecto de TituloDocumento9 páginasProyecto de Titulosf1553Aún no hay calificaciones
- Informe de RetortaDocumento18 páginasInforme de Retortaalfredo moranAún no hay calificaciones
- Transformada de La PlasDocumento8 páginasTransformada de La PlasramiroAún no hay calificaciones
- Daño A La FormaciónDocumento6 páginasDaño A La Formaciónjuan emiliano castillo quinterosAún no hay calificaciones
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (201)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Manual técnico para la interpretación de análisis de suelos y fertilización de cultivosDe EverandManual técnico para la interpretación de análisis de suelos y fertilización de cultivosCalificación: 4 de 5 estrellas4/5 (1)
- El concepto Mulligan de terapia manual (Color)De EverandEl concepto Mulligan de terapia manual (Color)Calificación: 5 de 5 estrellas5/5 (3)
- La causa raiz de los accidentes: Historias de accidentes en la industriaDe EverandLa causa raiz de los accidentes: Historias de accidentes en la industriaCalificación: 5 de 5 estrellas5/5 (1)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Proyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadDe EverandProyectos Arduino con Tinkercad: Diseño y programación de proyectos electrónicos basados en Arduino con TinkercadCalificación: 5 de 5 estrellas5/5 (1)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Guía de cálculo y diseño de conductos para ventilación y climatizaciónDe EverandGuía de cálculo y diseño de conductos para ventilación y climatizaciónCalificación: 5 de 5 estrellas5/5 (1)
- Cardiología y enfermedades cardiovascularesDe EverandCardiología y enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)