Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Blue Professional Extensive Mind Map Graph
Cargado por
horoaxerrobloxDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Blue Professional Extensive Mind Map Graph
Cargado por
horoaxerrobloxCopyright:
Formatos disponibles
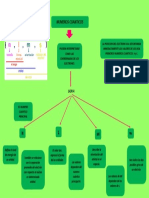
MIND
MAP
Establece que la distribución de
electrones se realiza de menor
energía a mayor energía
relativa de los orbitales.
Se emplea para la distribución de electrones en
·Un orbital es más estable,
niveles y subniveles. El diagrama de Moller, indica
cuando ER es la más baja
EN ESTE SE PRINCIPIO REGLA DE MOLLER el orden creciente de llenado de los subniveles y
posible.
·Cuando dos orbitales DE AUFBAU O DEL SERRUCHO niveles de energía de un átomo de arriba hacia
SUS PRINCIPIOS SON:
abajo, y siguiendo el sentido de las flechas.
tienen el mismo valor de ER,
SUS REG LAS SON :
la más estable es aquella
que tiene el valor más bajo
de n. CONFIGURACION
ELECTRONICA
PRINCIPIO DE REGLA DE HUD O
Dos electrones en un átomo no pueden EN ESTE
tener los cuatro números cuánticos EXCLUSION DE SE EMPLEA PARA HALLAR: DE MAXIMA
iguales. Es decir que en un orbital, solo PAULI MULTIPLICIDAD Los electrones deben
puede existir, como máximo hasta dos ocupar todos los orbitales
electrones con sus espines opuestos o de un subnivel dado en
apareados forma individual antes de
ELEMENTOS GRUPO O
que se inicie el
REPRESENTATIVOS FAMILIA PERIODO N° ATOMICO DEL apareamiento
ELEMENTO
TRANSICION
ELEMENTOS
DE
El número de período indica
Para hallar el numero
el número de niveles de
Su configuración electrónica atomico, se necesita sumar
energía que tiene el
termina en "ns" o "np" todos los subniveles,
·Lo forman los elementos de transición cuya elemento
·El número de grupo indica ejemplo: He 1S2
configuración termina en "(n-1)d" y los de
la cantidad de electrones El 2 seria su numero atomico
transición interna que termina en "(n-2)f" y
en el último nivel de energía
se encuentran ubicados en la parte inferior
o capa de valencia. Están de la T.P.
situados en los extremos de
la T.P.
También podría gustarte
- Mapa Mental Configuración ElctrónicaDocumento1 páginaMapa Mental Configuración ElctrónicaKonejo Wingartz38% (26)
- Organizador Grafico - QuimicaDocumento1 páginaOrganizador Grafico - QuimicaJesus alberto Perez mendezAún no hay calificaciones
- InglésDocumento1 páginaInglésramosfer739Aún no hay calificaciones
- CEPASPRIMAVERA05Documento5 páginasCEPASPRIMAVERA05Julio BernalesAún no hay calificaciones
- 3B. Estructura ElectrónicaDocumento12 páginas3B. Estructura ElectrónicaÍtalo LuizAún no hay calificaciones
- Quimica I 1° Iib 2018Documento11 páginasQuimica I 1° Iib 2018aldoAún no hay calificaciones
- Configuración ElectrónicaDocumento28 páginasConfiguración ElectrónicaWILLIAM ALVA LÓPEZAún no hay calificaciones
- Configuracion ElectronicaDocumento2 páginasConfiguracion ElectronicaGABRIEL GARCIA MARQUEZAún no hay calificaciones
- Configuracion Electronica Mayo 2021 3ro Ees N°9Documento24 páginasConfiguracion Electronica Mayo 2021 3ro Ees N°9Sofi FlorentínAún no hay calificaciones
- Trabajo de QuímicaDocumento5 páginasTrabajo de Químicaangeleri.26.07.06Aún no hay calificaciones
- Cómo Se Escribe La Configuración Electrónica?Documento2 páginasCómo Se Escribe La Configuración Electrónica?Benicio LemosAún no hay calificaciones
- Quimica 01b ESTRUCTURA ATOMICA (Complemento)Documento2 páginasQuimica 01b ESTRUCTURA ATOMICA (Complemento)Dreyer Tocto MolinaAún no hay calificaciones
- Clase Zoom Configuracion ElectronicaDocumento12 páginasClase Zoom Configuracion Electronicadiana patriciaAún no hay calificaciones
- Numeros CuanticosDocumento1 páginaNumeros CuanticosAngela PSAún no hay calificaciones
- Configuración ElectrónicaDocumento9 páginasConfiguración ElectrónicaCamila BotiaAún no hay calificaciones
- Configuración ElectrónicaDocumento47 páginasConfiguración ElectrónicaJairo Palacios ChangaAún no hay calificaciones
- Átomo. Configuración ElectrónicaDocumento20 páginasÁtomo. Configuración Electrónicaleshem_1526Aún no hay calificaciones
- Química 1.2 IpnDocumento42 páginasQuímica 1.2 IpnAlejandra García SotoAún no hay calificaciones
- Configuracion ElectronicaDocumento20 páginasConfiguracion ElectronicaPaul CR100% (1)
- Mapa Conceptual Configuracion ElectronicaDocumento1 páginaMapa Conceptual Configuracion Electronicaramosfer739Aún no hay calificaciones
- Tarea #1 Resumen de La Unidad 1 Martinez Velasco IsaacDocumento5 páginasTarea #1 Resumen de La Unidad 1 Martinez Velasco IsaacIsaac Martínez VelascoAún no hay calificaciones
- Tarea 1Documento5 páginasTarea 1Alex Ronaldo QuijiaAún no hay calificaciones
- Clase 1 Propiedades PeriódicasDocumento44 páginasClase 1 Propiedades PeriódicasEsmeralda VenegasAún no hay calificaciones
- Asm Qu1 TS005Documento18 páginasAsm Qu1 TS005Miguel Angel Parrilla ApazaAún no hay calificaciones
- Números CuánticosDocumento15 páginasNúmeros Cuánticosteranhfelix20Aún no hay calificaciones
- Exposicion RadiologiaDocumento52 páginasExposicion RadiologiaMarcela Mishel Maldonado GuerreroAún no hay calificaciones
- 3-Q-2do Sec-Configuración Electrónica IDocumento27 páginas3-Q-2do Sec-Configuración Electrónica IOrlando CutipaAún no hay calificaciones
- Estructura Atomica Clase 3ADocumento6 páginasEstructura Atomica Clase 3AAdrian Ventura CernaAún no hay calificaciones
- Repaso Numero II Cepre IIIDocumento4 páginasRepaso Numero II Cepre IIICN KramAún no hay calificaciones
- Material Configuracion Electronica Numeros CuanticosDocumento4 páginasMaterial Configuracion Electronica Numeros CuanticosBrayam J V. CanalesAún no hay calificaciones
- Q Sem2Documento7 páginasQ Sem2Nils Quiña PomaAún no hay calificaciones
- 9 Tema Nube ElectronicaDocumento46 páginas9 Tema Nube ElectronicaJYOSEF GAVILAN HUAMANAún no hay calificaciones
- Configuracion ElectronicaDocumento2 páginasConfiguracion ElectronicaTonalli GaonaAún no hay calificaciones
- Practica 5 Numeros Cuanticos Cepuns 2017 IIIDocumento5 páginasPractica 5 Numeros Cuanticos Cepuns 2017 IIIVictorAlejandroAscurraValleAún no hay calificaciones
- 4 Zona ExtranuclearDocumento22 páginas4 Zona Extranuclearhdíaz_489491Aún no hay calificaciones
- Separata Guía - S1 - QUI - SEM3 - VU 2022Documento3 páginasSeparata Guía - S1 - QUI - SEM3 - VU 2022José FerreyraAún no hay calificaciones
- TALLER DE REPASO (Biología Molecular)Documento7 páginasTALLER DE REPASO (Biología Molecular)Franky Santiago Rodriguez BermudezAún no hay calificaciones
- Grupo EliteDocumento26 páginasGrupo ElitecuentarandomparaotrascosasAún no hay calificaciones
- 6 CtaDocumento6 páginas6 CtaAngie Gabriela Sosa MejiaAún no hay calificaciones
- Manual 22Documento28 páginasManual 22coficab juarezAún no hay calificaciones
- Configuración ElectrónicaDocumento16 páginasConfiguración ElectrónicaMiguel ivan MolinaAún no hay calificaciones
- Configuración Electrónica y LEWISDocumento6 páginasConfiguración Electrónica y LEWISAlburezAún no hay calificaciones
- Numeros CuanticosDocumento7 páginasNumeros CuanticosPluton79Aún no hay calificaciones
- Filemd8109-2024-01-06 13-49-42Documento34 páginasFilemd8109-2024-01-06 13-49-42GretelAún no hay calificaciones
- Guía Conf ElectrónicaDocumento3 páginasGuía Conf ElectrónicaLeo LoyolaAún no hay calificaciones
- Clase5 PDDocumento25 páginasClase5 PDMateo LópezAún no hay calificaciones
- Modelos Atomicos y Numeros CuanticosDocumento1 páginaModelos Atomicos y Numeros CuanticosXavier RodríguezAún no hay calificaciones
- Clase 01Documento7 páginasClase 01Mares RomeroAún no hay calificaciones
- Unidad 1. Aplicaciones Del Modelo Átomico (Autoguardado) (Autoguardado)Documento24 páginasUnidad 1. Aplicaciones Del Modelo Átomico (Autoguardado) (Autoguardado)Mtra Sofy ChaconAún no hay calificaciones
- V de GowinDocumento1 páginaV de GowinyadiraAún no hay calificaciones
- Estados Cuanticos de La MateriaDocumento22 páginasEstados Cuanticos de La MateriaJorge GarciaAún no hay calificaciones
- Texto Didactizado de Configuración ElectrónicaDocumento7 páginasTexto Didactizado de Configuración ElectrónicaMarizol SajamaAún no hay calificaciones
- Configuración Electrónica Grado 7 A 11 Juan Andrés Carranza López ?Documento6 páginasConfiguración Electrónica Grado 7 A 11 Juan Andrés Carranza López ?JUAN ANDRES CARRANZA LOPEZAún no hay calificaciones
- Mapa Mental Propiedades PeriodicasDocumento1 páginaMapa Mental Propiedades PeriodicasGabriel García BautistaAún no hay calificaciones
- Act 2 Eda 2 CytDocumento6 páginasAct 2 Eda 2 CytRuth Morales PecerosAún no hay calificaciones
- Estructura AtómicaDocumento107 páginasEstructura AtómicaYimi RiuzAún no hay calificaciones
- Configuracion ElectronicaDocumento21 páginasConfiguracion ElectronicaPaty JamaicaAún no hay calificaciones
- Flores - Yadira Milagro - Mapa Conceptual - IPDocumento1 páginaFlores - Yadira Milagro - Mapa Conceptual - IPMilagro FloresAún no hay calificaciones
- AcidosDocumento2 páginasAcidosAlejandro Espinoza Orellan100% (1)
- Guia Inge OxiDocumento36 páginasGuia Inge OxiJAVQ100% (1)
- EcDiseño-OPU 2dopDocumento2 páginasEcDiseño-OPU 2dopJesus Eduardo Muñoz IsidoroAún no hay calificaciones
- Guía Instal Calefacción&Agua CalienteDocumento60 páginasGuía Instal Calefacción&Agua CalienteLuis RelajateAún no hay calificaciones
- Imforme 6Documento7 páginasImforme 6Richard R Rufran Choque MamaniAún no hay calificaciones
- Exposicion de Ciencias Leccion 1 Modulo 3Documento13 páginasExposicion de Ciencias Leccion 1 Modulo 3Moises CarrilloAún no hay calificaciones
- Resumen 3.1Documento2 páginasResumen 3.1Henry Valda ZuñigaAún no hay calificaciones
- Manual de Mantenimiento - LRDocumento8 páginasManual de Mantenimiento - LRLina VargasAún no hay calificaciones
- Exposición Sonda LambdaDocumento17 páginasExposición Sonda LambdaAlfonso Barrantes100% (1)
- Ficha Actividad #3 - 3º Cts - I Bimestre - Cambio ClimaticoDocumento7 páginasFicha Actividad #3 - 3º Cts - I Bimestre - Cambio ClimaticoMichael Puma CentenoAún no hay calificaciones
- Ficha Tecnica Neoxol C 30a 260117Documento1 páginaFicha Tecnica Neoxol C 30a 260117Soraya AvendañoAún no hay calificaciones
- Informe N°4. Descenso Crioscópico - Lab. FisicoquimicaDocumento5 páginasInforme N°4. Descenso Crioscópico - Lab. FisicoquimicaJOSELIN BELTRÁN PÉREZAún no hay calificaciones
- Acerosduplex PDFDocumento6 páginasAcerosduplex PDFAlejandro TolosaAún no hay calificaciones
- Reseña Histórica de Los Rayos XDocumento3 páginasReseña Histórica de Los Rayos XXrysw CabreraAún no hay calificaciones
- 8505-W1-Procedimientos de Soldadura Smaw Electrodos Revestidos E-7018 y E8018 PDFDocumento2 páginas8505-W1-Procedimientos de Soldadura Smaw Electrodos Revestidos E-7018 y E8018 PDFMarvin Guerrero PadillaAún no hay calificaciones
- Carga Electrica Informe 1Documento9 páginasCarga Electrica Informe 1Alberth ZambranoAún no hay calificaciones
- Presentacion Del Benceno.Documento5 páginasPresentacion Del Benceno.Juan GabrielAún no hay calificaciones
- Propiedades Físicas y Comportamiento Del SueloDocumento42 páginasPropiedades Físicas y Comportamiento Del SueloAlexis Julián ZuritaAún no hay calificaciones
- Precios Unitarios 4+400 16 de Abril Del 2012Documento24 páginasPrecios Unitarios 4+400 16 de Abril Del 2012Juan CooperAún no hay calificaciones
- Materiales AglutinantesDocumento9 páginasMateriales AglutinantesJose Antonio DenosAún no hay calificaciones
- La Subrasante PDFDocumento6 páginasLa Subrasante PDFmaria fernanda peñaranda suarezAún no hay calificaciones
- Informe 1 InstrumentalDocumento4 páginasInforme 1 InstrumentalWilliam BuzzoAún no hay calificaciones
- PRACTICA 1. Extracción de Cafeína de Café o TéDocumento5 páginasPRACTICA 1. Extracción de Cafeína de Café o TéYeimy Andrea Ocampo GilAún no hay calificaciones
- PRESUPUESTODocumento4 páginasPRESUPUESTOAngelyn JulcaAún no hay calificaciones
- Revisión Guía Combate y Prevención de Incendios 4Documento5 páginasRevisión Guía Combate y Prevención de Incendios 4pabloAún no hay calificaciones
- EL SuperadobeDocumento19 páginasEL SuperadobeJOSELYN LIZBETH TAPIA CEVALLOSAún no hay calificaciones
- Espontaneidad y Energia Libre de GibbsDocumento9 páginasEspontaneidad y Energia Libre de GibbsIvancito Paul Martinez CondoriAún no hay calificaciones
- Contreras Rodriguez MluisaDocumento465 páginasContreras Rodriguez MluisaJosé Luis Avila QuinteroAún no hay calificaciones
- Informe Visita San MarcosDocumento11 páginasInforme Visita San MarcosAna Maria Parra Blandon0% (1)
- 1 - Fundamentos Del Tratamiento PTARDocumento17 páginas1 - Fundamentos Del Tratamiento PTARDenisse Gabriela Berrospi Alvarado100% (1)