Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Linea de Tiempo-Yurisell Nieto-LicFísica-QuímicaGeneralA
Cargado por
Yurisell NietoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Linea de Tiempo-Yurisell Nieto-LicFísica-QuímicaGeneralA
Cargado por
Yurisell NietoCopyright:
Formatos disponibles
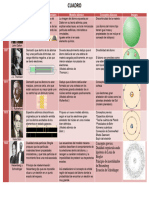
Química General (A) – Licenciatura en Física
Estudiante: Yurisell Nieto
Línea de tiempo
Estructura del modelo atómico
1803
Modelo de Dalton – Jhon Dalton
Este modelo presenta al átomo como la partícula más
pequeña e indivisible de la materia. Propuso que los
átomos eran los bloques de construcción básicos de la
materia y los representaba como esferas sólidas. 1902
Modelo cubico - Gilbert N. Lewis
Se basa en la regla de Abegg. Fue desarrollada
posteriormente por Irving Langmuir en 1919. En este
modelo los electrones del átomo estaban situados en
los ocho vértices de un cubo.
1903
Modelo Saturnino - Hantaro Nagaoka
Para el japones el sistema de partículas era similar al de
Saturno. Un gran número de partículas de igual masa
dispuestos en círculos que se repelen entre sí; Y una masa
central cargada positivamente que atrae a las otras
partículas negativos formando anillos.
1904
Modelo pudin de pasas - Joseph Jhon Thomson
Propuso que la mayor parte de la masa del átomo era la
carga positiva. Thomson imaginó el átomo como una
especie de esfera positiva continúa en la que se encuentran
incrustados los electrones, más o menos como las uvas
pasas en un pudin.
1907
Jean Perrín – Sistema planetario
Sugirió la carga positiva estaba concentrada en el centro
del átomo y que las cargas negativas son externas a
dicho núcleo.
1911
Modelo de Rutherford - Ernest Rutherford
Sus proposiciones nos dicen que: La mayor parte de la masa
atómica se concentra en el núcleo y dotada de carga positiva;
Alrededor del núcleo y a grandes distancias están
los electrones, de carga negativa, orbitando en trayectorias
circulares; y, la suma de las cargas eléctricas positivas y
negativas de un átomo debería dar cero como resultado.
1913
Modelo de Bohr – Niels Bohr
Dedujo que los electrones de la corteza giran alrededor del
núcleo describiendo sólo determinadas órbitas circulares. En
el átomo, los electrones se organizan en capas y, en cada capa
tendrán una cierta energía, llenando siempre las capas
inferiores y después las superiores.
1916
Modelo de Sommerfeld – Arnold Sommerfeld
Postula que: Dentro de un mismo nivel energético (n)
existen subniveles diferentes. También, nos dice que: No
solo existen órbitas circulares sino también órbitas
elípticas determinadas por el número cuántico
azimutal (l) que toma valores desde 0 a n-1.
1926
Modelo cuántico ondulatorio - Erwin Schrödinger
Se postula que los electrones se contemplaban
originalmente como una onda estacionaria de materia
cuya amplitud decaía rápidamente al sobrepasar el radio
atómico. Entonces, la ecuación de esta describe la
evolución en el tiempo y en el espacio de esta onda
material.
Actual
Modelo Mecano Cuántico - Heisenberg y Schrödinger
Se piensa en los electrones como ondas de materia
probabilística utilizando la longitud de onda de De Broglie,
la ecuación de Schrödinger y el principio de incertidumbre
de Heisenberg. Estudiamos el espín del electrón y el
experimento de Stern-Gerlach. La idea está determinada
por encontrar en dónde podría estar el electrón dentro del
átomo. Para esto ellos propusieron que existen orbitales y
no órbitas.
También podría gustarte
- Cuadro Comparativo de Los Modelos AtomicosDocumento1 páginaCuadro Comparativo de Los Modelos Atomicoslautarobre10Aún no hay calificaciones
- Tarea Evidencias de Estructura AtómicaDocumento5 páginasTarea Evidencias de Estructura Atómicaalanntorres09ctrlAún no hay calificaciones
- Historia Del AtomoDocumento15 páginasHistoria Del Atomoisaac luna cañete100% (1)
- Modelos Atomicos Mas ImportantesDocumento10 páginasModelos Atomicos Mas ImportantesMariaElizabeth14Aún no hay calificaciones
- Línea de TiempoDocumento5 páginasLínea de TiempoValery CardenasAún no hay calificaciones
- Modelos Del AtomoDocumento2 páginasModelos Del Atomocamiv14ygAún no hay calificaciones
- Teoria AtomicaDocumento3 páginasTeoria AtomicaNeheyler MecatrónicoAún no hay calificaciones
- 4Documento6 páginas4perladz12Aún no hay calificaciones
- Línea de Tiempo: Modelos AtómicosDocumento1 páginaLínea de Tiempo: Modelos AtómicosMisael Ruiz Gutiérrez100% (2)
- El ÁtomoDocumento15 páginasEl ÁtomoCONSTANZA OSSAAún no hay calificaciones
- Modelo de Esfera SolidaDocumento4 páginasModelo de Esfera Solidaamezcuasantiago2006Aún no hay calificaciones
- Modelos Atomicos 2Documento3 páginasModelos Atomicos 2Jhoe Henrriquez0% (1)
- Modelos AtomicosDocumento14 páginasModelos Atomicosyahir cantoAún no hay calificaciones
- Trabajo Modelos Atómicos Grupo 3Documento3 páginasTrabajo Modelos Atómicos Grupo 3Lorenzo Es SaAún no hay calificaciones
- Modelos AtomicosDocumento2 páginasModelos AtomicosDuyujoju Gor Agu86% (29)
- Química PREDocumento4 páginasQuímica PREVictor Huerta RojasAún no hay calificaciones
- Teoria AtomicaDocumento8 páginasTeoria AtomicaMisael diaz diaz100% (1)
- Modelos AtómicosDocumento10 páginasModelos AtómicosCristian BravoAún no hay calificaciones
- Quimica - 4 ToDocumento5 páginasQuimica - 4 ToVictor Huerta RojasAún no hay calificaciones
- Modelo AtomicoDocumento2 páginasModelo AtomicoToy Mangle FazversAún no hay calificaciones
- NIVELACIÓN FORMATIVA 2 - 2do. CURSODocumento4 páginasNIVELACIÓN FORMATIVA 2 - 2do. CURSOVanessa CBAún no hay calificaciones
- ModelosDocumento3 páginasModelosricky hernandezAún no hay calificaciones
- Solucion QuimicaDocumento4 páginasSolucion Quimicadaniel giron0% (1)
- Modelos AtomicosDocumento5 páginasModelos AtomicosALDO SAMUEL ANGULO SANCHEZAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosSamanta Trejo SalcedoAún no hay calificaciones
- Bohr SommerfeldDocumento10 páginasBohr SommerfeldXimena OrtegaAún no hay calificaciones
- Segundo Parcial Ondas y ParticulasDocumento21 páginasSegundo Parcial Ondas y ParticulasJuan Jose Villamizar LAún no hay calificaciones
- Línea de Tiempo Modelos Atomicos - Velasco SantiagoDocumento3 páginasLínea de Tiempo Modelos Atomicos - Velasco SantiagoSantiago Vs100% (1)
- Cuadro Modelos Atómicos - Roldán Marianela 6°EDocumento2 páginasCuadro Modelos Atómicos - Roldán Marianela 6°EAgusAún no hay calificaciones
- LMy TDocumento6 páginasLMy Tlu pnAún no hay calificaciones
- Resumen Modelos AtómicosDocumento6 páginasResumen Modelos Atómicosyour.worst.nightmare79417873Aún no hay calificaciones
- Fusión NuclearDocumento30 páginasFusión NuclearTrapGameAún no hay calificaciones
- Modelos AtómicosDocumento5 páginasModelos AtómicosTrapGameAún no hay calificaciones
- Modelo Atomico de BohrDocumento11 páginasModelo Atomico de BohrShekinaAún no hay calificaciones
- Bohr SommerfeldDocumento10 páginasBohr SommerfeldXimenaAún no hay calificaciones
- Modelo de RutherfordDocumento18 páginasModelo de RutherfordLuis Fernando Contreras OrtizAún no hay calificaciones
- Modelo de ThonsonDocumento22 páginasModelo de ThonsonGladys Makkoukdji KassarAún no hay calificaciones
- Actividad - 2 - Tabla Modelos - AtomicoDocumento4 páginasActividad - 2 - Tabla Modelos - AtomicoJuan de Dios Marín EscamillaAún no hay calificaciones
- Modelo Atómico TeóricoDocumento4 páginasModelo Atómico TeóricoProf. Ignacio CaggianoAún no hay calificaciones
- Guia QuimicaDocumento26 páginasGuia QuimicaANA KAREN HERNANDEZ BERUMENAún no hay calificaciones
- Deber 1 Quimica UpsDocumento4 páginasDeber 1 Quimica UpsPaola Alejandra GuerreroAún no hay calificaciones
- Modelo Atómico de ThomsonDocumento3 páginasModelo Atómico de ThomsonLeri OspinaAún no hay calificaciones
- MÓDULO 2 - Fundamentos de QuímicaDocumento52 páginasMÓDULO 2 - Fundamentos de Químicajose.torres1Aún no hay calificaciones
- El Átomo - Su Historia y EstructuraDocumento8 páginasEl Átomo - Su Historia y EstructuraEmilio RaschiaAún no hay calificaciones
- 04 - MODELOS ATOMICOS - 2da ParteDocumento3 páginas04 - MODELOS ATOMICOS - 2da ParteRUTH ARACELLY PANGALIMA ALBANAún no hay calificaciones
- Modelos HistoricosDocumento10 páginasModelos HistoricosSusana ChicasAún no hay calificaciones
- Clase 1 Modelos Atómicos, Estructura Atómica y Tipos de ÁtomosDocumento27 páginasClase 1 Modelos Atómicos, Estructura Atómica y Tipos de ÁtomosluisAún no hay calificaciones
- Guia QuímicaDocumento20 páginasGuia Químicaswtdny89bhAún no hay calificaciones
- Evolucion de Los Modelos AtomicosDocumento8 páginasEvolucion de Los Modelos AtomicosIsrael GarAún no hay calificaciones
- Linea de Tiempo Teoria AtomistaDocumento4 páginasLinea de Tiempo Teoria AtomistaEsperanza López MosquedaAún no hay calificaciones
- Linea de TiempoDocumento6 páginasLinea de TiempoYamilet ReyesAún no hay calificaciones
- Teoría AtómicaDocumento6 páginasTeoría AtómicaAngello MolinaAún no hay calificaciones
- Linea de Tiempo Aportaciones en El Modelo AtomicoDocumento5 páginasLinea de Tiempo Aportaciones en El Modelo AtomicoJuan PabloAún no hay calificaciones
- Química 2 Guia 1Documento16 páginasQuímica 2 Guia 1Alexander GustavoAún no hay calificaciones
- Infografia de La Evolución Del Atomo - Lesly PDFDocumento1 páginaInfografia de La Evolución Del Atomo - Lesly PDFLesly MuñetonezAún no hay calificaciones
- Modelo Atomico de RutherfordDocumento5 páginasModelo Atomico de RutherfordPaula andrea Gomez valenciaAún no hay calificaciones
- Atomo CuanticoDocumento48 páginasAtomo CuanticoFernando Díaz SánchezAún no hay calificaciones
- Nacimiento de La Teoría CuánticaDocumento26 páginasNacimiento de La Teoría CuánticaEva HernandezAún no hay calificaciones
- Copia de Tu Gran IdeaDocumento15 páginasCopia de Tu Gran IdeaTOP - s1mpleAún no hay calificaciones
- La Historia ClínicaDocumento15 páginasLa Historia ClínicaFranco ZapataAún no hay calificaciones
- Circuito en ParaleloDocumento7 páginasCircuito en ParaleloBárbaraAún no hay calificaciones
- 496838-Introducci N A La Pedagog A PDFDocumento97 páginas496838-Introducci N A La Pedagog A PDFIván MorenoAún no hay calificaciones
- Bloque I - Fase PreparatoriaDocumento60 páginasBloque I - Fase PreparatoriaMishell TatianaAún no hay calificaciones
- ETS - 01 - Conductor Barra FlexibleDocumento7 páginasETS - 01 - Conductor Barra FlexibleRoberto Carlos Bernaola ChuquillanquiAún no hay calificaciones
- Descriptor de Cargo - Camión Aljibe Gastón MuñozDocumento3 páginasDescriptor de Cargo - Camión Aljibe Gastón MuñozJonathan Philip O'Brien RamirezAún no hay calificaciones
- Caratula CicloDocumento130 páginasCaratula CicloCintia GonzálesAún no hay calificaciones
- Ficha Com 19 - 07 IvDocumento6 páginasFicha Com 19 - 07 Ivmersysc2Aún no hay calificaciones
- AperlanDocumento2 páginasAperlanNelida Cid PaniaguaAún no hay calificaciones
- Existencialismo y VideojuegosDocumento3 páginasExistencialismo y VideojuegosJuan DiazAún no hay calificaciones
- Guia 2. Nutricion en Hongos y Vegetales PDFDocumento3 páginasGuia 2. Nutricion en Hongos y Vegetales PDFtoxico ytAún no hay calificaciones
- La Crítica Como AptitudDocumento6 páginasLa Crítica Como Aptitudtefa2602Aún no hay calificaciones
- Mapa Conceptual Discurso de La EducacionDocumento1 páginaMapa Conceptual Discurso de La EducacionMary Luz Garcia JimenezAún no hay calificaciones
- Evaluación SensorialDocumento7 páginasEvaluación SensorialLara ObedAún no hay calificaciones
- Guía - 1 - Instalar Oracle 12c en Linux7Documento33 páginasGuía - 1 - Instalar Oracle 12c en Linux7Miles LoganAún no hay calificaciones
- Clasificación de Los Números y Propiedades de Los Números RealesDocumento5 páginasClasificación de Los Números y Propiedades de Los Números RealesAlfonso Gonzalez JR.Aún no hay calificaciones
- Anexo 1 Ejercicios Tarea 2 16-01 2022Documento13 páginasAnexo 1 Ejercicios Tarea 2 16-01 2022Fabian GarciaAún no hay calificaciones
- FICHA - TECNICA - BIOMERK - TG - TABLETAS GrasasDocumento1 páginaFICHA - TECNICA - BIOMERK - TG - TABLETAS GrasasJosePallaresGarnicaAún no hay calificaciones
- Resumen BialostockiDocumento6 páginasResumen BialostockiRosa GutiérrezAún no hay calificaciones
- Informe Mantenimeinto de Obras CivilesDocumento7 páginasInforme Mantenimeinto de Obras CivilesAylín Colina JordánAún no hay calificaciones
- SIAE (Panel de Control) HISTORIAL ACADÉMICODocumento1 páginaSIAE (Panel de Control) HISTORIAL ACADÉMICOEric Pedraza VelázquezAún no hay calificaciones
- Invima - ABC Alimentos ModificadosDocumento28 páginasInvima - ABC Alimentos ModificadosJose HernandezAún no hay calificaciones
- ns160 TD Abs 2023 - Bajaj Pulsar - Blanco 15 02 2023Documento2 páginasns160 TD Abs 2023 - Bajaj Pulsar - Blanco 15 02 2023Alexi Cordova garciaAún no hay calificaciones
- Instalar Juegos JAVA en Celulares MotorolaDocumento4 páginasInstalar Juegos JAVA en Celulares MotorolaJeidinson Jesus Pabon TerneraAún no hay calificaciones
- El Barril de AmontilladoDocumento8 páginasEl Barril de AmontilladoCarol Dayana Cabezas VargasAún no hay calificaciones
- EnsayoDocumento3 páginasEnsayoNely Estefany Pérez HernándezAún no hay calificaciones
- Accidentes en OleoductosDocumento106 páginasAccidentes en OleoductosAnonymous hVlHBtoHTAún no hay calificaciones
- ST24001.950.221013 Formato Calibración y Verificación Instrumentación Switchs FlujoDocumento2 páginasST24001.950.221013 Formato Calibración y Verificación Instrumentación Switchs FlujoInstrumentación IndustrialAún no hay calificaciones
- Compendio de Ejercicios de Comprensión Lectora - Textos Discontinuos RuzDocumento29 páginasCompendio de Ejercicios de Comprensión Lectora - Textos Discontinuos RuzRuben MarecosAún no hay calificaciones