Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Reacciones Secci N B
Cargado por
Cesar Valenzuela0 calificaciones0% encontró este documento útil (0 votos)
8 vistas10 páginasEl documento describe las reacciones redox, en las cuales un átomo o ion pierde electrones (oxidación) mientras que otro gana electrones (reducción). Las reacciones redox son comunes en procesos biológicos y industriales. Se explican los conceptos de estado de oxidación, agentes oxidantes y reductores, y se describen varios tipos de reacciones redox.
Descripción original:
Título original
7._Reacciones_secci_n_B
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEl documento describe las reacciones redox, en las cuales un átomo o ion pierde electrones (oxidación) mientras que otro gana electrones (reducción). Las reacciones redox son comunes en procesos biológicos y industriales. Se explican los conceptos de estado de oxidación, agentes oxidantes y reductores, y se describen varios tipos de reacciones redox.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas10 páginasReacciones Secci N B
Cargado por
Cesar ValenzuelaEl documento describe las reacciones redox, en las cuales un átomo o ion pierde electrones (oxidación) mientras que otro gana electrones (reducción). Las reacciones redox son comunes en procesos biológicos y industriales. Se explican los conceptos de estado de oxidación, agentes oxidantes y reductores, y se describen varios tipos de reacciones redox.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 10
Reacciones redox
Lcda. Claudia Cajas
Reacciones redox
• Las reacciones redox (reducción-oxidación) son
procesos químicos en los cuales los átomos o
iones experimentan una transferencia de
electrones. En una reacción redox, una especie
química se oxida (pierde electrones) mientras que
otra se reduce (gana electrones).
• Las reacciones redox son muy comunes en la
naturaleza y se encuentran involucradas en
procesos biológicos como la respiración celular y
la fotosíntesis, así como en procesos industriales
como la producción de energía eléctrica y la
síntesis de productos químicos.
Estado de oxidación
• El estado de oxidación indica la cantidad de
electrones que un átomo de un elemento químico
cede o acepta cuando forma parte de una reacción
química.
• Se puede interpretar también como la supuesta
carga eléctrica que tendría determinado átomo si
todos sus enlaces con otros átomos fuesen
completamente iónicos.
• El estado de oxidación se expresa en números
enteros, siendo cero el estado de oxidación para los
elementos neutros. Así, puede tomar valores
positivos o negativos dependiendo del tipo de
átomo y de la reacción donde participe.
Agentes
• Agente oxidante. Es el átomo que capta
los electrones. En este sentido,
disminuye su estado de oxidación inicial,
y se experimenta una reducción. De esta
forma, aumenta su carga eléctrica
negativa al ganar electrones.
• Agente reductor. Es el átomo que cede
los electrones y aumenta su estado de
oxidación inicial, experimentando una
oxidación. De esta forma, aumenta su
carga eléctrica positiva al ceder
electrones.
Características
• En la mayoría de los casos, las
reacciones redox liberan una
importante cantidad de energía.
• Por lo general, cada reacción redox está
compuesta por dos etapas o
semirreacciones. En una de las
semirreacciones ocurre la oxidación (el
reactivo se oxida) y en la otra ocurre la
reducción (el reactivo se reduce).
• La reacción redox total, que se obtiene
como resultado de combinar
algebraicamente todas las
semirreacciones, se suele llamar
“reacción global”.
• Combustión. Liberan una importante cantidad de energía en forma de
calor y luz. Estas reacciones son oxidaciones rápidas que desprenden
mucha energía. La energía liberada puede ser utilizada de forma
controlada para generar movimiento en los motores de los autos. En
estas reacciones participa un elemento llamado comburente (que se
reduce y oxida al combustible) y un elemento combustible (que se
oxida y reduce al comburente).
• Oxidación de metales. Son reacciones más lentas que las
Tipos de combustiones. Son descritas comúnmente como la degradación de
ciertos materiales, especialmente metálicos, por acción del oxígeno
sobre ellos.
reacción redox • Desproporción. También conocidas como reacciones de dismutación,
presentan un único reactivo que se reduce y se oxida al mismo
tiempo. Un caso típico de esto es la descomposición del agua
oxigenada (H2O2).
• Desplazamiento simple. También llamadas “reacciones de sustitución
simple”, ocurren cuando dos elementos intercambian sus lugares
respectivos dentro de un mismo compuesto. Es decir, un elemento
sustituye a otro en su exacto lugar de la fórmula, balanceando sus
respectivas cargas eléctricas con otros átomos según convenga.
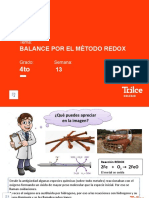
Ejercicio
• ¿Es esta reacción una reacción redox? Si es así, ¿qué elemento de la
reacción se oxida y qué elemento se reduce?
+3
-3 +1 0 +2 -2 +2 -2
Nitrógeno: -3 → +2 oxidando: perdiendo electrones
Oxígeno: 0 → -2 Reducción: gana electrones
Agente oxidante: Oxígeno
Agente reductor: Amoniaco
Ejercicio
• ¿Qué elemento de la reacción se oxida y qué elemento se reduce?
+6 -6 -4
+3 -2 +2 -2 0 +4 -2
Hierro: +3 → 0 Reducción: gana electrones
Carbono: +2 → +4 oxidando: perdiendo electrones
Agente oxidante: óxido férrico
Agente reductor: monóxido de carbono
Ejercicio
• ¿Qué elemento de la reacción se oxida y qué elemento se reduce?
-6 -6
0 +5 +1 -2 +5 +1 -2 0
Plata (Ag): +5 → 0 Reducción: gana electrones
Zinc: 0 → +5 oxidando: perdiendo electrones
Agente oxidante: Hidróxido de plata
Agente reductor: Zinc
Ejercicio
• ¿Qué elemento de la reacción se oxida y qué elemento se reduce?
-4 -2
+4 -2 +1 -1 +2 -1 0
Manganeso: +4 → +2 Reducción: gana electrones
Cloro: -1 → 0 oxidando: perdiendo electrones
Agente oxidante: óxido de manganeso
Agente reductor: ácido clorhídrico
También podría gustarte
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADe EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSAAún no hay calificaciones
- Primera Parte TeoriaDocumento6 páginasPrimera Parte TeoriaMario Monreal ToledanoAún no hay calificaciones
- Análisis Químico E Instrumental: Semana 06Documento21 páginasAnálisis Químico E Instrumental: Semana 06Genaro HuarcayaAún no hay calificaciones
- Oxdidacion-Reduccion RedoxDocumento12 páginasOxdidacion-Reduccion RedoxAshly De Jesus RodriguezAún no hay calificaciones
- 1° Parte. ELECTROQUÍMICA 2023Documento15 páginas1° Parte. ELECTROQUÍMICA 2023Estefani Hassinger BottgerAún no hay calificaciones
- Informe de LaboratorioDocumento11 páginasInforme de LaboratorioFabritzio SandovalAún no hay calificaciones
- Redox GANA O PERDIO HGG ABRIL 201Documento23 páginasRedox GANA O PERDIO HGG ABRIL 201Alb CruzAún no hay calificaciones
- Oxido ReducciónDocumento7 páginasOxido Reducciónjorge fernando TorresAún no hay calificaciones
- Trabajo de QuimicaDocumento7 páginasTrabajo de Quimicathe_ever_ucAún no hay calificaciones
- Redox InformeDocumento7 páginasRedox InformeSaul GonzalezAún no hay calificaciones
- Agentes Oxidantes y Agentes ReductoresDocumento10 páginasAgentes Oxidantes y Agentes ReductoresXochitl Yazmin Dolores RodriguezAún no hay calificaciones
- 4 Electroquimica - Parte 2Documento26 páginas4 Electroquimica - Parte 2XIMENA LINARES LAURAAún no hay calificaciones
- Informe de Laboratorio N6Documento14 páginasInforme de Laboratorio N6Alex QuentaAún no hay calificaciones
- Informe VolumetriaDocumento18 páginasInforme VolumetriakaylaniariannequispecuizaAún no hay calificaciones
- Monografia Quimica CuerpoDocumento18 páginasMonografia Quimica CuerpoBryan Almanza MarcapuraAún no hay calificaciones
- Unidad 1 - Sem 1 - Ses 1 - Reacciones RedoxDocumento16 páginasUnidad 1 - Sem 1 - Ses 1 - Reacciones RedoxLizbeth Candy AranaAún no hay calificaciones
- Agente Oxidante y Agente Reductor33Documento3 páginasAgente Oxidante y Agente Reductor33Oscar ReyesAún no hay calificaciones
- Taller Reacciones RedoxDocumento2 páginasTaller Reacciones RedoxtelmapatriciaAún no hay calificaciones
- Balanceo de Ecuaciones QuímicasDocumento19 páginasBalanceo de Ecuaciones QuímicasCarlos Gerardo Castillo SosaAún no hay calificaciones
- QUIM-102 RedoxDocumento16 páginasQUIM-102 RedoxenukAún no hay calificaciones
- RedoxDocumento32 páginasRedoxyuliana MantheyAún no hay calificaciones
- Unidad 1 - Sesión 1 - Reacciones RedoxDocumento16 páginasUnidad 1 - Sesión 1 - Reacciones RedoxBrayam Stalyn Bonifacio AyalaAún no hay calificaciones
- Material 2022B1 QUI100 02 151324Documento33 páginasMaterial 2022B1 QUI100 02 151324Evelin Sonia Tapia PachecoAún no hay calificaciones
- Diapositivas Redox Primera ParteDocumento25 páginasDiapositivas Redox Primera ParteSol PolitanoAún no hay calificaciones
- Numeros de OxidacionDocumento5 páginasNumeros de OxidacionnaitzyAún no hay calificaciones
- Qui MicaDocumento11 páginasQui MicaNadia ReyesAún no hay calificaciones
- Practica 1.-Reacciones REDOXDocumento10 páginasPractica 1.-Reacciones REDOXIvancito Paul Martinez CondoriAún no hay calificaciones
- Protocolo de Las Reacciones de Oxido Reducción en La PlataDocumento8 páginasProtocolo de Las Reacciones de Oxido Reducción en La PlataGabriela Corona TorresAún no hay calificaciones
- INTRODUCCIÓ1Documento20 páginasINTRODUCCIÓ1LEOAún no hay calificaciones
- Química 4°MC M. Pradenas 16 06 20Documento14 páginasQuímica 4°MC M. Pradenas 16 06 20Diego Simão Rojas ArrietAún no hay calificaciones
- ¿Qué Son Las Reacciones Redox?Documento8 páginas¿Qué Son Las Reacciones Redox?Belen MonicoAún no hay calificaciones
- Reacciones RedoxDocumento8 páginasReacciones Redoxangelina berigueteAún no hay calificaciones
- Laboratorio VirtualDocumento15 páginasLaboratorio VirtualValeria NCoronadoAún no hay calificaciones
- Teórico 9 Electroquímica 2023Documento41 páginasTeórico 9 Electroquímica 2023facuchilinchavideAún no hay calificaciones
- Trabajo Reacciones RedoxDocumento13 páginasTrabajo Reacciones RedoxManu DomAún no hay calificaciones
- Practica 5 QuimecaDocumento4 páginasPractica 5 QuimecaLima Olivas AngelAún no hay calificaciones
- Romero Zapana Leonardo (Prueba de Entrada Semana 4) PDFDocumento3 páginasRomero Zapana Leonardo (Prueba de Entrada Semana 4) PDFLEONARDO ALCIDES ROMERO ZAPANAAún no hay calificaciones
- Química Inorgánica - ELECTROQUIMICA Primera ParteDocumento19 páginasQuímica Inorgánica - ELECTROQUIMICA Primera ParteEmilly WilliamsAún no hay calificaciones
- REDOXDocumento11 páginasREDOXYailen LlantoAún no hay calificaciones
- Sesión 4 Bioxidación y BiorreducciónDocumento62 páginasSesión 4 Bioxidación y BiorreducciónKatherine Milagros Valdiviezo SantosAún no hay calificaciones
- Expo Potencial EstandarDocumento10 páginasExpo Potencial Estandaralares165Aún no hay calificaciones
- Reacciones y Ecuaciones Quimicas BalanceoDocumento20 páginasReacciones y Ecuaciones Quimicas BalanceoAndres MoralesAún no hay calificaciones
- Química IV Medio S4Documento14 páginasQuímica IV Medio S4brunoh3oAún no hay calificaciones
- REDOXDocumento10 páginasREDOXSEBASTUTUTUAún no hay calificaciones
- Guia 10Documento7 páginasGuia 10Cristofher MaradiagaAún no hay calificaciones
- Reacciones de Oxido-ReducciónDocumento25 páginasReacciones de Oxido-ReducciónMauriAún no hay calificaciones
- Todo Sobre Las Reacciones REDOXDocumento3 páginasTodo Sobre Las Reacciones REDOXCesar ContrerasAún no hay calificaciones
- Q - 4to - Balance Por Método Redox (Con Audio)Documento26 páginasQ - 4to - Balance Por Método Redox (Con Audio)Edwin FloresAún no hay calificaciones
- Practica 5 - Oxidación-ReducciónDocumento8 páginasPractica 5 - Oxidación-ReducciónAlexandraAún no hay calificaciones
- 5.laboratorio de Quimica Industrial Reacciones de Oxido-ReducciónDocumento10 páginas5.laboratorio de Quimica Industrial Reacciones de Oxido-Reducciónalejandro suarezAún no hay calificaciones
- Qui Elec III M Unidad 1 III Ab DF Clase Semana 1 y 2 2020Documento19 páginasQui Elec III M Unidad 1 III Ab DF Clase Semana 1 y 2 2020Cynthia AlvaradoAún no hay calificaciones
- Reacciones RedoxDocumento8 páginasReacciones RedoxNatalia BalbuenaAún no hay calificaciones
- Practica 5 Oxido-Reduccion Equipo 6Documento8 páginasPractica 5 Oxido-Reduccion Equipo 6RODRIGUEZ RAMIREZ SAMUEL100% (1)
- Guia de Refuerzo - Reacciones QuimicasDocumento5 páginasGuia de Refuerzo - Reacciones QuimicasThe Evil TwinAún no hay calificaciones
- Taller de Balanceo Por Óxido-ReducciónDocumento1 páginaTaller de Balanceo Por Óxido-ReducciónDiego Fernando Ardila ArizaAún no hay calificaciones
- Electroquimica 1Documento13 páginasElectroquimica 1Victor Quecaña GutierrezAún no hay calificaciones
- Tarea AdrianDocumento1 páginaTarea AdrianLiz BenitezAún no hay calificaciones
- Reacciones RedoxDocumento12 páginasReacciones RedoxKarla BairesAún no hay calificaciones
- Reacciones RedoxDocumento9 páginasReacciones RedoxDavid Reinaldo Ascue SalgadoAún no hay calificaciones
- Practica 8 PresentacionDocumento37 páginasPractica 8 PresentacionHelen Fabiola Macz GodinezAún no hay calificaciones
- ELABORACIONDocumento35 páginasELABORACIONevivaccaniAún no hay calificaciones
- Sanigen® CL HDSDocumento12 páginasSanigen® CL HDSNatalya Domian LópezAún no hay calificaciones
- 1ra TareaDocumento6 páginas1ra TareaJhoselyn Pijuan ViscarraAún no hay calificaciones
- Tratamiento de Lodos en PTAP.2003Documento106 páginasTratamiento de Lodos en PTAP.2003Lucio AlvarezAún no hay calificaciones
- Etiquetas Sistema Globalmente ArmonizadoDocumento68 páginasEtiquetas Sistema Globalmente ArmonizadoLisseth Juliana Mesa RosasAún no hay calificaciones
- ElementalDocumento7 páginasElementalGayosso Arellano MaricruzAún no hay calificaciones
- La Panadería, Manual Práctico de La Fabricación de Toda Clase de Pan, Condiciones Generales de Las HarinasDocumento151 páginasLa Panadería, Manual Práctico de La Fabricación de Toda Clase de Pan, Condiciones Generales de Las HarinasAdan romoAún no hay calificaciones
- SolucionesDocumento5 páginasSolucionesLara PanaccioAún no hay calificaciones
- Cuestionario Seminario 4Documento2 páginasCuestionario Seminario 4Andres Omar Poveda CaballeroAún no hay calificaciones
- NC Antiox NicodemoDocumento105 páginasNC Antiox NicodemoLizeth Palacios GonzalesAún no hay calificaciones
- Problemario Analisis AADocumento10 páginasProblemario Analisis AAKassandra RosalesAún no hay calificaciones
- ELL Pentane + N-Formylmorpholine Equipo 13Documento29 páginasELL Pentane + N-Formylmorpholine Equipo 13Gilberto MartínezAún no hay calificaciones
- La RazDocumento3 páginasLa Razthais pizarro contrerasAún no hay calificaciones
- Grease Free 2Documento5 páginasGrease Free 2erick SadotAún no hay calificaciones
- Actividad 1 Cuestionario 1 de BioquimicaDocumento10 páginasActividad 1 Cuestionario 1 de BioquimicaJairo TavaresAún no hay calificaciones
- Oxidación BiológicaDocumento16 páginasOxidación BiológicaDelmira Andia challcoAún no hay calificaciones
- 4 Diapositivas Ensayo de Gravedad Especifica y Absorcion de Agregados FinosDocumento15 páginas4 Diapositivas Ensayo de Gravedad Especifica y Absorcion de Agregados Finos01-IC-HU-CRISTIAM RICARDO POMALAZA RODRIGUEZAún no hay calificaciones
- FOTOSINTESISDocumento9 páginasFOTOSINTESISYURI DANIELA MUNEVAR MARTINEZAún no hay calificaciones
- Tech-Spa - P101SDocumento1 páginaTech-Spa - P101SKeyna DíazAún no hay calificaciones
- Catalogo Treck Calzado 2023Documento53 páginasCatalogo Treck Calzado 2023Natalia SantanderAún no hay calificaciones
- Hipoclorito de Sodio Al 13Documento8 páginasHipoclorito de Sodio Al 13Rodolfo HuitronAún no hay calificaciones
- Canales de Drenaje Ulma Architectural SolutionsDocumento55 páginasCanales de Drenaje Ulma Architectural SolutionsFrancisco Javier Agurto BravoAún no hay calificaciones
- Tipos de LadrillosDocumento4 páginasTipos de LadrillosJohan FabianAún no hay calificaciones
- Guía Lab PRÁCTICA #1Documento6 páginasGuía Lab PRÁCTICA #1Anderson MartelAún no hay calificaciones
- 25manualDocumento18 páginas25manualLina Espitia TorresAún no hay calificaciones
- Los Ácidos NucléicosDocumento12 páginasLos Ácidos NucléicosJose murciaAún no hay calificaciones
- Unidad 1. Paso 7 Taller Fisiologia VegetalDocumento12 páginasUnidad 1. Paso 7 Taller Fisiologia VegetalCLERIS SERPAAún no hay calificaciones
- Practica 1 Recristalización y Puntos de FusiónDocumento3 páginasPractica 1 Recristalización y Puntos de FusiónPAOLA ANDREA QUENALLATA CHIPANAAún no hay calificaciones
- Quimica Mi Espe Evaluacion 1 ParcialDocumento4 páginasQuimica Mi Espe Evaluacion 1 ParcialKlever AcaroAún no hay calificaciones
- Informe Analitica TerminadoDocumento6 páginasInforme Analitica Terminadostevew apellidosAún no hay calificaciones