Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejercicios Redox Soluciones
Cargado por
Mauro Alejandro ChocobarTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ejercicios Redox Soluciones
Cargado por
Mauro Alejandro ChocobarCopyright:
Formatos disponibles
lOMoARcPSD|6838866
Ejercicios Redox- Soluciones
Quimica general (Universidad Nacional de Salta)
Studocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejercicios Redox - Soluciones
Ejercicio 1: Dada la siguiente reacción redox en disolución acuosa:
KMnO4 + KI + H2SO4 I2 + MnSO4 + K2SO4 + H2O
a) Ajustar la reacción por el método del ión-electrón.
b) Calcule los litros de disolución 2 M de permanganato de potasio necesarios para obtener
1 Kg de yodo. Masas atómicas: I = 127; K = 39; O = 16; Mn = 55
Ejercicio 2: Dada la reacción redox en disolución acuosa:
KI + H2SO4 + K2Cr2O7 K2SO4 + H2O + Cr2(SO4)3
a) Ajuste por el método del ión-electrón la reacción.
b) Calcule la molaridad de la disolución de dicromato de potasio, si 30 mL de la misma
reaccionan con 60 mL de una disolución que contiene 80 g/L de yoduro de potasio.
Masas atómicas: O = 16; K = 39; Cr = 52; I = 127
Ejercicio 3: El ácido sulfúrico concentrado reacciona con el bromuro de potasio según la
reacción:
H2SO4 + KBr K2SO4 + Br2 + SO2 + H2O
a) Ajuste, por el método del ión-electrón, la reacción anterior.
b) Calcule el volumen de bromo líquido (densidad 2,92g/cm3) que se obtendrá al tratar 90,1
g de bromuro de potasio con suficiente cantidad de ácido sulfúrico. Masas atómicas: K =
39; Br = 80
Ejercicio 4: El KMnO4, en medio ácido sulfúrico, reacciona con el H2O2 para dar 4
MnSO4, O2 , H2O y K2SO4.
a) Ajuste la reacción molecular por el método del ion-electrón.
b) ¿Qué volumen de O2 medido a 1520 mm de Hg y 125 ºC se obtiene a partir de 100 g
de KMnO4? Masas atómicas: C = 12; O = 16; K = 39; Mn = 55.
Ejercicio 5: Dadas las siguientes reacciones (sin ajustar):
CaO + H2O Ca(OH)2
Ag + HNO3 AgNO3 + NO2 + H2O
a) Si son de oxidación-reducción.
b) ¿Qué especies se oxidan y qué especies se reducen?
c) Iguale por el método del ión electrón la ecuación que sea redox.
Ejercicio 6: En medio ácido sulfúrico, el permanganato de potasio reacciona con Fe (II)
según:
KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
a) Ajuste la reacción por el método del ión-electrón.
b) Calcule el número de moles de sulfato de hierro (III) que se obtienen cuando reaccionan
79 g de permanganato de potasio con la cantidad necesaria de Fe (II).
c) Calcule los mL de disolución 0,5 M de KMnO4 necesarios para que reaccionen
Completamente con 2,4 g de FeSO4. Masas atómicas: O = 16; K = 39; Mn = 55; S=32; Fe=56
Ejercicio 7: El óxido nítrico (NO) se prepara según la reacción:
Cu HNO3 Cu(NO3)2 NOH2O
a) Ajuste la reacción molecular por el método del ión-electrón.
b) Calcule la masa de cobre que se necesita para obtener 0,5 L de NO medidos a 750 mm de
Hg y 25º C.
c) Calcule el volumen de NO, medido en condiciones normales, que se obtiene cuando
reaccionan 7,5 g de Cu con 1 litro de disolución 0’2 M de HNO3. Masa atómica: Cu = 63,5.
Ing. Silvia Cristina Ibáñez Página 1
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejercicios Redox - Soluciones
Ejercicio 8: En medio ácido, el ión cromato oxida al ión sulfito según la ecuación:
CrO4 2- + SO3 2- + H + Cr 3+ + SO4 2- + H2O
a) Ajuste la ecuación iónica por el método del ión-electrón.
b) Si 25 mL de una disolución de Na2SO3 reaccionan con 28,1 mL de disolución 0,088
M de K2CrO4 , calcule la molaridad de la disolución de Na2SO3
Ejercicio 9: La siguiente reacción redox tiene lugar en medio ácido:
MnO4– + Cl - + H+ Mn 2+ + Cl2 + H2O
Indique, razonando la respuesta, la veracidad o falsedad de las afirmaciones siguientes:
a) El Cl es el agente reductor.
b) El MnO4 experimenta una oxidación.
c) En la reacción, debidamente ajustada, se forman también 4 moles de H2O por cada
mol de MnO4 .
Ejercicio 10: El bromuro sódico reacciona con el ácido nítrico, en caliente, según la
siguiente ecuación:
NaBr HNO3 Br2 NO2 NaNO3 H2O
a) Ajuste esta reacción por el método del ión electrón.
b) Calcule la masa de bromo que se obtiene cuando 100 g de bromuro de sodio se tratan
con ácido nítrico en exceso.Masas atómicas: Br = 80; Na = 23.
Ejercicio 11: La siguiente reacción redox tiene lugar en medio ácido:
MnO4 - + Ag + H+ Mn2+ + Ag+ + H2O
a) Ajuste esta reacción por el método del ión electrón.
b) Calcule los gramos de plata metálica que podría ser oxidada por 50 mL de una
disolución acuosa de MnO4 0,2 M. Masa atómica: Ag = 108.
Ejercicio 12: El ácido nítrico (HNO3) reacciona con el sulfuro de hidrógeno (H2S)
dando azufre elemental (S), monóxido de nitrógeno (NO) y agua.
a) Escriba y ajuste por el método del ión electrón la reacción correspondiente.
b) Determine el volumen de H2S, medido a 60º C y 1 atm, necesario para que reaccione
con 500 mL de HNO3 0,2 M.
Ejercicio 13: Dada la siguiente reacción redox:
HCl K2Cr2O7 CrCl3 KCl Cl2 H2O
a) Ajuste la reacción por el método del ion-electrón.
b) Calcule la molaridad de la disolución de HCl si cuando reaccionan 25 mL de la
misma con exceso de K2Cr2O7 producen 0,3 L de Cl2 medidos en condiciones normales.
Ejercicio 14: Dada la siguiente reacción redox:
H2SO4 KBrK2SO4 Br2 SO2 H2O
a) Ajuste la reacción por el método del ión-electrón.
b) Calcule el volumen de SO2, medido a 700 mm de Hg y 25 ºC, que se puede obtener a
partir de 50 g de KBr y exceso de H2SO4. Masas atómicas: K = 39; Br = 80.
Ejercicio 15: La siguiente reacción tiene lugar en medio ácido:
Mn4O- + Fe2+ Mn2+ + Fe 3+
a) Ajuste la reacción iónica por el método del ión-electrón.
Ing. Silvia Cristina Ibáñez Página 2
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejercicios Redox - Soluciones
b) Calcule la molaridad de una disolución de KMnO4, sabiendo que a partir de 50 mL de
la misma se pueden obtener 0,34 moles de Fe3+
Ejercicio 16: Dada la siguiente reacción redox:
KI H2SO4 K2SO4 I2 H2S H2O
a) Ajuste la reacción por el método del ión-electrón.
b) Calcule los moles de I2 que se obtienen cuando 1 L de una disolución 2 M de KI se
ponen a reaccionar con 2 L de una disolución 0,5 M de H2SO4.
Ejercicio 17: La siguiente reacción redox tiene lugar en medio ácido:
Zn + BrO4- Zn2+ + Br -
a) Ajuste la reacción iónica por el método del ión-electrón.
b) Calcule la riqueza (pureza) de una muestra de cinc si 1,00 g de la misma reacciona con
25 mL de una disolución 0,1 M en iones BrO4- . Masa atómica: Zn = 65,4.
Ejercicio 18: La siguiente reacción tiene lugar en medio ácido:
Cr2O7 2- + C2O4 2- Cr3+ +CO2
a) Ajuste por el método del ión-electrón esta reacción en su forma iónica.
b) Calcule el volumen de medido a 700 mm de Hg y 30 ºC que se obtendrá cuando
reaccionan 25,8 mL de una disolución de K2Cr2O7 0,02 M con exceso de ión C2O4 2-
Ejercicio 19: Una muestra que contiene sulfuro de calcio, CaS, se trata con ácido nítrico
concentrado hasta reacción completa, según:
CaS HNO3 NO SO2 Ca(NO3)2 H2O
a) Ajuste por el método del ión-electrón esta reacción en sus formas iónica y molecular.
b) Sabiendo que al tratar 35 g de la muestra con exceso de ácido se obtienen 20,3 L de
NO, medidos a 30 ºC y 780º mm de Hg, calcule la riqueza en CaS de la muestra.
Masas atómicas: Ca = 40; S = 32.
Ejercicio 20: El ácido nítrico reacciona con el sulfuro de hidrógeno según la ecuación:
HNO3 (ac) H2S(g) NO(g) SO2 (g) H2O(l)
a) Ajuste por el método del ión-electrón esta reacción en sus formas iónica y molecular.
b) Calcule el volumen de sulfuro de hidrógeno, medido a 700 mm de Hg y 60ºC,
necesario para reaccionar con 500 mL de una disolución de ácido nítrico 0,5 M.
Ejercicio 21: Dada la reacción:
K2Cr2O7(ac) + Na2SO3(ac) + H2SO4 Cr2(SO4)3(ac) + K2 SO4(ac) + Na2SO4(ac) + H2O
a) Ajuste por el método del ión-electrón esta reacción en sus formas iónica y molecular.
b) Calcule la molaridad de una disolución de sulfito de sodio, si 15 mL de ésta reaccionan
totalmente, en medio ácido, con 25,3 mL de disolución de dicromato potásico 0,06 M
Ejercicio 22: La siguiente reacción transcurre en medio ácido:
MnO4 - + SO3 2- MnO2 + SO4 2-
a) Razone qué especie se oxida y cuál se reduce.
b) Indique cuál es el oxidante y cuál el reductor, justificando la respuesta.
c) Ajuste la reacción iónica.
Ejercicio 23: El ácido nítrico reacciona con el cobre generando nitrato de cobre (II),
monóxido de nitrógeno (NO) y agua.
a) Escriba la ecuación iónica del proceso.
b) Asigne los números de oxidación y explique qué sustancia se oxida y cuál se reduce.
Ing. Silvia Cristina Ibáñez Página 3
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejercicios Redox - Soluciones
c) Determine la ecuación molecular y ajústela mediante el método del ión-electrón
Ejercicio 24: Dada la reacción:
KMnO4 + Na2C2O4 + H2SO4 K2SO4 + MnSO4 + Na2SO4 + H2O + CO2
a) Ajuste por el método del ión-electrón esta reacción en sus formas iónica y molecular.
b) Calcule la molaridad de una disolución de KMnO4 sabiendo que 20 mL de la misma
reaccionan por completo con 0,268 g de Na2C2O4. Masas atómicas: C=12 ; O=16 ; Na=23
Ejercicio 25: Dada la reacción:
KMnO4 + FeSO4 + H2SO4 MnSO4 + K2SO4 + Fe2(SO4)3 + H2O
a) Ajuste por el método del ión-electrón esta reacción, en su forma iónica y molecular.
b) ¿Qué volumen de disolución 0,02 M de permanganato de potasio se necesita para oxidar
30 mL de disolución de sulfato de hierro (II) 0,05 M, en presencia de ácido sulfúrico?
Ejercicio 26: El ácido nítrico concentrado reacciona con mercurio elemental en presencia
de ácido clorhídrico produciendo cloruro de mercurio (II), monóxido de nitrógeno y agua.
a) Ajuste la ecuación iónica y molecular por el método del ión-electrón.
b) Calcule el volumen de ácido nítrico 2 M que se debe emplear para oxidar completamente
3 g de mercurio elemental. Masa atómica: Hg = 200'6.
Ejercicio 27: El estaño metálico es oxidado por el ácido nítrico produciendo óxido de
estaño (IV), dióxido de nitrógeno y agua.
a) Ajuste las ecuaciones iónica y molecular del proceso por el método del ión-electrón.
b) Calcule los gramos de estaño que reaccionan con 2 L de disolución de ácido nítrico 2 M.
Masa atómica: Sn = 118'7.
Ejercicio 28: El gas cloro se puede obtener por reacción de ácido clorhídrico con ácido
nítrico, produciéndose simultáneamente dióxido de nitrógeno y agua.
a) Ajuste la ecuación iónica y molecular por el método del ión-electrón.
b) Calcule el volumen de cloro obtenido, a 17 ºC y 720 mm de Hg, cuando reaccionan 100
mL de una disolución de ácido clorhídrico 0,5 M con ácido nítrico en exceso.
Ejercicio 29: a) Ajuste por el método del ión-electrón la siguiente reacción:
KClO3 + KI + H2O KCl + I2 + KOH
b) Calcule la masa de clorato de potasio que se necesitará para obtener 1 gramo de yodo.
Masas atómicas: . Cl=35'5 ; K=39 ; O=16 ; I=127
Ejercicio 30: El permanganato de potasio oxida al sulfato de hierro (II) en medio ácido
sulfúrico, para dar sulfato de manganeso (II), sulfato de hierro (III), sulfato de potasio y
agua.
a) Ajuste la ecuación iónica y la molecular del proceso por el método del ión-electrón.
b) Calcule el volumen de una disolución de permanganato de potasio 0,02 M que se
requiere para oxidar 40 mL de disolución de sulfato de hierro (II) 0,1 M.
Ejercicio 31: En la valoración de una muestra de nitrito de potasio impuro, disuelto en 100
mL de agua acidulada con ácido sulfúrico, se han empleado 5,0 mL de permanganato de
potasio 0,1 M. Sabiendo que se obtiene nitrato de potasio, sulfato de potasio y sulfato de
manganeso (II)
a) Ajuste las ecuaciones iónica y molecular por el método del ión-electrón.
b) Calcule la riqueza en nitrito de la muestra inicial, si su masa era 0,125 g.
Masas atómicas: K = 39; O = 16; N = 14.
Ing. Silvia Cristina Ibáñez Página 4
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejercicios Redox - Soluciones
Ejercicio 32: En disolución acuosa y en medio ácido sulfúrico el sulfato de hierro (II)
reacciona con permanganato de potasio para dar sulfato de manganeso (II), sulfato de hierro
(III) y sulfato de potasio.
a) Escriba y ajuste las correspondientes reacciones iónicas y la molecular del proceso por el
método del ión-electrón.
b) Calcule la concentración molar de una disolución de sulfato de hierro (II) si 10 mL de
esta disolución han consumido 22,3 mL de una disolución acuosa de permanganato de
potasio 0,02 M.
Ejercicio 33: El dióxido de manganeso reacciona en medio de hidróxido de potasio con
clorato de potasio para dar permanganato de potasio, cloruro de potasio y agua.
a) Ajuste la ecuación molecular por el método del ión-electrón.
b) Calcule la riqueza en dióxido de manganeso de una muestra si 1,00 g de la misma
reacciona exactamente con 0,35 g de clorato de potasio.
Masas atómicas: O=16 ; Cl=35,5 ; K= 39 ; Mn=55
Ejercicio 34: Ajuste las siguientes ecuaciones iónicas, en medio ácido, por el método del
ión-electrón:
a) MnO4 - + I- Mn 2+ + I2
b) VO4 3- + Fe 2+ VO 2+ + Fe3+
c) Cl2 + I- Cl- + I 2
Ejercicio 35: El clorato de potasio reacciona en medio ácido sulfúrico con el sulfato de
hierro (II) para dar cloruro de potasio, sulfato de hierro (III) y agua:
a) Escriba y ajuste la ecuación iónica y molecular por el método del ión-electrón.
b) Calcule la riqueza en clorato de potasio de una muestra sabiendo que 1g de la misma han
reaccionado con 25 mL de sulfato de hierro (II) 1M. Masas atómicas:O=16;Cl=35,5; K= 39.
Ejercicio 36: El ácido sulfúrico concentrado reacciona con el bromuro de potasio para dar
bromo, dióxido de azufre, sulfato de potasio y agua.
a) Escriba y ajuste la ecuación molecular por el método del ión-electrón.
b) Calcule los gramos de bromo que se producirán cuando se traten 50,00 g de bromuro de
potasio con exceso de ácido sulfúrico. Masas atómicas: K=39 ; Br=80
Ejercicio 37: Una muestra de un mineral que contiene cobre, además de impurazas inertes,
se disuelve con ácido nítrico concentrado según la siguiente reacción sin ajustar:
Cu + HNO3 Cu(NO3)2 + NO + H2O
a) Ajuste por el método del ión-electrón la ecuación molecular.
b) Calcule el contenido en cobre de la muestra si 1, 00 g de la misma reacciona totalmente
con 25 mL de ácido nítrico 1 M. Masas atómicas: Cu = 63,5
Ejercicio 38: Al burbujear sulfuro de hidrógeno a través de una disolución de dicromato de
potasio, en medio ácido sulfúrico, el sulfuro de hidrógeno se oxida a azufre elemental según
la siguiente reacción:
H2S + K2Cr2O7 + H2SO4 Cr2(SO4)3 + S + H2O + K2SO4
a) Ajuste la ecuación molecular por el método del ión-electrón.
b) Qué volumen de sulfuro de hidrógeno, medido a 25ºC y 740 mm Hg de presión, debe
pasar para que reaccionen exactamente con 30 mL de disolución de dicromato de potasio
0,1 M.
Ejercicio 39: El yodo molecular en medio básico reacciona con el sulfito de sodio según la
reacción:
Ing. Silvia Cristina Ibáñez Página 5
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejercicios Redox - Soluciones
I2 + Na2SO3 + NaOH NaI + H2O + Na2SO4
a) Ajuste la ecuación molecular según el método del ión-electrón.
b) ¿Qué cantidad de sulfito de sodio reaccionará exactamente con 2,54 g de yodo
molecular? Datos: Masas atómicas O = 16; Na = 23; S = 32; I = 127.
Ejercicio 40: Dada la reacción de oxidación-reducción:
I2 + HNO3 HIO3 + NO+ H2O
a) Escriba y ajuste las semireacciones de oxidación y reducción por el método del ión-
electrón.
b) Escriba la reacción molecular ajustada.
c) Identifique, justificando la respuesta, el agente oxidante y el reductor.
Ejercicio 41: El ácido nítrico reacciona con el sulfuro de hidrógeno dando azufre elemental
(S), monóxido de nitrógeno y agua.
a) Escriba y ajuste por el método del ion-electrón la reacción molecular correspondiente.
b) Determine el volumen de sulfuro de hidrógeno, medido a 60ºC y 1 atm, necesario para
que reaccione con 500 mL de ácido nítrico 0,2 M.
Ejercicio 42: Dada la siguiente reacción:
As + KBrO + KOH K3AsO4 + KBr + H2O
a) Ajuste la ecuación molecular según el método del ión-electrón.
b) Calcule los gramos de arsénico que habrán reaccionado cuando se hayan consumido 60
mL de hidróxido de potasio 0,25 M. Datos: Masas atómicas: H=1 ; As=74,9 ; O=16 ; K=39
Ejercicio 43: Se hace reaccionar una muestra de 10 g de cobre con ácido sulfúrico
obteniéndose 23,86 g de sulfato de cobre (II), además de dióxido de azufre y agua.
a) Ajuste la reacción molecular que tiene lugar por el método del ión-electrón.
b) Calcule la riqueza de la muestra inicial en cobre. Datos: Masas atómicas: H=1 ; O=16 ;
S=32 ; Cu= 63,5
Ejercicio 44: 100 g de bromuro de sodio, se tratan con ácido nítrico concentrado, de
densidad 1,39 g/mL y riqueza del 70% en masa, hasta reacción completa. En esta reacción
se obtienen: Br2, NO2 , nitrato de sodio y agua como productos de la reacción.
a) Ajuste las semireacciones de oxidación y reducción por el método del ión electrón y
ajuste tanto la reacción iónica como la molecular.
b) Calcule el volumen de ácido nítrico necesario para completar la reacción.
Datos: Masas atómicas: Br = 80, Na = 23, O = 16, N = 14, H = 1.
Ejercicio 45: Dada la reacción:
Sulfuro cúprico + ácido nítrico S + NO+ nitrato cúprico+agua
a) Ajuste las semirreacciones de oxidación y reducción por el método de ión electrón y
ajuste tanto la reacción iónica como la molecular.
b) Calcule el volumen de una disolución de ácido nítrico del 65% de riqueza en peso y
densidad de 1,4 g/mL que se necesitan para que reaccionen 20,00 g de sulfuro de cobre
(II). Datos: Masas atómicas: S=32; Cu=63,5; N=14; H=1; O=16
Ejercicio 46: Dada la reacción:
Permanganato de potasio + ácido fluorhídrico + agua fluoruro de potasio + fluoruro
de manganeso (II) + peróxido de hidrógeno
a) Identifique y ajuste las semirreacciones de oxidación y reducción.
b) Indique la especie oxidante y reductora.
Ing. Silvia Cristina Ibáñez Página 6
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
lOMoARcPSD|6838866
Ejercicios Redox - Soluciones
Ejercicio 47: Dada la siguiente reacción:
KMnO4 KI KOH K2MnO KIO3 H2O
a) Ajusta las semireacciones de oxidación y reducción por el método del ión-electrón y
ajusta tanto la reacción iónica como la molecular.
b) Calcula los gramos de yoduro de potasio necesarios para que reaccionen con 120 mL
de disolución de permanganato de potasio 0,67 M. Masas atómicas: I = 127; K = 39
Ejercicio 48: Dada la siguiente reacción:
K2Cr2 O7 HCl NaNO2 NaNO3 CrCl3 H2OKCl
a) Ajuste las semirreacciones de oxidación y reducción por el método de ión electrón y
ajuste tanto la reacción iónica como la molecular.
b) Calcule el volumen de K2Cr2O7 2 M necesario para oxidar 20 g de NaNO2 .
Datos: Masas atómicas N 14;O 16;Na 23
Ejercicio 49: Dada la reacción:
KBr H2SO4 K2SO4 Br2 SO2 H2O
a) Ajuste las semirreacciones de oxidación y reducción por el método de ión electrón y
ajuste tanto la reacción iónica como la molecular.
b) ¿Cuántos mL de bromo ( Br2 , líquido) se producirán al hacer reaccionar 20 gramos
de bromuro de potasio con ácido sulfúrico en exceso? Datos: Densidad Br2 2,8 g /mL.
Masas atómicas Br 80;K 39 .
Ejercicio 50: El cinc metálico puede reaccionar en medio ácido oxidándose a Zn2+, según
la siguiente reacción redox espontánea:
Zn + 2H+ Zn2+ + H2
¿Qué volumen de hidrógeno medido a 700 mmHg y 77ºC se desprenderá si se disuelven
completamente 0,5 moles de cinc?
Ejercicio 51: El dicromato de potasio, en medio ácido, oxida los iones cloruro hasta cloro
Reduciéndose a sal de cromo (III).
a) ajusta por el método ión-electrón la ecuación iónica que representa el proceso anterior.
b) Calcula cuántos litros de cloro, medidos a 20 º C y 1,5 atm, se pueden obtener si 20 mL
de dicromato de potasio 0,2 M reaccionan con un exceso de cloruro de potasio en medio
ácido.
Ejercicio 52: Igualar las siguientes ecuaciones en medio básico por el método del ion
electrón.
a) Permanganato de potasio + sulfito de sodio + agua dióxido de manganeso +
sulfato de sodio + hidróxido de potasio
b) La reacción entre el permanganato de potasio y el yoduro de potasio en
presencia de hidróxido de potasio acuoso conduce a la formación de manganato
de potasio, yodato de potasio y agua.
c) Trioxonitrato (V) de potasio + monóxido de manganeso + hidróxido de
potasio tetraoxomanganato (VI) de potasio + dioxonitrato (III) de potasio +
agua
d) KCrO2 + KClO + KOH K2CrO4 + KCl + H2O
e) MnO2 + KClO3 + KOH K2MnO4 + KCl + H2O
f) Br2 + KOH KBr + KBrO3 + H2O
g) KMnO4 + NH3 KNO3 + MnO2 + KOH + H2O
Ing. Silvia Cristina Ibáñez Página 7
Descargado por Alejandro Chocobar (achocobar808@gmail.com)
También podría gustarte
- Reacciones redox de permanganato y sulfato de hierroDocumento8 páginasReacciones redox de permanganato y sulfato de hierroAcademia SanRoqueAún no hay calificaciones
- Ejercicios RedoxDocumento13 páginasEjercicios RedoxJusta CAÑIBANO PALMEROAún no hay calificaciones
- Red OxDocumento4 páginasRed OxPaola Alba MagrizAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Ej 05 SolDocumento13 páginasEj 05 Soljrb7590Aún no hay calificaciones
- Caracterización química, morfológica y estructural de materialesDe EverandCaracterización química, morfológica y estructural de materialesAún no hay calificaciones
- 10-Selectividad Redox AjusteDocumento2 páginas10-Selectividad Redox AjusteAnonymous Tgt3vyGIAún no hay calificaciones
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Q08 Rédoxypilas PRINTDocumento20 páginasQ08 Rédoxypilas PRINTPatricioL'HuissierAún no hay calificaciones
- Redox BatDocumento4 páginasRedox BatYOAún no hay calificaciones
- Guía de Problemas Química InorgánicaDocumento9 páginasGuía de Problemas Química InorgánicaNora Cadenillas FernàndezAún no hay calificaciones
- Problemas para El II ExamenDocumento22 páginasProblemas para El II Examenjjqv_22Aún no hay calificaciones
- Redox. Ejercicios EvAUDocumento8 páginasRedox. Ejercicios EvAUmartaAún no hay calificaciones
- Ejercicios Esteq - RedoxDocumento2 páginasEjercicios Esteq - RedoxGian GiancarlosAún no hay calificaciones
- Ejercicios redox solucionesDocumento5 páginasEjercicios redox solucionesSuyapa Sierra AgueroAún no hay calificaciones
- Ejercicios redox solucionesDocumento5 páginasEjercicios redox solucionesFernando RamirezAún no hay calificaciones
- Guía Taller N°5Documento3 páginasGuía Taller N°5pipe147Aún no hay calificaciones
- EjercT7logseREDOX (Estan Muy Bien)Documento8 páginasEjercT7logseREDOX (Estan Muy Bien)Ana PérezAún no hay calificaciones
- Electro Qu Í MicaDocumento3 páginasElectro Qu Í MicaLeandro SchmidtAún no hay calificaciones
- Q7 PAU ElectroquímicaDocumento7 páginasQ7 PAU ElectroquímicaAdrian Cea ManjonAún no hay calificaciones
- Ficha 9 RedoxDocumento1 páginaFicha 9 RedoxSergio SanchezAún no hay calificaciones
- BA Estequiometrà A 3Documento2 páginasBA Estequiometrà A 3Lucia MartinAún no hay calificaciones
- Reacciones RedoxDocumento7 páginasReacciones RedoxAnonymous NdznmUoAún no hay calificaciones
- Ejercicios Esteq - Redox 2011 VDocumento2 páginasEjercicios Esteq - Redox 2011 VLuis Jesus Carbajal LozanoAún no hay calificaciones
- Redox 2013Documento1 páginaRedox 2013Claudia Alvarez GonzalezAún no hay calificaciones
- 4 RedoxDocumento5 páginas4 Redoxoskarg4420Aún no hay calificaciones
- Volredox 2009Documento4 páginasVolredox 2009Bryan SantiagoAún no hay calificaciones
- Q7-PAU-ElectroquímicaDocumento23 páginasQ7-PAU-Electroquímicaalexandra28092005larisadavidAún no hay calificaciones
- Redox SelecDocumento2 páginasRedox Selecapi-3722779100% (1)
- Ejercicios Redox Con SolucionDocumento3 páginasEjercicios Redox Con SolucionPRUEBA 54Aún no hay calificaciones
- Taller Calificado 01 - Sem 4 - Ses 4Documento9 páginasTaller Calificado 01 - Sem 4 - Ses 4Stephanie Paz Reategui100% (1)
- Equilibrio RedoxDocumento2 páginasEquilibrio RedoxMarta VinesAún no hay calificaciones
- BancoPreguntas2doParcialQuimica 2-2011 PDFDocumento12 páginasBancoPreguntas2doParcialQuimica 2-2011 PDFJairo Martínez100% (1)
- Ejercicios Reacciones Redox Evau Castilla La ManchaDocumento7 páginasEjercicios Reacciones Redox Evau Castilla La ManchaJavier Marti AndreuAún no hay calificaciones
- Ejercicios Repaso EstequiometríaDocumento4 páginasEjercicios Repaso EstequiometríacarlotaarosaAún no hay calificaciones
- PAU Oxidación ReducciónDocumento1 páginaPAU Oxidación Reducciónchenxi vales ferreñoAún no hay calificaciones
- EstequiometriaDocumento3 páginasEstequiometriaCarla Pascual EsclapezAún no hay calificaciones
- Ejercicios Estequiometria 1-83Documento4 páginasEjercicios Estequiometria 1-83MariaAún no hay calificaciones
- Ficha EjerciciosDocumento2 páginasFicha EjercicioskarmaAún no hay calificaciones
- Ejercicios Redox RepasoDocumento2 páginasEjercicios Redox RepasoPaqui Alonso MingoranceAún no hay calificaciones
- Calculos EstequiométricosDocumento5 páginasCalculos EstequiométricosPaula Medal MartínezAún no hay calificaciones
- EstequiometriaDocumento4 páginasEstequiometriaJuan ManuelAún no hay calificaciones
- Problemas REDOX 1 - PQ1 (PRINCIPIOS DE QUIMICA I) - FACULTAD DE CIENCIAS - UCV (UNIVERSIDAD CENTRAL DE VENEZUELA)Documento2 páginasProblemas REDOX 1 - PQ1 (PRINCIPIOS DE QUIMICA I) - FACULTAD DE CIENCIAS - UCV (UNIVERSIDAD CENTRAL DE VENEZUELA)WILMOISAún no hay calificaciones
- Ejercicios de Balanceo Por Metodo Oxido Reduccion y EstequiometriaDocumento3 páginasEjercicios de Balanceo Por Metodo Oxido Reduccion y EstequiometriaJuan MenesesAún no hay calificaciones
- Ejercicios-REDOX-1-5Documento1 páginaEjercicios-REDOX-1-5Ángela RodríguezAún no hay calificaciones
- Reacciones QuimicasDocumento4 páginasReacciones QuimicasAriadne VillarroelAún no hay calificaciones
- Ejercicios Redox Con SolucionDocumento3 páginasEjercicios Redox Con SolucionAdriana SilvaAún no hay calificaciones
- Selectividad Redox Desde 2009Documento18 páginasSelectividad Redox Desde 2009P M RAún no hay calificaciones
- Química - Hoja 4aDocumento2 páginasQuímica - Hoja 4aPedroAún no hay calificaciones
- Segundo Taller - Conceptos Básicos de Equilibrio y GravimetríaDocumento4 páginasSegundo Taller - Conceptos Básicos de Equilibrio y Gravimetría'Sebastian OrtizAún no hay calificaciones
- S01.s1 - Ejercicios para Resolver-Reacciones RedoxDocumento2 páginasS01.s1 - Ejercicios para Resolver-Reacciones Redoxriquy82456Aún no hay calificaciones
- BA Estequiometrà A 1Documento2 páginasBA Estequiometrà A 1Lucia MartinAún no hay calificaciones
- Cálculos de estequiometría con solución 1o BachDocumento6 páginasCálculos de estequiometría con solución 1o BachJosé LuisAún no hay calificaciones
- S03.s1 - Material ComplementarioDocumento9 páginasS03.s1 - Material ComplementariojuancitoAún no hay calificaciones
- Cálculos con masas y volúmenes en reacciones químicasDocumento5 páginasCálculos con masas y volúmenes en reacciones químicasRamirez Brizuela JoseAún no hay calificaciones
- Tema1. Repaso Conceptos BásicosDocumento8 páginasTema1. Repaso Conceptos BásicosJavierfyqAún no hay calificaciones
- Química IIº Guía 8 Scarlett Valenzuela y Lidia Alvarado PDFDocumento5 páginasQuímica IIº Guía 8 Scarlett Valenzuela y Lidia Alvarado PDFCésarCoñocarAún no hay calificaciones
- So Luci OnesDocumento6 páginasSo Luci OnesMauro Alejandro ChocobarAún no hay calificaciones
- TP - Museo 2023Documento1 páginaTP - Museo 2023Mauro Alejandro ChocobarAún no hay calificaciones
- 03 HerbarioDocumento14 páginas03 HerbarioMauro Alejandro ChocobarAún no hay calificaciones
- Catalogo JuguetesDocumento94 páginasCatalogo JuguetesJosué AlviaAún no hay calificaciones
- Quiz - Escenario 3 - SEGUNDO BLOQUE-TEORICO - VIRTUAL - CULTURA AMBIENTAL - (GRUPO B10)Documento8 páginasQuiz - Escenario 3 - SEGUNDO BLOQUE-TEORICO - VIRTUAL - CULTURA AMBIENTAL - (GRUPO B10)Maria fernanda G CubillosAún no hay calificaciones
- Lorentz, 1878. La Vegetación Del Noroeste de La Provincia de Entre RiosDocumento11 páginasLorentz, 1878. La Vegetación Del Noroeste de La Provincia de Entre RiosFernando Julio BioléAún no hay calificaciones
- 3º Basicos Ciencias Naturales Guia 9 Paula CabezasDocumento6 páginas3º Basicos Ciencias Naturales Guia 9 Paula CabezasJuan José BugueñoAún no hay calificaciones
- Relatos Sobre Argentina S Gonorasky Nro8Documento5 páginasRelatos Sobre Argentina S Gonorasky Nro8JAVIYAROSAún no hay calificaciones
- Modulo Iii El Divorcio CausalesDocumento33 páginasModulo Iii El Divorcio CausalesVasquez Villanueva Nieves HeydiAún no hay calificaciones
- Actividad 1 Tema 1Documento5 páginasActividad 1 Tema 1Rolando RolesAún no hay calificaciones
- Constancia de Aptitus de Trabajo Soncco Humpire YeniferDocumento1 páginaConstancia de Aptitus de Trabajo Soncco Humpire YeniferGRUPO HM SUMITASAún no hay calificaciones
- Canvas ESDocumento8 páginasCanvas ESPersona125Aún no hay calificaciones
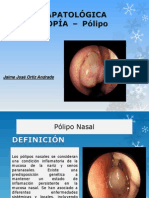
- ANATOMÍAPATOLÓGICA MACROSCOPÍA - Polipo NasalesDocumento9 páginasANATOMÍAPATOLÓGICA MACROSCOPÍA - Polipo NasalesJaime Jose Ortiz AndradeAún no hay calificaciones
- Prueba Unidad 1 Abril OkDocumento7 páginasPrueba Unidad 1 Abril OkDoris Martínez AlarcónAún no hay calificaciones
- El Amor y La InfidelidadDocumento27 páginasEl Amor y La InfidelidadJulissa Rosa Castro CastroAún no hay calificaciones
- Guia de Alimentos para SopDocumento2 páginasGuia de Alimentos para SopArianaAún no hay calificaciones
- Valvula de Dirección OrbitrolDocumento13 páginasValvula de Dirección OrbitrolTabare Yegros85% (20)
- Caílculo de IluminacionDocumento3 páginasCaílculo de Iluminacionjohana arismendiAún no hay calificaciones
- FlujogramaDocumento4 páginasFlujogramaEdwar MarquezAún no hay calificaciones
- La Tiendita de La EsquinaDocumento19 páginasLa Tiendita de La EsquinaFabiola ContrerasAún no hay calificaciones
- Manual Del FacilitadorDocumento24 páginasManual Del Facilitadorandrevega100% (1)
- Cefalea AlturaDocumento8 páginasCefalea AlturaMauricio GaeteAún no hay calificaciones
- Organizador VisualDocumento5 páginasOrganizador Visualgemm91monAún no hay calificaciones
- Formulación Clínica de CasoDocumento11 páginasFormulación Clínica de CasoAna Catalina Sanchez CanoAún no hay calificaciones
- Quirurgica PinzasDocumento8 páginasQuirurgica PinzasCrisGuzAún no hay calificaciones
- Contactos Mujeres Vallecas Gratis en MadridDocumento4 páginasContactos Mujeres Vallecas Gratis en MadridConocer mujeres en MadridAún no hay calificaciones
- AnamnesisDocumento9 páginasAnamnesisAngelica Reyes RodriguezAún no hay calificaciones
- FT Jake 200-SLDocumento2 páginasFT Jake 200-SLJhon CristhianAún no hay calificaciones
- AmoxicilinaDocumento9 páginasAmoxicilinaHappy Day100% (1)
- Bolted Bonnet EspDocumento39 páginasBolted Bonnet EspJhoni Manuel Rosado CuellarAún no hay calificaciones
- Masaje facial: beneficios y técnicasDocumento25 páginasMasaje facial: beneficios y técnicasJoliss Kitty Briones50% (2)
- Exposición Final PRODUC. QUESO UltimoDocumento28 páginasExposición Final PRODUC. QUESO UltimoJOSE ANTONIO VALDEZ UTURUNCOAún no hay calificaciones
- Resolución CABA 655Documento4 páginasResolución CABA 655Martin Perez AntelafAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Desastres y emergencias. Prevención, mitigación y preparaciónDe EverandDesastres y emergencias. Prevención, mitigación y preparaciónCalificación: 4 de 5 estrellas4/5 (5)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Borges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonDe EverandBorges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonCalificación: 5 de 5 estrellas5/5 (4)
- Cómo hacer aviones de papel y otros objetos voladoresDe EverandCómo hacer aviones de papel y otros objetos voladoresAún no hay calificaciones
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Notas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesDe EverandNotas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesAún no hay calificaciones
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Trucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasDe EverandTrucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- El cerebro del niño explicado a los padresDe EverandEl cerebro del niño explicado a los padresCalificación: 4.5 de 5 estrellas4.5/5 (147)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)