Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejemplos Leyes de Los Gases
Cargado por
nancy pittiDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ejemplos Leyes de Los Gases
Cargado por
nancy pittiCopyright:
Formatos disponibles
Ejemplos de Problemas Leyes de los Gases
Ley de Boyle:
P1V1 = P2V2 No hay cambio en el número de moles ni en la temperatura
Figura 1: Conforme el volumen disminuye, las moléculas de gas se amontonan más, lo que produce un
aumento de presión. la presión (P) y el volumen (V) guardan una relación inversa.
Ejemplo 1: ¿Cómo calcular el volumen cuando cambia la presión?
Ley de Charles:
V1 V2
= No hay cambio en el número de moles ni en la presión
T1 T2
Todas las temperaturas utilizadas en los cálculos de leyes de gas deben convertirse a sus
correspondientes temperaturas Kelvin (K).
Figura 2: La temperatura Kelvin de un gas guarda una relación directa con el volumen del gas cuando no hay
ningún cambio ni en la presión ni en la cantidad de gas. Cuando la temperatura aumenta, lo que hace que las
moléculas se muevan más rápido, el volumen debe aumentar para mantener la presión constante.
Ejemplo 2: ¿Cómo calcular el volumen cuando la temperatura cambia?
Ley de Gay-Lussac:
P1 P2
= No cambian el número de moles ni el volumen.
T1 T2
Todas las temperaturas utilizadas en los cálculos de ley de gas deben convertirse en sus
correspondientes temperaturas Kelvin (K).
Figura 3: Cuando la temperatura Kelvin de un gas se duplica con un volumen y una cantidad de gas
constantes, la presión también se duplica
Ejemplo 3: ¿Cómo calcular la presión cuando cambia la temperatura?
Ley Combinada de los Gases:
P1 V 1 P2 V 2
= No cambian los moles del gas
T1 T2
Figura 4: Al usar la ley general de los gases, es posible
derivar cualquiera de las leyes de gas al omitir aquellas
propiedades que no cambian, como se observa en la
tabla 7.6.
Ejemplo 4: ¿Cómo usar la ley combinada de los gases?
Ley de Avogadro:
V1 V2
= No cambian ni presión ni temperatura
n1 n2
Figura 5: El volumen de un gas es directamente proporcional al número de moles del gas. Si el número
de moles se duplica, el volumen debe duplicarse a presión y temperatura constantes.
Ejemplo 5: ¿Cómo calcular el volumen cuando hay un cambio en moles?
Ley del gas ideal:
PV = nRT Al reordenar la ecuación de la ley del gas ideal se observa que las cuatro propiedades de los gases son iguales a
PV
una constante R. =R
nT
Figura 6: La ley del gas ideal es una expresión útil cuando se
proporcionan los valores para cualesquiera tres de las cuatro
propiedades de un gas. Al resolver problemas con el uso de la ley
del gas ideal, las unidades de cada variable tienen que coincidir
con las unidades en la R que seleccione.
Ejemplo 6: ¿Cómo usar la ley del gas ideal?
Resuelve en tu cuaderno: El butano, C4H10, se utiliza como combustible para parrilladas (asados) y como propulsor de aerosol. Si tiene
108 mL de butano a 715 mmHg y 25 °C, ¿cuál es la masa, en gramos, del butano? R./ 0,241 g de C 4H10
Recuerda:
g g
MM = n= MM = masa molar G = gramos n = moles
n MM
También podría gustarte
- Evaluacion Quimica Decimo Segundo BimestreDocumento2 páginasEvaluacion Quimica Decimo Segundo BimestreLuis Santiago Saldaña LozanoAún no hay calificaciones
- Guia de Leyes de Los GasesDocumento2 páginasGuia de Leyes de Los GasesLeonardo Campos100% (1)
- Tabla Periódica, Configuración Electrónica y Enlace Químico de Los ElementosDocumento4 páginasTabla Periódica, Configuración Electrónica y Enlace Químico de Los Elementosvladimir divasAún no hay calificaciones
- Taller Tabla PeriodicaDocumento1 páginaTaller Tabla PeriodicaLoren RamirezAún no hay calificaciones
- Guia Sexto 2Documento13 páginasGuia Sexto 2AURAAún no hay calificaciones
- Taller Leyes de MendelDocumento1 páginaTaller Leyes de MendelJULIO SARMIENTOAún no hay calificaciones
- Taller Aplicacion Leyes de Los Gases 9-2Documento2 páginasTaller Aplicacion Leyes de Los Gases 9-2Ana giselleAún no hay calificaciones
- RQ 2Documento9 páginasRQ 2Lena Churata SalcedoAún no hay calificaciones
- Guia N°2 Enlace QuimicoDocumento5 páginasGuia N°2 Enlace QuimicoJake Mate100% (1)
- Guia de Soluciones Molaridad y MDocumento1 páginaGuia de Soluciones Molaridad y MJake MateAún no hay calificaciones
- Química EstequiometríaDocumento9 páginasQuímica EstequiometríaYasna Vargas PeñalozaAún no hay calificaciones
- Guía de Ejercicios Ley de GasesDocumento5 páginasGuía de Ejercicios Ley de GasesLee EdwardsAún no hay calificaciones
- Resumen Tabla Periódica PDFDocumento9 páginasResumen Tabla Periódica PDFEstefania Ortiz AriasAún no hay calificaciones
- Evaluacion Enlace Quimico DecimoDocumento2 páginasEvaluacion Enlace Quimico DecimoLADY CAROLINA PUERTO SÁNCHEZAún no hay calificaciones
- Guía 1 Leyes de Los GasesDocumento4 páginasGuía 1 Leyes de Los GasesSol OlAún no hay calificaciones
- CB33-11 Disoluciones II 2015 PDFDocumento12 páginasCB33-11 Disoluciones II 2015 PDFFeña Ibarra FuentesAún no hay calificaciones
- Los GasesDocumento4 páginasLos Gasespaorodi8601Aún no hay calificaciones
- Hibridacion Geomteria Molecular Polaridad de Moleculas Fuerzas IntermolecularesDocumento6 páginasHibridacion Geomteria Molecular Polaridad de Moleculas Fuerzas IntermolecularesJean PaúlAún no hay calificaciones
- Taller de Introduccion A La Quimica OrganicaDocumento13 páginasTaller de Introduccion A La Quimica OrganicaStephany BermúdezAún no hay calificaciones
- Comunicacion Celular Aula VirtualDocumento34 páginasComunicacion Celular Aula VirtualGrover Manuel Rivera CayutuiroAún no hay calificaciones
- Leyes PonderalesDocumento17 páginasLeyes PonderalesConstanza Rojos AlmunaAún no hay calificaciones
- Evaluación de QuímicaDocumento2 páginasEvaluación de QuímicabeamAún no hay calificaciones
- Prueba Química Orgánica 1 CepechDocumento3 páginasPrueba Química Orgánica 1 CepechFrancisco AlexisAún no hay calificaciones
- Guia Septimos - Elementos y CompuestosDocumento3 páginasGuia Septimos - Elementos y CompuestosLucia Honores CarvajalAún no hay calificaciones
- Actividades de La Asignatura de QuimicaDocumento1 páginaActividades de La Asignatura de QuimicaJOSE LUIS RUIZ AVILAAún no hay calificaciones
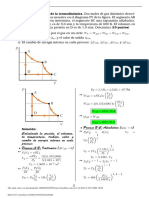
- Primera Ley de La Temrodinamica.Documento4 páginasPrimera Ley de La Temrodinamica.Alvaro Vasquez Flores100% (1)
- 6° Basico Ciencias Naturales Calor y TemperaturaDocumento13 páginas6° Basico Ciencias Naturales Calor y TemperaturaINGRID LIZETH VERA ESCOBEDOAún no hay calificaciones
- Taller No 011 Sistema Endocrino-HormonasDocumento6 páginasTaller No 011 Sistema Endocrino-HormonasFREDDYS71010% (1)
- 2) Números Cuánticos y Configuración ElectrónicaDocumento12 páginas2) Números Cuánticos y Configuración ElectrónicaUnozxcv DoszxcAún no hay calificaciones
- Teoria y Ejercicios Nomenclatura, Reacciones, Estequiometria, Electroquimica PDFDocumento33 páginasTeoria y Ejercicios Nomenclatura, Reacciones, Estequiometria, Electroquimica PDFAderly PacoAún no hay calificaciones
- Tabla PeriodicaDocumento4 páginasTabla PeriodicaJimena Vasquez SilvaAún no hay calificaciones
- 111 Prueba Cuarto Medio RedoxDocumento5 páginas111 Prueba Cuarto Medio RedoxdanielaAún no hay calificaciones
- Nomenclatura química inorgánicaDocumento26 páginasNomenclatura química inorgánicaNubia Patricia Parada Rivera100% (1)
- Balanceo de EcuacionesDocumento5 páginasBalanceo de EcuacionesRolando Martìnez AguilarAún no hay calificaciones
- Estequiometria EjerciciosDocumento1 páginaEstequiometria EjerciciosRocío RamírezAún no hay calificaciones
- Quiz Cuarto Periodo DecimoDocumento1 páginaQuiz Cuarto Periodo DecimoJohan Alx RianhosAún no hay calificaciones
- Guia ADN 4 Medio - 2014Documento5 páginasGuia ADN 4 Medio - 2014Berny Barraza VegaAún no hay calificaciones
- Guía de Ejercicios - MagnitudesDocumento2 páginasGuía de Ejercicios - MagnitudesLuna MigdalAún no hay calificaciones
- Química Números Cuánticos Configuración Electrónica Fusión Reg 1-2 TareaDocumento2 páginasQuímica Números Cuánticos Configuración Electrónica Fusión Reg 1-2 TareaDiana Elizabeth ZVillanuevaAún no hay calificaciones
- Guía Química Orgánica Segundo CicloDocumento17 páginasGuía Química Orgánica Segundo CicloSummy Teniente ArcondoAún no hay calificaciones
- Oxidos básicos: nomenclatura química inorgánicaDocumento3 páginasOxidos básicos: nomenclatura química inorgánicaEna Margarita Mercado OlmosAún no hay calificaciones
- Tema 4 GasesDocumento25 páginasTema 4 GasesDasigo SzkamardaAún no hay calificaciones
- 2P Transporte de Sustancias Celulares 2Documento2 páginas2P Transporte de Sustancias Celulares 2Danna RomeroAún no hay calificaciones
- Determinar HCl comercialDocumento4 páginasDeterminar HCl comercialCarlos Miranda CastilloAún no hay calificaciones
- Ejercicios de TablaDocumento8 páginasEjercicios de TablaceilingfAún no hay calificaciones
- Clase MagnitudesDocumento18 páginasClase MagnitudesAnalia GimenezAún no hay calificaciones
- Leyes PonderalesDocumento39 páginasLeyes PonderalesJorge Gonzalez100% (1)
- Modelos atómicos Dalton Rutherford BohrDocumento3 páginasModelos atómicos Dalton Rutherford BohrmitzipachecolaurinAún no hay calificaciones
- Miniensayo Números Cuánticos y Configuración ElectrónicaDocumento4 páginasMiniensayo Números Cuánticos y Configuración ElectrónicaPamelaAún no hay calificaciones
- Tema 3 El Enlace QuímicoDocumento4 páginasTema 3 El Enlace QuímicoROCIOAún no hay calificaciones
- Clase 1 Electricidad IDocumento29 páginasClase 1 Electricidad IfvrodriguezcAún no hay calificaciones
- Examen Modelos AtomicosDocumento3 páginasExamen Modelos AtomicostereAún no hay calificaciones
- Módulo Tabla PeriódicaDocumento18 páginasMódulo Tabla PeriódicaEC Maria50% (2)
- Taller 11Documento12 páginasTaller 11Yo No MasAún no hay calificaciones
- Resumen de Enlace Químico 1Documento9 páginasResumen de Enlace Químico 1SRL FotografíaAún no hay calificaciones
- Guia 1 Disoluciones 2 MedioDocumento6 páginasGuia 1 Disoluciones 2 MedioFelipe Alejandro JaraAún no hay calificaciones
- Evaluación ColoidesDocumento8 páginasEvaluación ColoidesAnnie CabreraAún no hay calificaciones
- Clase 19 CB33 Nomenclatura de Hidrocarburos 2017Documento30 páginasClase 19 CB33 Nomenclatura de Hidrocarburos 2017franciaAún no hay calificaciones
- Modulo de Quimica 11º 3Documento19 páginasModulo de Quimica 11º 3Moises ObregonAún no hay calificaciones
- Gases Ideales y Sus LeyesDocumento7 páginasGases Ideales y Sus LeyesMarlene SotoAún no hay calificaciones
- Masa Molar y Balanceo de EcuacionesDocumento3 páginasMasa Molar y Balanceo de Ecuacionesnancy pittiAún no hay calificaciones
- Trabajo Final 1Documento16 páginasTrabajo Final 1nancy pittiAún no hay calificaciones
- Ganaderia Unidad 1 Sector LacteoDocumento12 páginasGanaderia Unidad 1 Sector Lacteonancy pittiAún no hay calificaciones
- Categorias GramaticalesDocumento1 páginaCategorias Gramaticalesnancy pittiAún no hay calificaciones
- No Quiero Ser MillonarioDocumento12 páginasNo Quiero Ser Millonarionancy pittiAún no hay calificaciones
- Estequiometria de ReaccionesDocumento7 páginasEstequiometria de Reaccionesnancy pittiAún no hay calificaciones
- Módulo (Óptica) - 2023Documento28 páginasMódulo (Óptica) - 2023nancy pittiAún no hay calificaciones
- La Seguridad EnergéticaDocumento9 páginasLa Seguridad Energéticanancy pittiAún no hay calificaciones
- El Canal de PanamaDocumento3 páginasEl Canal de Panamanancy pittiAún no hay calificaciones
- PilotesDocumento11 páginasPilotesnancy pittiAún no hay calificaciones
- Diferencia Entre Valor Presente Neto y La Tasa de RetornoDocumento2 páginasDiferencia Entre Valor Presente Neto y La Tasa de Retornonancy pittiAún no hay calificaciones
- Lenguaje de La QuimicaDocumento4 páginasLenguaje de La Quimicanancy pittiAún no hay calificaciones
- Modulo Historia de Panamá 11º - 3Documento34 páginasModulo Historia de Panamá 11º - 3nancy pittiAún no hay calificaciones
- 1.1. Nomenclatura Iones Monoatómicos y PoliatómicosDocumento3 páginas1.1. Nomenclatura Iones Monoatómicos y Poliatómicosnancy pittiAún no hay calificaciones
- Danzas Folcloricas de ChiriquíDocumento11 páginasDanzas Folcloricas de Chiriquínancy pittiAún no hay calificaciones
- Tema Estequiometría de Fórmulas Parte IDocumento6 páginasTema Estequiometría de Fórmulas Parte Inancy pittiAún no hay calificaciones
- Enlace MetálicoDocumento1 páginaEnlace Metáliconancy pittiAún no hay calificaciones
- Estructura Del Informe de LaboratorioDocumento2 páginasEstructura Del Informe de Laboratorionancy pittiAún no hay calificaciones
- Nociones de ComercioDocumento14 páginasNociones de Comercionancy pittiAún no hay calificaciones
- Modulo Historia de Panamá 11º - I TrimestreDocumento16 páginasModulo Historia de Panamá 11º - I Trimestrenancy pitti100% (2)
- Nomenclatura InorgánicaDocumento11 páginasNomenclatura Inorgánicanancy pittiAún no hay calificaciones
- Tema 2 para 11 - FotosintesisDocumento6 páginasTema 2 para 11 - Fotosintesisnancy pittiAún no hay calificaciones
- Geometría MolecularDocumento7 páginasGeometría Molecularnancy pitti0% (1)
- Arnulfo AriasDocumento19 páginasArnulfo Ariasnancy pittiAún no hay calificaciones
- Trabajo Final Historia de PanamaDocumento2 páginasTrabajo Final Historia de Panamanancy pittiAún no hay calificaciones
- Trabajo Final Historia de PanamaDocumento2 páginasTrabajo Final Historia de Panamanancy pittiAún no hay calificaciones
- Vida y Arquitectura de Los EgipciosDocumento4 páginasVida y Arquitectura de Los Egipciosnancy pittiAún no hay calificaciones
- Enlaces Químicos y Enlace IónicoDocumento5 páginasEnlaces Químicos y Enlace Ióniconancy pittiAún no hay calificaciones
- Trabajo Historia de PanamáDocumento16 páginasTrabajo Historia de Panamánancy pittiAún no hay calificaciones
- 1era Tarea Meteorologia (Marian Espiritu)Documento7 páginas1era Tarea Meteorologia (Marian Espiritu)MariianStefanyEaAún no hay calificaciones
- TALLER No 2Documento4 páginasTALLER No 2Johan felipe VillalobosAún no hay calificaciones
- Unidad 3Documento5 páginasUnidad 3Guadalupe Andrea BiazisoAún no hay calificaciones
- Discovery: PruebaDocumento28 páginasDiscovery: PruebaPAULA RIOSAún no hay calificaciones
- Guia Estudio MeteorologiaDocumento3 páginasGuia Estudio MeteorologiaBryan Perez VallartaAún no hay calificaciones
- Localización y Climas de La Tierra de Canaán-IsraelDocumento6 páginasLocalización y Climas de La Tierra de Canaán-IsraelDiego Jose Renteria LascanoAún no hay calificaciones
- PortfDocumento6 páginasPortfAnndy YunAún no hay calificaciones
- Manual de Espacios ConfinadosDocumento32 páginasManual de Espacios ConfinadosWilberZanga100% (2)
- Escenarios AR5Documento57 páginasEscenarios AR5ANGELA MARIA PEDROZA NUÑEZAún no hay calificaciones
- Antecedentes Del Cambio ClimáticoDocumento3 páginasAntecedentes Del Cambio ClimáticofrancisxoAún no hay calificaciones
- Ejercicios Leyes de Los GasesDocumento25 páginasEjercicios Leyes de Los GasesKAREN DANIELA SANCHEZ GARCIAAún no hay calificaciones
- Examen de Aspen Hysys V.8.8Documento1 páginaExamen de Aspen Hysys V.8.8Neyla0% (1)
- T3 SanitariasDocumento28 páginasT3 SanitariasAndy Alex Mestanza MinaAún no hay calificaciones
- Ciclo Del Agua - RaquelOliveros - 501Documento2 páginasCiclo Del Agua - RaquelOliveros - 501Indira Raquel Oliveros CruzAún no hay calificaciones
- Viscosidad de Los GasesDocumento13 páginasViscosidad de Los GasesINGRITH STEFANY CHAVEZ ALARC�NAún no hay calificaciones
- Termo03 PDFDocumento2 páginasTermo03 PDFErick Uriel Sánchez CastilloAún no hay calificaciones
- 5.5 Aplicaciones A Problemas de Mecanica de FluidosDocumento12 páginas5.5 Aplicaciones A Problemas de Mecanica de FluidosFrancisco Hernandez100% (1)
- Unidad2 Tarea 3 Soluciones y GasesDocumento8 páginasUnidad2 Tarea 3 Soluciones y Gasescamila fernanda rincon gonzalezAún no hay calificaciones
- EXPERIMENTO El Efecto de La Presion Atmosferica 3IM43 1Documento23 páginasEXPERIMENTO El Efecto de La Presion Atmosferica 3IM43 1Armando MillerAún no hay calificaciones
- Typ 2Documento26 páginasTyp 2Gerardo LandaverdeAún no hay calificaciones
- Taller 1 Diferencia de Presión (Grupal)Documento9 páginasTaller 1 Diferencia de Presión (Grupal)Ashley Aranea100% (1)
- Sistema SolarDocumento3 páginasSistema SolarSandy KanaAún no hay calificaciones
- Examen de Climatologia II 2Documento2 páginasExamen de Climatologia II 2delvis sanchez diasAún no hay calificaciones
- Metar 27 NSGDocumento8 páginasMetar 27 NSGNICOLAS SANCHEZ GOMEZAún no hay calificaciones
- Ejercicios 2Documento4 páginasEjercicios 2Kennieth OjedaAún no hay calificaciones
- T2 - Informe + IntroduccionDocumento30 páginasT2 - Informe + IntroduccionOsmar M MiAún no hay calificaciones
- Clima y precipitación del municipio de YacuanquerDocumento44 páginasClima y precipitación del municipio de YacuanquerJhon SebastianAún no hay calificaciones
- Comportamiento Del FuegoDocumento10 páginasComportamiento Del FuegomaykerliconAún no hay calificaciones
- Tarea de Investigación MarioDocumento4 páginasTarea de Investigación MarioEstevin Santiago ReyesAún no hay calificaciones
- Analisis de La Presión AtmosfericaDocumento10 páginasAnalisis de La Presión AtmosfericaDORIAN JOAQUIN FASABI APAZAAún no hay calificaciones