Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Modelos Atómicos
Cargado por
fred doors0 calificaciones0% encontró este documento útil (0 votos)
10 vistas5 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
10 vistas5 páginasModelos Atómicos
Cargado por
fred doorsCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
Modelo Atómico de Demócrito
La “Teoría Atómica del Universo” fue creada por el filósofo griego Demócrito
junto a su mentor, Leucipo. Esta teoría, no se apoya en resultados
experimentales, sino que se desarrolla mediante razonamientos lógicos, por
ser una teoría filosófica. Demócrito propuso que el mundo estaba formado
por partículas muy pequeñas e indivisibles, de existencia eterna,
homogéneas e incompresibles, cuyas únicas diferencias eran de forma y
tamaño, nunca de funcionamiento interno. Según Demócrito, las propiedades
de la materia varían según el agrupamiento de los átomos.
Modelo Atómico de Dalton
Fue desarrollado a principios de 1800 (se estima, entre 1803 y 1807) por el
científico británico John Dalton. Fue el primer modelo atómico con bases
científicas. A su modelo atómico Dalton lo llamó “Teoría Atómica”). Dalton
proponía que los átomos de un mismo elemento químico eran iguales entre sí y
tenían la misma masa e iguales propiedades. Por otro lado, propuso el
concepto de peso atómico relativo (el peso de cada elemento respecto al peso
del hidrógeno), comparando las masas de cada elemento con la masa del
hidrógeno. También propuso que los átomos pueden combinarse entre sí para
formar compuestos químicos. Más adelante se encontraron errores al modelo
atómico de Dalton.
Modelo Atómico de Lewis: Modelo atómico
cúbico
Esta teoría se desarrolló en 1902 por G. Lewis, el modelo atómico de Lewis
representa al átomo como un cubo, donde los electrones están colocados en
cada uno de los 8 vértices de ese cubo. El Modelo Atómico Cúbico representó
un paso importante hacia el entendimiento del enlace químico, ya que introdujo
el concepto de "valencia de un átomo", es decir, la cantidad de electrones en el
último nivel de energía del átomo que se pondrán en juego en un enlace
químico.
Modelo Atómico de Thomson (o Pudín de Pasas)
Fue desarrollado en 1906 por el científico británico Joseph John "J.J."
Thomson, quien unos años antes había descubierto el electrón. este modelo es
previo al descubrimiento de los protones y neutrones por lo que asumía que el
átomo está compuesto por electrones de carga negativa en un átomo de carga
positiva. Los electrones se hallan incrustados en este al igual que las pasas de
un pudín. Por esta analogía también se lo denomina “Modelo del pudín de
pasas”. Este modelo hacía una predicción incorrecta de la carga positiva en el
átomo, pues afirmaba que esta estaba distribuida por todo el átomo. Más tarde
esto fue corregido en el modelo de Rutherford donde se definió el núcleo
atómico.
Modelo atómico de Rutherford (o Modelo Planetario)
Este modelo fue propuesto en 1911 por el químico y físico británico-
neozelandés Ernest Rutherford. Este científico había desarrollado un
experimento denominado” experimento de la lámina de oro” el cual le permitió
enunciar el modelo atómico. Fue el primer modelo en separar al átomo en dos
zonas: núcleo y corteza. A partir de aquí, se empezaron a estudiar por
separado.
Modelo atómico de Bohr
Fue postulado en 1913 por el físico danés Niels Bohr. Puede considerarse
transicional ya que se ubica entre la mecánica clásica y la cuántica. Incorpora
ideas tomadas del efecto fotoeléctrico, explicado por Einstein.
El modelo de Bohr se resume en tres postulados:
Los electrones trazan órbitas circulares en torno al núcleo sin irradiar
energía.
Las órbitas permitidas a los electrones son aquellas con cierto valor
de momento angular (L) (cantidad de rotación de un objeto) que sea
un múltiplo entero del valor, siendo h=6.6260664×10 -34 y n=1, 2, 3….
Los electrones emiten o absorben energía al saltar de una órbita a
otra y al hacerlo emiten un fotón que representa la diferencia de
energía entre ambas órbitas.
Modelo atómico de Sommerfeld
Fue desarrollado en 1916 por el físico alemán Arnold Sommerfeld,
basándose en la teoría de la relatividad de Albert Einstein, por lo que se dice
que es un modelo atómico relativista. Entre sus modificaciones está la
afirmación de que las órbitas de los electrones fueran circulares o
elípticas, que los electrones tuvieran corrientes eléctricas minúsculas y que a
partir del segundo nivel de energía existieran dos o más subniveles. Hizo
modificaciones al modelo de Bohr. Aun así, sigue siendo válido para el átomo
de Hidrógeno, pero al tratar de explicar el comportamiento de átomos de otros
elementos, presenta insuficiencias.
Si comparamos el modelo atómico de Sommerfeld con el de Bohr,
observamos dos modificaciones básicas:
El modelo de Sommerfeld plantea órbitas casi elípticas para los
electrones. En el modelo de Bohr los electrones sólo giraban en órbitas
circulares. Esto introdujo un nuevo número cuántico: Número cuántico
azimutal (l) que describe la forma de los orbitales.
El modelo atómico de Sommerfeld postula velocidades relativistas.
Modelo atómico de Schrödinger
Propuesto por Erwin Schrödinger a partir de los estudios de Bohr y
Sommerfeld, concebía los electrones como ondulaciones de la materia, lo cual
permitió la formulación posterior de una interpretación probabilística de la
función de onda (magnitud que sirve para describir la probabilidad de encontrar
a una partícula en el espacio) por parte de Max Born. Eso significa que se
puede estudiar probabilísticamente la posición de un electrón o su cantidad
de movimiento pero no ambas cosas a la vez, debido al Principio de
Incertidumbre de Heisenberg. Este es el modelo atómico vigente a inicios del
siglo XXI, con algunas posteriores adiciones. Se le conoce como “Modelo
Cuántico-Ondulatorio”.
¿Cuál es el modelo atómico actual?
Modelo atómico Actual o Modelo Orbital
Este modelo atómico se desarrolló en la década de 1920, como
resultado del aporte de conocimientos de muchos científicos, entre ellos
Broglie, Einstein, Bohr, Schrödinger, Heisenberg. Está basado en la mecánica
cuántica ondulatoria, la cual está fundamentada en los números cuánticos. Los
números cuánticos son 4: n, l, m, s. Sirven para describir cada uno de los
electrones de un átomo. Cabe destacar que, para los electrones de un mismo
átomo, la combinación de estos 4 números nunca es la misma. En esta teoría
se afirma que:
En los átomos, los electrones están distribuidos en niveles de energía
estacionaria o fija.
Los electrones se mueven alrededor del núcleo sin perder ni ganar
energía y sólo lo hacen cuando pasan de un nivel a otro.
Un nivel de energía está formado por igual número de subniveles.
Un subnivel de energía consta de uno o más orbitales o nubes
electrónicas.
Un orbital o nube electrónica se llena con dos electrones con rotación
contraria, es decir, distinto número de spin (número cuántico s).
Gutierrez Vizcarra Melanie Yolanda
También podría gustarte
- Resumen Modelos AtomicosDocumento4 páginasResumen Modelos AtomicosTamara VegaAún no hay calificaciones
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Modelos AtomicosDocumento5 páginasModelos AtomicosDiter VazquezAún no hay calificaciones
- Clase PaolaDocumento6 páginasClase PaolaPaola González JiménezAún no hay calificaciones
- Album Modelos AtomicosDocumento18 páginasAlbum Modelos AtomicosAlan Martínez :vAún no hay calificaciones
- Modelos Atomicos (Keisha)Documento6 páginasModelos Atomicos (Keisha)keisha 99Aún no hay calificaciones
- Modelos AtómicosDocumento7 páginasModelos AtómicosJulia Peralta MeloAún no hay calificaciones
- Modelos AtómicosDocumento7 páginasModelos AtómicosMaricel Rojas0% (1)
- Modelos AtomicosDocumento5 páginasModelos Atomicosjulian.huerta02Aún no hay calificaciones
- Teorías AtómicasDocumento7 páginasTeorías AtómicasMariano BiondiAún no hay calificaciones
- Teorías AtómicasDocumento3 páginasTeorías AtómicasRuth Oré RojasAún no hay calificaciones
- Modelo Atomico A1Documento6 páginasModelo Atomico A1Robert WilliamAún no hay calificaciones
- Los Modelos AtómicosDocumento10 páginasLos Modelos AtómicosNicolasCenaAún no hay calificaciones
- Modelos AtómicosDocumento3 páginasModelos AtómicosDionelsys RodriguezAún no hay calificaciones
- Informe de Los Modelos AtomicosDocumento8 páginasInforme de Los Modelos Atomicosaudio novelas fenAún no hay calificaciones
- Modelos Atómicos Dalton, Thomson, Perrin, Bohr, Sommerfeld y +Documento5 páginasModelos Atómicos Dalton, Thomson, Perrin, Bohr, Sommerfeld y +Martha Estela Martinez BazaAún no hay calificaciones
- Modelos AtómicosDocumento6 páginasModelos AtómicosAxel GonzalezAún no hay calificaciones
- Modelos AtómicosDocumento3 páginasModelos AtómicosJohanna Cortés HurtadoAún no hay calificaciones
- Cuales Son Los Diferentes Modelos Atómicos Que Existen? R/ Existen 8 Que SonDocumento10 páginasCuales Son Los Diferentes Modelos Atómicos Que Existen? R/ Existen 8 Que SonElizabeth MercadoAún no hay calificaciones
- Investigación 1 - Química BásicaDocumento8 páginasInvestigación 1 - Química BásicaJosafat S. TapiaAún no hay calificaciones
- Modelo AtómicoDocumento5 páginasModelo Atómicogabylalo3006Aún no hay calificaciones
- Modelo Atómico de DemócritoDocumento4 páginasModelo Atómico de DemócritoSkarle DiazAún no hay calificaciones
- Modelo AtomicoDocumento6 páginasModelo AtomicoKatia NinaAún no hay calificaciones
- Proyecto Modelo Atómico RutherfordDocumento11 páginasProyecto Modelo Atómico RutherfordAlexander Jhoel Cristiam Pari MaqueAún no hay calificaciones
- Modelos AtomicosDocumento6 páginasModelos AtomicosBy Miguel - clash royal y másAún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos AtomicosFELPA TOVAún no hay calificaciones
- Modelo AtómicoDocumento13 páginasModelo Atómicojavi jimenezAún no hay calificaciones
- Modelos atómicos: evolución de las representaciones del átomoDocumento20 páginasModelos atómicos: evolución de las representaciones del átomoMay MartinezAún no hay calificaciones
- Trabajo practico de modelos atomicos - CopiaDocumento5 páginasTrabajo practico de modelos atomicos - CopiabrandanmariiiiAún no hay calificaciones
- Los Modelos Atómicos Rafael CastilloDocumento3 páginasLos Modelos Atómicos Rafael CastilloRafael CastilloAún no hay calificaciones
- Actividad 3 Fisica 4Documento6 páginasActividad 3 Fisica 4Joel RezaAún no hay calificaciones
- Modelos AtómicosDocumento2 páginasModelos AtómicosSo VAún no hay calificaciones
- Qué Son Los Modelos AtómicosDocumento3 páginasQué Son Los Modelos AtómicosGonzález Bocos Carlos DanielAún no hay calificaciones
- Modelos AtómicosDocumento7 páginasModelos AtómicosGabi MoralesAún no hay calificaciones
- Modelos atómicos evoluciónDocumento5 páginasModelos atómicos evoluciónleydimar0% (1)
- Teorias Atómicas 2021Documento73 páginasTeorias Atómicas 2021EDUCAMOS BarillasAún no hay calificaciones
- Modelos AtomicosDocumento13 páginasModelos AtomicosAngie MendozaAún no hay calificaciones
- 1.-Modelos AtomicosDocumento23 páginas1.-Modelos Atomicosalanalambre2607Aún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosMarco Meneses PlascenciaAún no hay calificaciones
- Block Modelo AtomicoDocumento8 páginasBlock Modelo AtomicoLuis Felipe Menor RojasAún no hay calificaciones
- Modelos Atomicos (Investigación)Documento3 páginasModelos Atomicos (Investigación)Victoria GrayAún no hay calificaciones
- Modelos AtómicosDocumento6 páginasModelos Atómicosmatuteoll06Aún no hay calificaciones
- Sintesis de Modelo AtomicoDocumento4 páginasSintesis de Modelo AtomicoCesar CGAún no hay calificaciones
- Teoría AtómicaDocumento23 páginasTeoría AtómicaCupul Cauich Diego RobertoAún no hay calificaciones
- Modelos AtómicosDocumento6 páginasModelos AtómicosRaulZorrilla100% (1)
- Modelos AtómicosssDocumento6 páginasModelos Atómicosssedhit82coriaAún no hay calificaciones
- Modelos Atómicos: Modelo Atómico de Demócrito (450 A.c.)Documento3 páginasModelos Atómicos: Modelo Atómico de Demócrito (450 A.c.)Andrés VásquezAún no hay calificaciones
- Modelos AtomicosDocumento5 páginasModelos AtomicosAnonymous z8qm8DYCUvAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos Atómicosrocio soledad rodriguezAún no hay calificaciones
- Teoria Atã Mica de DaltonDocumento9 páginasTeoria Atã Mica de DaltonLuz JaraAún no hay calificaciones
- Modelo Atómico de DemócritoDocumento4 páginasModelo Atómico de DemócritoPumba :PAún no hay calificaciones
- Modelos atómicos a través de la historiaDocumento3 páginasModelos atómicos a través de la historiaDeyviss CzzAún no hay calificaciones
- El Modelo Atómico de Demócrito Tiene Los Siguiente EnunciadosDocumento10 páginasEl Modelo Atómico de Demócrito Tiene Los Siguiente EnunciadosNashely PereyraAún no hay calificaciones
- 7 Modelos Atomicos y Cada Uno Con Su ImagenDocumento3 páginas7 Modelos Atomicos y Cada Uno Con Su ImagenNestor ExequielAún no hay calificaciones
- 5to Modelos AtomicosDocumento5 páginas5to Modelos AtomicosDaurys Jesus Jimenez Almonte 20Aún no hay calificaciones
- Sumativa 1, Teoria Atomica, Giovanni RodriguezDocumento13 páginasSumativa 1, Teoria Atomica, Giovanni RodriguezGiovanni RodriguezAún no hay calificaciones
- Modelos AtomicosDocumento10 páginasModelos AtomicosJuan martin CastroAún no hay calificaciones
- Dios Mio Esto Es MuchoDocumento6 páginasDios Mio Esto Es Muchojisder urbinaAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosOrlando Rangel RomeroAún no hay calificaciones
- Carta RecomDocumento1 páginaCarta Recomfred doorsAún no hay calificaciones
- Qué Es La Selva SecaDocumento1 páginaQué Es La Selva Secafred doorsAún no hay calificaciones
- Torque Maximo para Tornillos MMDocumento1 páginaTorque Maximo para Tornillos MMfred doorsAún no hay calificaciones
- Plg-Ta-101-07 - Rev A PDFDocumento1 páginaPlg-Ta-101-07 - Rev A PDFfred doorsAún no hay calificaciones
- GargamelDocumento1 páginaGargamelfred doorsAún no hay calificaciones
- Entrevista FceDocumento3 páginasEntrevista Fcefred doorsAún no hay calificaciones
- MAVS4380PJDocumento2 páginasMAVS4380PJfred doorsAún no hay calificaciones
- VIH sintomas proteccion 40Documento2 páginasVIH sintomas proteccion 40fred doorsAún no hay calificaciones
- Tesis Diseno y Costruccion de AVR para GDocumento17 páginasTesis Diseno y Costruccion de AVR para Gfred doorsAún no hay calificaciones
- CB 47974Documento1 páginaCB 47974fred doorsAún no hay calificaciones
- Radiador Evaporativo 02.01.2020-Cuerpo TraseroDocumento1 páginaRadiador Evaporativo 02.01.2020-Cuerpo Traserofred doorsAún no hay calificaciones
- La historia de Cruella De Vil, la villana obsesionada con la moda de 101 DálmatasDocumento2 páginasLa historia de Cruella De Vil, la villana obsesionada con la moda de 101 Dálmatasfred doorsAún no hay calificaciones
- Radiador Evaporativo 02.01.2020-Cuerpo FrontalDocumento1 páginaRadiador Evaporativo 02.01.2020-Cuerpo Frontalfred doorsAún no hay calificaciones
- Radiador Evaporativo 02.01.2020-OriginalDocumento1 páginaRadiador Evaporativo 02.01.2020-Originalfred doorsAún no hay calificaciones
- Modulo de Arranque Automático 5110 Instrucciones de Operación - 1Documento42 páginasModulo de Arranque Automático 5110 Instrucciones de Operación - 1fred doorsAún no hay calificaciones
- Tub 3 Flux 2102576888Documento1 páginaTub 3 Flux 2102576888fred doorsAún no hay calificaciones
- Planta de AsfaltoDocumento2 páginasPlanta de Asfaltofred doorsAún no hay calificaciones
- Tarifa Applied 2022 Mayo - tcm205 154813Documento21 páginasTarifa Applied 2022 Mayo - tcm205 154813Javier Luna Victoria WenzelAún no hay calificaciones
- Ley de Faraday. Práctica experimentalDocumento6 páginasLey de Faraday. Práctica experimentalNaoko-chan KonichiiwaAún no hay calificaciones
- J 20 Air-Jet Spinning Machine Brochure 2386-V1 Es 34515Documento16 páginasJ 20 Air-Jet Spinning Machine Brochure 2386-V1 Es 34515ED TitoAún no hay calificaciones
- Prueba QuimicaDocumento5 páginasPrueba QuimicaveraAún no hay calificaciones
- AdsorcionDocumento34 páginasAdsorcionJennifer Moran RodriguezAún no hay calificaciones
- Historia Del Codigo AsmeDocumento6 páginasHistoria Del Codigo AsmeLEYNER IGNACIO CORREAAún no hay calificaciones
- Trabajo Autovalores y AutovectoresDocumento17 páginasTrabajo Autovalores y AutovectoresSebastian Pedraza Ramirez50% (2)
- Armas de Fuego CriminalisticaDocumento28 páginasArmas de Fuego CriminalisticaLiliana Margarita Giménez MartinezAún no hay calificaciones
- Prueba Ciencias Sobre Fuerza 7°basicoDocumento3 páginasPrueba Ciencias Sobre Fuerza 7°basicoAlex Mauricio ReyesAún no hay calificaciones
- Estudio Del Trabajo 2 Tiempos PredeterminadosDocumento5 páginasEstudio Del Trabajo 2 Tiempos PredeterminadosJose VidañaAún no hay calificaciones
- Redes de DistribuciónDocumento39 páginasRedes de DistribuciónLUCELY ASRID ESCOBAR ROJASAún no hay calificaciones
- Curso Puentes ColgantesDocumento44 páginasCurso Puentes ColgantesYohell Coba100% (2)
- Segunda Actividad ProgramacionDocumento13 páginasSegunda Actividad ProgramacionPara JugarAún no hay calificaciones
- Metodo de Disolucion de TabletasDocumento144 páginasMetodo de Disolucion de TabletasGiancarlo DlcAún no hay calificaciones
- VigaDocumento6 páginasVigaNegas Faisán de la HuertaAún no hay calificaciones
- Física 3: Semana 12 Óptica OndulatoriaDocumento198 páginasFísica 3: Semana 12 Óptica OndulatoriaSergio RosalesAún no hay calificaciones
- EXAMEN MÓDULO ETABS Y SAFE Solucionado MariaDocumento5 páginasEXAMEN MÓDULO ETABS Y SAFE Solucionado MariaTatiana Carrión SilvaAún no hay calificaciones
- Clasificación metales 40Documento5 páginasClasificación metales 40LION32Aún no hay calificaciones
- SquashDocumento3 páginasSquashjvalenciayAún no hay calificaciones
- Ensayo Sobre La Ley Cero de La TermodinamicaDocumento3 páginasEnsayo Sobre La Ley Cero de La TermodinamicaJhon Fredy Avella Chaparro0% (2)
- Ensayo de Penetración de Cono (CPT)Documento49 páginasEnsayo de Penetración de Cono (CPT)Jordy Juan Ascencio Abarca100% (3)
- Proceso Merrill Crowe para la clarificación y precipitación de oroDocumento102 páginasProceso Merrill Crowe para la clarificación y precipitación de orom100% (3)
- Kouritsuchuu Madoushi Vol 1 PDFDocumento267 páginasKouritsuchuu Madoushi Vol 1 PDFRafael AguilarAún no hay calificaciones
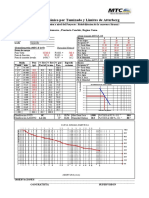
- Análisis Mecánico Por Tamizado y Límites de Atterberg: Granulometría (MTC E 107)Documento12 páginasAnálisis Mecánico Por Tamizado y Límites de Atterberg: Granulometría (MTC E 107)Fiore ChiniAún no hay calificaciones
- Relatoría Individual Historia Del Álgebra LinealDocumento3 páginasRelatoría Individual Historia Del Álgebra LinealBrayan Hernandez DelfinAún no hay calificaciones
- Equipo Didactico HidraulicoDocumento26 páginasEquipo Didactico HidraulicojomafiAún no hay calificaciones
- Aportes Evaluacion Final - Señales y SistemasDocumento4 páginasAportes Evaluacion Final - Señales y SistemasEstudiante UnadAún no hay calificaciones
- Máquina de WimshurstDocumento2 páginasMáquina de WimshurstJordy PumaAún no hay calificaciones
- Respuesta temporal de los SCADocumento9 páginasRespuesta temporal de los SCAGUIDO CHAMBILLA CONDORIAún no hay calificaciones
- Belleza ExpresivaDocumento4 páginasBelleza ExpresivaMarianny M. Rodriguez G100% (2)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Nunca fuimos modernos: Ensayos de antropología simétricaDe EverandNunca fuimos modernos: Ensayos de antropología simétricaAún no hay calificaciones
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Estoicismo y dureza mental: Descubre los secretos psicológicos de la filosofía estoica en la vida moderna. Construir una autodisciplina inquebrantable y hábitos diarios que garanticen el éxitoDe EverandEstoicismo y dureza mental: Descubre los secretos psicológicos de la filosofía estoica en la vida moderna. Construir una autodisciplina inquebrantable y hábitos diarios que garanticen el éxitoCalificación: 4 de 5 estrellas4/5 (23)
- Borges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonDe EverandBorges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonCalificación: 5 de 5 estrellas5/5 (4)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Cálculo infinitesimal: El lenguaje matemático de la naturalezaDe EverandCálculo infinitesimal: El lenguaje matemático de la naturalezaCalificación: 5 de 5 estrellas5/5 (3)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Genética general: Libro de textoDe EverandGenética general: Libro de textoCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Desastres y emergencias. Prevención, mitigación y preparaciónDe EverandDesastres y emergencias. Prevención, mitigación y preparaciónCalificación: 4 de 5 estrellas4/5 (5)
- Estadística básica: Introducción a la estadística con RDe EverandEstadística básica: Introducción a la estadística con RCalificación: 5 de 5 estrellas5/5 (8)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Investigación de operaciones: Conceptos fundamentalesDe EverandInvestigación de operaciones: Conceptos fundamentalesCalificación: 4.5 de 5 estrellas4.5/5 (2)