Documentos de Académico
Documentos de Profesional
Documentos de Cultura
5to Modelos Atomicos
Cargado por
Daurys Jesus Jimenez Almonte 20Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
5to Modelos Atomicos
Cargado por
Daurys Jesus Jimenez Almonte 20Copyright:
Formatos disponibles
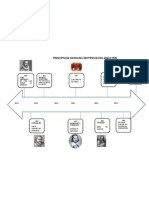
Modelo Atómico de Thomson.
Joseph John Thomson fue un científico británico que descubrió la primera partícula
subatómica, el electrón, que son partículas cargadas negativamente.
Como consecuencia de este descubrimiento, y considerando que aún no se tenía evidencia
del núcleo de átomo, Thomson pensó que los electrones se encontraban inmersos en una
sustancia de carga positiva que contrarrestaba la carga negativa de los electrones. Algo
semejante a tener una gelatina con pasas flotando adentro. Por este motivo a su modelo
atómico se le conoció como el modelo del pudín con pasas.
Este modelo creado en 1904 nunca tuvo una aceptación académica generalizada y fue
rápidamente descartado cuando en 1909 Hans Geiger y Ernest Marsden, colaboradores
de Ernest Rutherford y bajo la supervisión de este, hicieron el experimento de la lámina
de oro, y en estos experimentos dedujeron que debía haber un núcleo con fuerte carga
positiva, y no una toda una masa gelatinosa con este tipo de carga como proponía
Thomson.
Modelo atómico de Rutherford
El modelo atómico de Rutherford propuesto en 1911 por el químico y físico británico
Ernest Rutherford, proponía que los átomos tienen un núcleo central donde se
encuentra el mayor porcentaje de su masa. Además, según esta teoría, este núcleo tiene
carga eléctrica positiva y es orbitado por partículas de carga opuesta y menor tamaño
(electrones).
Según sus consideraciones, el átomo operaba como un Sistema Solar de electrones que
orbitan alrededor de un núcleo atómico más pesado, como hacen los planetas alrededor
del Sol, es por esto por lo que es conocido como “Modelo Planetario”.
Realizo un experimento con las láminas de oro. Este consistía en bombardear con
partículas alfa una lámina delgada de oro con átomos sin electrones, esto demostró que
algunas partículas atravesaban los átomos de oro en línea recta, mientras que otras eran
desviadas en direcciones aleatorias.
Modelo atómico de Rutherford
Modelo atómico de Bohr
Niels Henrik Bohr propuso el modelo atómico de Bohr en 1913.
El modelo de Bohr indicaba que los electrones orbitan alrededor del núcleo, pero en
ciertas orbitas permitidas. Estas órbitas definidas se les refirió como capas de energía o
niveles de energía. En otras palabras, la energía de un electrón dentro de un átomo no es
continua, sino “cuantificada”.
Este modelo de niveles de energía significaba que los electrones solo pueden ganar o
perder energía saltando de una órbita permitida a otra y al ocurrir esto, absorbería o
emitiría radiación electromagnética en el proceso.
Distribuyo los electrones en las capas de la siguiente manera:
La 1ª capa puede contener, como máximo, 2 electrones.
La 2ª capa puede contener, como máximo, 8 electrones.
La 3ª capa puede contener, como máximo, 18 electrones.
Modelo atómico de Sommerfeld
Arnold Sommerfeld (1868 – 1951). Fue un físico de origen alemán, que en el año de 1916
postulo postuló que los electrones al rededor del núcleo mantienen orbitas tanto
circulares como elípticas distribuidas en orbitales cuánticos, moviéndose a velocidades
que son relativas. Además, de consistir en un núcleo del átomo en movimiento.
Para describir el comportamiento de diferentes lecturas de energía, sobre un mismo
electrón dentro de un orbital. Afirmo que existen diferentes niveles energéticos, es decir
subniveles dentro de un mismo nivel de energía.
Características y Postulados:
-El núcleo atómico no permanece inmóvil.
-El electrón posee una corriente eléctrica mínima.
-Los electrones mantienen orbitas circulares y elípticas.
-Dentro de los orbitales existen subniveles energéticos.
Modelo Atómico de Schrödinger
Desarrollado por Erwin Schrödinger en 1926 se basa en la teoría de un átomo cuántico.
Schrödinger se apoyaría de los estudios en el modelo atómico de Sommerfeld, para
postular que el comportamiento de los electrones al rededor del núcleo se debía a ondas
de materia. Se calcularía como una ecuación ondulatoria que media su evolución en el
tiempo y el espacio de dicho electrón. Afianzando una interpretación sobre con base en
el “principio de incertidumbre”, que postula que es “improbable” determinar la posición
y trayectoria de un electrón en movimiento.
Características del modelo atómico de Schrödinger
-Este modelo del átomo describe el movimiento de los electrones como ondas
estacionarias.
-Los electrones se mueven constantemente, es decir, no tienen una posición fija o definida
dentro del átomo.
-Este modelo no predice la ubicación del electrón, ni describe la ruta que realiza dentro
del átomo. Solo establece una zona de probabilidad para ubicar al electrón.
-Estas áreas de probabilidad se denominan orbitales atómicos. Los orbitales describen un
movimiento de traslación alrededor del núcleo del átomo.
-Estos orbitales atómicos tienen diferentes niveles y subniveles de energía, y pueden
definirse entre nubes de electrones.
Modelo Atómico Actual
Este modelo atómico fue descrito hacia los años 1920, llegando a dar con un modelo
matemático de mecánica cuántica, también conocido como la teoría cuántica. Este tuvo
la colaboración de varios científicos, entre ellos:
Louis Broglie, quien indica que la energía y la materia están formadas por corpúsculos.
Werner Heisenberg, propuso el principio de incertidumbre lo que contribuyó en buena
suma sobre el desarrollo de la mecánica cuántica. Este principio refería a la incapacidad
de poder saber el camino que recorre el electrón.
Erwin Schrödinger estudió la disposición de los electrones con respecto al átomo.
Manejan un sistema de números cuánticos, estos son:
-Número cuántico principal: representado por la letra n, alude a la energía y está
clasificada desde el 1 al 7.
-Número cuántico secundario: también es llamado azimutal, se representa por la letra l,
guarda asociación con los orbitales con respecto a la forma que tienen. Tienen subniveles
catalogados con los números del 0 al 3.
s=0
p=1
d=2
f=3
-Número cuántico magnético: representado por la letra m, manifiesta la posición de la
órbita en el espacio.
-El cuarto número, de giro o spin, se simboliza con la letra s o ms, como su nombre indica
se trata del giro que realiza sobre sí mismo el electrón, bien sea hacia derecha o izquierda,
obteniendo cuantías en -1/2 o +1/2.
Modelo Atómico Actual
También podría gustarte
- Modelos AtomicosDocumento3 páginasModelos AtomicosMarco Meneses PlascenciaAún no hay calificaciones
- Modelos AtomicosDocumento5 páginasModelos AtomicosDiter VazquezAún no hay calificaciones
- Teorías AtómicasDocumento4 páginasTeorías Atómicasحاجز اي جيAún no hay calificaciones
- El Átomo A Través Del TiempoDocumento8 páginasEl Átomo A Través Del Tiempoorlando pachecoAún no hay calificaciones
- Modelos AtomicosDocumento5 páginasModelos AtomicosGustavo GenoveseAún no hay calificaciones
- Investigación 1 - Química BásicaDocumento8 páginasInvestigación 1 - Química BásicaJosafat S. TapiaAún no hay calificaciones
- 1.-Modelos AtomicosDocumento23 páginas1.-Modelos Atomicosalanalambre2607Aún no hay calificaciones
- Teoria AtomicaDocumento8 páginasTeoria AtomicaMisael diaz diaz100% (1)
- Modelos AtómicosDocumento7 páginasModelos AtómicosJulia Peralta MeloAún no hay calificaciones
- Modelos AtómicosDocumento7 páginasModelos AtómicosMaricel Rojas0% (1)
- Block Modelo AtomicoDocumento8 páginasBlock Modelo AtomicoLuis Felipe Menor RojasAún no hay calificaciones
- Pia de Fisica y QuimicaDocumento8 páginasPia de Fisica y Quimicadarianna ovallesAún no hay calificaciones
- Modelos AtómicosDocumento3 páginasModelos AtómicosDionelsys RodriguezAún no hay calificaciones
- LECTURA 2.1 El Átomo, Historia y Estructura.Documento7 páginasLECTURA 2.1 El Átomo, Historia y Estructura.Esther GuanangaAún no hay calificaciones
- Modelo Atómico de DemócritoDocumento4 páginasModelo Atómico de DemócritoSkarle DiazAún no hay calificaciones
- Modelos atómicos desde Demócrito a SchrödingerDocumento6 páginasModelos atómicos desde Demócrito a SchrödingerAlejandro Fuentes SalinasAún no hay calificaciones
- Teoría AtómicaDocumento23 páginasTeoría AtómicaCupul Cauich Diego RobertoAún no hay calificaciones
- Teorías AtómicasDocumento7 páginasTeorías AtómicasMariano BiondiAún no hay calificaciones
- Clase PaolaDocumento6 páginasClase PaolaPaola González JiménezAún no hay calificaciones
- Teorías AtómicasDocumento3 páginasTeorías AtómicasRuth Oré RojasAún no hay calificaciones
- Modelo Atomico A1Documento6 páginasModelo Atomico A1Robert WilliamAún no hay calificaciones
- Modelos atómicos a través de la historiaDocumento3 páginasModelos atómicos a través de la historiaDeyviss CzzAún no hay calificaciones
- Evolucion Del Modelo AtomicoDocumento4 páginasEvolucion Del Modelo Atomicojohnlovecraft100% (3)
- Resumen Modelos AtomicosDocumento4 páginasResumen Modelos AtomicosTamara VegaAún no hay calificaciones
- Modelos Atomicos Mas ImportantesDocumento10 páginasModelos Atomicos Mas ImportantesMariaElizabeth14Aún no hay calificaciones
- Modelos AtómicosDocumento17 páginasModelos AtómicosThomasAún no hay calificaciones
- Modelos Atómicos y Tabla PeriódicaDocumento5 páginasModelos Atómicos y Tabla Periódicajhon pachecoAún no hay calificaciones
- Segundo Parcial Ondas y ParticulasDocumento21 páginasSegundo Parcial Ondas y ParticulasJuan Jose Villamizar LAún no hay calificaciones
- Album Modelos AtomicosDocumento18 páginasAlbum Modelos AtomicosAlan Martínez :vAún no hay calificaciones
- Informe de Los Modelos AtomicosDocumento8 páginasInforme de Los Modelos Atomicosaudio novelas fenAún no hay calificaciones
- Modelos atómicos a través de la historiaDocumento9 páginasModelos atómicos a través de la historiaSebastian GuzmanAún no hay calificaciones
- Teorias Atómicas 2021Documento73 páginasTeorias Atómicas 2021EDUCAMOS BarillasAún no hay calificaciones
- Modelos atómicos históricosDocumento4 páginasModelos atómicos históricosDawill Ocaña CarballidoAún no hay calificaciones
- Cuales Son Los Diferentes Modelos Atómicos Que Existen? R/ Existen 8 Que SonDocumento10 páginasCuales Son Los Diferentes Modelos Atómicos Que Existen? R/ Existen 8 Que SonElizabeth MercadoAún no hay calificaciones
- Modelos Atómicos Dalton, Thomson, Perrin, Bohr, Sommerfeld y +Documento5 páginasModelos Atómicos Dalton, Thomson, Perrin, Bohr, Sommerfeld y +Martha Estela Martinez BazaAún no hay calificaciones
- Modelos AtomicosDocumento16 páginasModelos AtomicosAnonymous vmuFYr31Aún no hay calificaciones
- Historia de La Teoría AtómicaDocumento41 páginasHistoria de La Teoría Atómicamaverick666990% (1)
- Modelos atómicos a través de la historiaDocumento15 páginasModelos atómicos a través de la historiaCONSTANZA OSSAAún no hay calificaciones
- A1 3 Torres Pilla Jorge A4-I-IC-02Documento12 páginasA1 3 Torres Pilla Jorge A4-I-IC-02Jorge David TorresAún no hay calificaciones
- Modelos AtómicosDocumento5 páginasModelos Atómicosfred doorsAún no hay calificaciones
- Boson FermionDocumento5 páginasBoson FermionInformatica Municipalidad de ZacapaAún no hay calificaciones
- Modelos AtómicosDocumento3 páginasModelos AtómicosJohanna Cortés HurtadoAún no hay calificaciones
- Que Es El Modelo AtómicoDocumento3 páginasQue Es El Modelo AtómicoVictoria Conejo LucioAún no hay calificaciones
- Presentación de Ciencias El Sistema Solar Azul Amarillo y BlancoDocumento16 páginasPresentación de Ciencias El Sistema Solar Azul Amarillo y BlancoJAMMMAún no hay calificaciones
- La Evolución Del Modelo AtómicoDocumento4 páginasLa Evolución Del Modelo AtómicoMalinalli GutiérrezAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosSamanta Trejo SalcedoAún no hay calificaciones
- Proyecto Modelo Atómico RutherfordDocumento11 páginasProyecto Modelo Atómico RutherfordAlexander Jhoel Cristiam Pari MaqueAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos AtomicosIgnacio LunaAún no hay calificaciones
- 6 Modelos Atomicos IlustradosDocumento6 páginas6 Modelos Atomicos IlustradosGiovanni CruzAún no hay calificaciones
- Teoria AtomicasDocumento19 páginasTeoria AtomicasLeonardo Valderrama LozanoAún no hay calificaciones
- Modelo Atómico de RutherfordDocumento5 páginasModelo Atómico de RutherfordNathaliaMarquezAún no hay calificaciones
- Modelos AtomicosDocumento5 páginasModelos Atomicosjulian.huerta02Aún no hay calificaciones
- Los Modelos AtómicosDocumento10 páginasLos Modelos AtómicosNicolasCenaAún no hay calificaciones
- Modelos Atomicos (Keisha)Documento6 páginasModelos Atomicos (Keisha)keisha 99Aún no hay calificaciones
- Modelos AtómicosDocumento2 páginasModelos AtómicosSo VAún no hay calificaciones
- Modelo Atómico Según Niels BohrDocumento7 páginasModelo Atómico Según Niels BohrWorh FalexAún no hay calificaciones
- Ilovepdf MergedDocumento14 páginasIlovepdf MergedFELIPE RONALDO ROSADO SALTOSAún no hay calificaciones
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- INPC: Índice Nacional de Precios al ConsumidorDocumento8 páginasINPC: Índice Nacional de Precios al ConsumidorHiram CansinoAún no hay calificaciones
- Trabajo Fósiles OviedoDocumento7 páginasTrabajo Fósiles OviedoNerea Cascon DiazAún no hay calificaciones
- IBAU GeneralDocumento24 páginasIBAU GeneralJulio MongeAún no hay calificaciones
- SUBRAYADODocumento2 páginasSUBRAYADOJosselin OreAún no hay calificaciones
- Tostion de CafeDocumento21 páginasTostion de Cafeavila83_14Aún no hay calificaciones
- Excavación Arqueológica en El Atrio Norte de La Colegiata de Santa María La Mayor de Toro.Documento29 páginasExcavación Arqueológica en El Atrio Norte de La Colegiata de Santa María La Mayor de Toro.Mverto AetivsAún no hay calificaciones
- Tema 2 - Actividad - 1Documento5 páginasTema 2 - Actividad - 1Mario AlbertoAún no hay calificaciones
- Manchaco Bayona KevinDocumento1 páginaManchaco Bayona KevinAnonymous mwfvC7Czc7Aún no hay calificaciones
- Ex. Parcial EE647 - FIEE UNIDocumento2 páginasEx. Parcial EE647 - FIEE UNIDavid100% (1)
- Recetas de Cocina y Autoayuda para El Enfermo OncologicoDocumento131 páginasRecetas de Cocina y Autoayuda para El Enfermo Oncologico19199054Aún no hay calificaciones
- Capacitacion Apoyo Medico InsaragDocumento35 páginasCapacitacion Apoyo Medico Insaragnaniyagami490Aún no hay calificaciones
- 2 PDFDocumento22 páginas2 PDFDarwing CastilloAún no hay calificaciones
- El Buda en Tu EspejoDocumento73 páginasEl Buda en Tu EspejoUlises ChávezAún no hay calificaciones
- Taller Practico # 5.1 Pasta Orly, Tempura, Apanado, SolomilloDocumento3 páginasTaller Practico # 5.1 Pasta Orly, Tempura, Apanado, SolomilloXxposeidonxX XAún no hay calificaciones
- 1906 Lluria Humanidad Porvenir PDFDocumento132 páginas1906 Lluria Humanidad Porvenir PDFHugociceronAún no hay calificaciones
- Trabajo de SensoresDocumento4 páginasTrabajo de SensoresSebastian Rojas GuzmanAún no hay calificaciones
- Articulo Cientifico AlgasDocumento19 páginasArticulo Cientifico AlgasDiego Cornejo ParedesAún no hay calificaciones
- Problemas ResueltosDocumento52 páginasProblemas Resueltossandy rosmeri zavala escalanteAún no hay calificaciones
- Iv 07Documento18 páginasIv 07Jose SanchezAún no hay calificaciones
- Mas Alla de Las Palabras La Topologia Del DiscursoDocumento22 páginasMas Alla de Las Palabras La Topologia Del DiscursodmilenamorenoAún no hay calificaciones
- Principales Avances Cientificos Del Siglo XviiDocumento1 páginaPrincipales Avances Cientificos Del Siglo XviiSocrates Coronado Calle60% (78)
- Sistema de FrenosDocumento4 páginasSistema de FrenosBrayanAún no hay calificaciones
- 488 La Instalaciones Sanitarias Tomo 1 de 6 Gustavo A TataDocumento205 páginas488 La Instalaciones Sanitarias Tomo 1 de 6 Gustavo A Tatalennisavila80% (5)
- Semana 5 GCM UpcDocumento45 páginasSemana 5 GCM UpcMilagros Pichihua ZavaletaAún no hay calificaciones
- Protrac 1Documento2 páginasProtrac 1Tommy ViteAún no hay calificaciones
- MedicoModerno y FuturoMatasanoDocumento1200 páginasMedicoModerno y FuturoMatasanoValentina Guimaraens86% (43)
- Resumen El Origen de La Familia La Propiedad Privada y El EstadoDocumento18 páginasResumen El Origen de La Familia La Propiedad Privada y El EstadoPablo Daniel Laguado100% (1)
- Circuitos con transistores: Identificación, mediciones y funcionamientoDocumento7 páginasCircuitos con transistores: Identificación, mediciones y funcionamientojuan jose romani parejaAún no hay calificaciones
- Oración para El Descanso NocturnoDocumento2 páginasOración para El Descanso NocturnoSánchez Eduardo de JesúsAún no hay calificaciones
- Determinacion de Cu Por VolumetriaDocumento16 páginasDeterminacion de Cu Por Volumetriajhoni100% (4)