Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Semana 11
Semana 11
Cargado por
JOSE GABRIEL HUACACHI BAZANTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Semana 11
Semana 11
Cargado por
JOSE GABRIEL HUACACHI BAZANCopyright:
Formatos disponibles
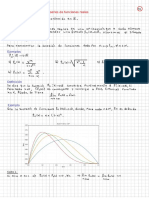
v» grandes: fase gaseosa gen JXMR corresponde a pequefios valores dev < v1: fase liquida gen JDN corresponde a la situacién inestable vy < v < vy En el punto X, se cortan las curvas KX N y JX M,y en este punto las energias libres del liquido y gas son iguales, es decir q a esta presién coexisten en equilibrio proporciones arbitrarias de ambas fases. 0 a a Gran Potencial y la funcién de particién macrocanénica Eeuacion de Euler; £ = T'S — pV + uN; Tambien en un sistema F = BTS: G = F + pV; C=; wn. Dofinimos ® = E—TS —D 4,N, Luego @ = P=, pyNy 3 ® = F-G 46 =—pv db = dE Td — SdT — > wjdNj — Y Njdp;: como dE = TdS — pv + ¥, wjdN, 7 j d® = —pdV — SdT - YY Nj; 5 es decir que # = 4(V,T, p,) y adomés (ar )ag 8 -()=—Fa) rae, Como O= LY ee =P Ve ews) a 1aQ ape AT hn Q) hu Oka ae ~ -kno—ert BEANE — Ny = -knQ Wehbe (E, Ns) pe = bmg Eg [DEM ED ete ary) = -kinQ op i> cere Luego, Esta eenacién se cumple si , a a) Pues en este caso, gp) = 6.5.1 Equilibrio Sélido-Vapor Consideremos un sistema Sélido-Vapor, con N, moléculas en Ia fase sélida y N, en la fase vac por de un total de N moléculas on un volumen V en contacto térmico con un foco ealorifico a. temperatina T. Condiciones de equilibria: HT, Na) = poo(T. No) (6.10) Para el vapor, Lay =e (6.1) Para el sélido, Z(No,T) = [Zia(T)) (6.12) Luego, QTV. ge) = YO ah 2(7, Nu V) = eb Q.(P36) = 3 5 ZIT) = —— ae ee Sag B21) Donde 3; = e# A partir de estas funciones, construimos N, y N,. OB ON Qe ep Dw , Mazo ae Ta (eM Zi(TV)) 2 Zy(TV)+kTZ, (TV) 0% Ope Ae El primer término de la tiltima ecuacion es cero. Luego, (6.13) (6.14) (6.15) (6.16) Ne = Zig(T.V)e%"* por lo que. Ne y= kT In ge ' ZialtV) Para N., of 1 (oan La ZiT) Op, (1 = 3e%10(T)) (6.17) (6.18) (6.19) (6.20) 1 a Me TTT 8 210)) 1 Le Bas Me elne N {I= €%#*21,4(T)] = Zaa(T)e* 4 Ny — NZ (Te = Zr<(T)e EM (L+ NZ (7) (6.20) (6.21) (6.22) (6.23) SiN, > 1. y= -kTnZ,,(7) En el equilibrio 1, = jie, luego in despejando N,, ZAT.V) Net (6.24) (6.25) (6.26) Esta. cantidad es erociente con la temperatura por lo que la fase sélida irs desaparcciendo con Ja temperatura, Si 7, es la temperatura para la cnal N, = 0, entonees para esta temperatura (6.27) Para la fase sélida, _ » ZilDoV) Zio LV) Nee NONE S FT) Zatavy TST N= o ret (6.28)
También podría gustarte
- Biologia Molecular 21 - II (2018)Documento10 páginasBiologia Molecular 21 - II (2018)JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Biologia CelularDocumento20 páginasBiologia CelularJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Jose TesisDocumento68 páginasJose TesisJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Biología CelularDocumento18 páginasBiología CelularJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Bioquímica GeneralDocumento9 páginasBioquímica GeneralJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Semana 12Documento45 páginasSemana 12JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Laboratorio 2 Mecanica CuanticaDocumento23 páginasLaboratorio 2 Mecanica CuanticaJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Bioquimica General 2018Documento8 páginasBioquimica General 2018JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Ep Part1Documento1 páginaEp Part1JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Informe N 2 Introducci N A La Astronom ADocumento4 páginasInforme N 2 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Capitulo Fisica NuclearDocumento11 páginasCapitulo Fisica NuclearJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Semana 10Documento40 páginasSemana 10JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Ilovepdf MergedDocumento148 páginasIlovepdf MergedJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- CamScanner 10-23-2022 10.40Documento7 páginasCamScanner 10-23-2022 10.40JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Ep Part2Documento1 páginaEp Part2JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Informe N 1 Introducci N A La Astronom ADocumento6 páginasInforme N 1 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- CamScanner 10-23-2022 16.44Documento10 páginasCamScanner 10-23-2022 16.44JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Informe N 1 Introducci N A La Astronom ADocumento6 páginasInforme N 1 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Informe N 1 Introducci N A La Astronom ADocumento7 páginasInforme N 1 Introducci N A La Astronom AJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Adobe Scan 23 Oct. 2022Documento13 páginasAdobe Scan 23 Oct. 2022JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Ilovepdf MergedDocumento9 páginasIlovepdf MergedJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- CamScanner 10-06-2022 20.36Documento6 páginasCamScanner 10-06-2022 20.36JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Semana1-Clase1 MergedDocumento91 páginasSemana1-Clase1 MergedJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Semana13 Clase2bDocumento5 páginasSemana13 Clase2bJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- 1lab MCI 2022IIDocumento2 páginas1lab MCI 2022IIJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Formato Del InformeDocumento5 páginasFormato Del InformeJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Series de Fourier - MergedDocumento45 páginasSeries de Fourier - MergedJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Laboratorio 1 Mecanica CuanticaDocumento11 páginasLaboratorio 1 Mecanica CuanticaJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Sem03 L3Documento25 páginasSem03 L3JOSE GABRIEL HUACACHI BAZANAún no hay calificaciones
- Urday EeDocumento117 páginasUrday EeJOSE GABRIEL HUACACHI BAZANAún no hay calificaciones