Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Pre Examen 2
Pre Examen 2
Cargado por
Rob VelaDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Pre Examen 2
Pre Examen 2
Cargado por
Rob VelaCopyright:
Formatos disponibles
Pre examen
Segunda unidad
Termodinámica química
1. Explique las diferencias termodinámicas entre el enfriamiento logrado por un abanico de
techo, un lavador de gases y un minisplit.
2. Realice el desarrollo matemático en el cual se demuestre la equivalencia de J y atm L.
3. ¿Por qué, si el valor del cambio de entropía podría describir la dirección de una reacción
química, se utiliza el cambio en la energía libre de Gibbs para describir la espontaneidad de
una reacción?
Resuelva los siguientes problemas.
1. Calcule ΔH° y delta ΔS° para las siguientes reacciones y decida en qué dirección impulsará
la reacción cada uno de estos factores. Calcule el ΔH a 50°C, así como a que temperatura la
reacción se encuentra en equilibrio.
a. 𝑁2(𝑔) + 3𝐻2(𝑔) ↔ 2𝑁𝐻3(𝑔)
b. N2(g) + 3 H2(g) ↔ 2 NH3(g)
2. Utilice los siguientes datos de energía libre de formación de estado estándar para calcular
la constante de equilibrio de disociación de ácido (Ka) en para el ácido fórmico:
Compuesto ΔG
HCO2(aq) -372.3
H+(aq) 0
2-
HCO (aq) -351
NOTA: ∆𝐺 0 = −𝑅𝑇 ln 𝑘𝑎
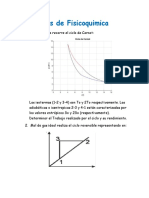
3. Una máquina de Carnot libera calor del reservorio caliente al frio hasta alcanzar 5000K
logrando una eficiencia del 25%. Que temperatura debería de alcanzar el reservorio frio
para alcanzar una eficiencia del 60%.
4. Una maquina térmica de Carnot que contiene 10000J a 600K de calor en el reservorio
caliente libera 6000J al reservorio frio el cual se encuentra a 400K. Calcular el calor
realizado por esta máquina. La eficiencia de este proceso y la eficiencia máxima que se
puede alcanzar.
También podría gustarte
- Preex 2Documento3 páginasPreex 2Rob VelaAún no hay calificaciones
- Tarea 12 - TermoquímicaDocumento6 páginasTarea 12 - TermoquímicaCuau SuarezAún no hay calificaciones
- Guia de TermodinamicaDocumento5 páginasGuia de TermodinamicaBetsabe Lilibeth Perez SaumonAún no hay calificaciones
- Lista Termodinámica 2019 05 20 JMA PDFDocumento5 páginasLista Termodinámica 2019 05 20 JMA PDFRegina MogrovejoAún no hay calificaciones
- Guia de Problemas - Capitulo 5Documento17 páginasGuia de Problemas - Capitulo 5Víctor Vázquez0% (1)
- Practica Domiciliaria 6Documento6 páginasPractica Domiciliaria 6Julio Soto LovonAún no hay calificaciones
- Fisicoquimica - Guia de Problemas EntropíaDocumento7 páginasFisicoquimica - Guia de Problemas EntropíaLuis HuaringaAún no hay calificaciones
- Clase Práctica 5. Vant'hoff y KirchhoffDocumento2 páginasClase Práctica 5. Vant'hoff y KirchhoffMirellea AndurayAún no hay calificaciones
- Enunciado Problemas2018 DefinitivoDocumento26 páginasEnunciado Problemas2018 DefinitivoMarcos PascualAún no hay calificaciones
- Ejercicios CineticaDocumento4 páginasEjercicios CineticaRodrigo GarciaAún no hay calificaciones
- Ejercicios TermodinámicaDocumento8 páginasEjercicios TermodinámicaJeremy SalasAún no hay calificaciones
- Ejercicios Termodinã - MicaDocumento11 páginasEjercicios Termodinã - MicaSofia Londoño LlanosAún no hay calificaciones
- Entalpia Guia de EjercitacionDocumento3 páginasEntalpia Guia de EjercitacionLeonel IvanAún no hay calificaciones
- Guia de Fisico QuimicaDocumento5 páginasGuia de Fisico QuimicaVictor Manuel Gallardo MuñizAún no hay calificaciones
- CORECCIONESDocumento17 páginasCORECCIONESJOSHUA JAI BASTIDAS JIMENEZAún no hay calificaciones
- Compendio de ExamenesDocumento78 páginasCompendio de ExamenesCV JonathanAún no hay calificaciones
- Taller II QGDocumento9 páginasTaller II QGJuan David Arias0% (1)
- Seminario TermoquimicaDocumento4 páginasSeminario TermoquimicaGabi SilveroAún no hay calificaciones
- Evaluación Diagnóstico Termo 2022Documento2 páginasEvaluación Diagnóstico Termo 2022Julián MelladoAún no hay calificaciones
- Serie 3Documento5 páginasSerie 3Deysi CamachoAún no hay calificaciones
- Clase5 QDocumento23 páginasClase5 Qyeiko.riveros.pAún no hay calificaciones
- FQ Guía Problemas y TP S Rev - 2015Documento43 páginasFQ Guía Problemas y TP S Rev - 2015Juan Pablo IngrassiaAún no hay calificaciones
- Guía de Problemas, Segunda ParteDocumento20 páginasGuía de Problemas, Segunda Partenico10377022Aún no hay calificaciones
- Taller TermoDocumento3 páginasTaller TermoLEANDRO ORTIZ TABARESAún no hay calificaciones
- Listado de Ejercicios 04 536.311 Semestre I-2023Documento3 páginasListado de Ejercicios 04 536.311 Semestre I-2023Jonathon zapataAún no hay calificaciones
- UntitledDocumento128 páginasUntitledReymar1995Aún no hay calificaciones
- T Gui A de Problemas para Taller Previo PC1 FQDocumento5 páginasT Gui A de Problemas para Taller Previo PC1 FQNavarro Saavedra Dayanna RusbelithAún no hay calificaciones
- Taller Fisicoquimica Termoquimica AmbientalDocumento3 páginasTaller Fisicoquimica Termoquimica AmbientalFrancia SotoAún no hay calificaciones
- SEMINARIO..4 Termodinamica Termoquimica PDFDocumento5 páginasSEMINARIO..4 Termodinamica Termoquimica PDFJIMZSAMIRAún no hay calificaciones
- GUIA DE ESTUDIO PARA EL ETS DE QUÍMICA APLICADA - Smid Santiago PedroDocumento4 páginasGUIA DE ESTUDIO PARA EL ETS DE QUÍMICA APLICADA - Smid Santiago PedroJorge CastilloAún no hay calificaciones
- Guia 1 Termoquimica y CineticaDocumento7 páginasGuia 1 Termoquimica y CineticaTanisBrisiSanchezAún no hay calificaciones
- Cinetica QuimicaDocumento9 páginasCinetica QuimicaJhon Datevolta Esteban Vetancur0% (1)
- Problemario de Termodinámica Del Equilibrio de FasesDocumento27 páginasProblemario de Termodinámica Del Equilibrio de FasesNadia Montero GonzálezAún no hay calificaciones
- Set Problemas 2do - Sem 530141 PDFDocumento19 páginasSet Problemas 2do - Sem 530141 PDFJavi Manríquez Inostroza0% (1)
- Quimica GeneralDocumento4 páginasQuimica GeneralARAMAYO JuanAún no hay calificaciones
- Ejercicios Unidad 2. TermoquímicaDocumento5 páginasEjercicios Unidad 2. TermoquímicaLuciana CruzAún no hay calificaciones
- Problemas Quim. 530Documento9 páginasProblemas Quim. 530Eduardo Luengo GonzalezAún no hay calificaciones
- 3.1 ExperimentacionDocumento8 páginas3.1 Experimentacionjonathan.garcia2912Aún no hay calificaciones
- TP 3 Termodinamica 2019Documento2 páginasTP 3 Termodinamica 2019Flor OtoneloAún no hay calificaciones
- Serie Equilibrio Químico 2021-1Documento2 páginasSerie Equilibrio Químico 2021-1Christopher MorenoAún no hay calificaciones
- Problemas TermoquimicaDocumento5 páginasProblemas TermoquimicaOscar Cruellas GrauAún no hay calificaciones
- UntitledDocumento141 páginasUntitledReymar1995Aún no hay calificaciones
- Ejercicios Propuestos Tema 1Documento2 páginasEjercicios Propuestos Tema 1Serena Rodrigo TorresAún no hay calificaciones
- Taller Nº3-2017Documento5 páginasTaller Nº3-2017DANIELA DIAZ GÓMEZAún no hay calificaciones
- Taller #2 FQDocumento8 páginasTaller #2 FQMily Gutierrez Espinoza100% (1)
- Guia de Problemas - Capitulo 2 PDFDocumento2 páginasGuia de Problemas - Capitulo 2 PDFJuan VasquezAún no hay calificaciones
- Taller de Repaso Entropia Energia Libre PDFDocumento5 páginasTaller de Repaso Entropia Energia Libre PDFCamila Barrero TiqueAún no hay calificaciones
- Tema 4 - TermoquímicaDocumento5 páginasTema 4 - TermoquímicaMiryam GarcésAún no hay calificaciones
- Ejercicios TermoquímicaDocumento4 páginasEjercicios TermoquímicaClarita393Aún no hay calificaciones
- Guia de Trabajo N°3 TermodinamicaDocumento5 páginasGuia de Trabajo N°3 TermodinamicaAndrea Angarita HernándezAún no hay calificaciones
- Ejercicios para El Examen de Recuperacion de FisicoquimicaDocumento7 páginasEjercicios para El Examen de Recuperacion de FisicoquimicaAnthony FreireAún no hay calificaciones
- Ets Teq 2022-1Documento2 páginasEts Teq 2022-1Erwin Joel Artigas LópezAún no hay calificaciones
- Química IV - 6to. - MatutinoDocumento6 páginasQuímica IV - 6to. - MatutinoAmelia IgnisAún no hay calificaciones
- PD06 - QG TermodinamicaDocumento4 páginasPD06 - QG TermodinamicaARIANA VALERIA HUALLPA GUTIERREZAún no hay calificaciones
- 4° Parcial 2020Documento4 páginas4° Parcial 2020Jhohan Mauricio LOZANO GARCIAAún no hay calificaciones
- 1er Examen Parcial de FQM 20-PDocumento1 página1er Examen Parcial de FQM 20-PLolgan PérezAún no hay calificaciones
- Practica #2 - Segundo ParcialDocumento12 páginasPractica #2 - Segundo ParcialMiguel Angel Mamani AliAún no hay calificaciones
- Fqii - Primer Práctico (A)Documento16 páginasFqii - Primer Práctico (A)Antonela YanethAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones