Documentos de Académico
Documentos de Profesional
Documentos de Cultura
BB 090482
Cargado por
felipitodenicoleTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
BB 090482
Cargado por
felipitodenicoleCopyright:
Formatos disponibles
REVISIÓN
Utilidad de los estudios genéticos y de neuroimagen en
el diagnóstico diferencial de la enfermedad de Parkinson
A. Rojo a, C. Corbella b
UTILIDAD DE LOS ESTUDIOS GENÉTICOS Y DE NEUROIMAGEN EN
EL DIAGNÓSTICO DIFERENCIAL DE LA ENFERMEDAD DE PARKINSON
Resumen. Introducción. El diagnóstico de la enfermedad de Parkinson (EP) se realiza habitualmente sobre la base de criterios
clínicos. Actualmente existen pruebas genéticas y de neuroimagen que pueden contribuir al estudio de esta enfermedad. Obje-
tivos. Revisar los avances recientes en estudios genéticos y en técnicas de neuroimagen aplicadas en EP, así como sus limita-
ciones, analizar los motivos de realización de dichas pruebas y discutir su trascendencia en la práctica clínica habitual, inclu-
yendo una serie de reflexiones éticas. Desarrollo. El listado de alteraciones genéticas asociadas a EP se encuentra en amplia-
ción y revisión continua, y se han definido ya al menos alteraciones patogénicas en 10 genes. Las mutaciones más frecuentes
en nuestro medio se encuentran en el gen parkina (PARK2) y en el gen LRKK2 (PARK8). Son mutaciones con penetrancia no
elevada y de expresión clínica variable. Imágenes obtenidas por resonancia magnética, tomografía computarizada por emi-
sión de fotón simple, tomografía por emisión de positrones o mediante ecografía craneal aportan datos que pueden ayudar al
diagnóstico de la EP y a la diferenciación de otras enfermedades, pero ninguna técnica es totalmente específica y existen dis-
cordancias clinicorradiológicas. Conclusiones. La detección de mutaciones no permite establecer una clara diferenciación
pronóstica ni una distinta actitud terapéutica. Aún no esta claramente establecido el valor de las técnicas de neuroimagen en
fases muy precoces y en casos dudosos. Se debate el hecho de que establecer un diagnóstico en fases muy precoces consiga en
la actualidad algún beneficio para el paciente. Convendría intentar diferenciar qué pruebas se realizan con propósito clínico
y cuáles con fines investigadores para poder proceder de la manera más adecuada. [REV NEUROL 2009; 48: 482-8]
Palabras clave. Diagnóstico. Enfermedad de Parkinson. Ética. Genética. Resonancia. SPECT.
INTRODUCCIÓN ESTUDIOS GENÉTICOS
La enfermedad de Parkinson (EP) es la segunda enfermedad Estudio genético es cualquier análisis de ADN, ARN, cromoso-
neurodegenerativa más frecuente. Han ocurrido recientemente mas, proteínas o ciertos metabolitos realizados para detectar al-
múltiples avances en el descubrimiento de nuevos genes impli- teraciones relativas a un trastorno hereditario. Son pruebas que
cados en su etiopatogénesis, así como en técnicas de neuroima- se encuentran en constante innovación y que suelen realizarse
gen aplicables al diagnóstico y a la diferenciación entre diferen- en laboratorios especializados. Pueden informar sobre un diag-
tes parkinsonismos. En la clínica habitual, cada vez es más fre- nóstico, una predicción de futuro, una predisposición, un estado
cuente la realización de estas pruebas. de portador y también realizarse de forma prenatal o preimplan-
Los neurólogos frecuentemente nos planteamos en nuestra tacional con fines eugenésicos. Sus resultados tienen no sólo
práctica habitual la necesidad de solicitar un estudio genético o implicaciones para el sujeto, sino también para su familia, y
una prueba de neuroimagen a personas afectas de EP. Muchas pueden formar parte de un consejo genético.
veces son los mismos afectados o sus familiares quienes las soli- Pero, ¿es la EP un trastorno hereditario? La EP es un trastor-
citan. Tenemos nuevas técnicas accesibles, aunque costosas, y, no neurodegenerativo sobre el que en la actualidad no se ha es-
en ocasiones, dudamos acerca de su verdadera trascendencia y tablecido un agente único causal. Hace relativamente pocos
repercusión en la clínica. Nos enfrentamos al diagnóstico de una años se especulaba sobre los diferentes agentes etiológicos am-
enfermedad para la que actualmente no existe un tratamiento bientales, pero en poco tiempo han cobrado mucha mayor aten-
preventivo, pero para la cual ya hay algunas evidencias de efica- ción los factores genéticos. Posiblemente, la mayoría de casos
cia de terapias neuroprotectoras que pueden modificar su curso son resultado de la interacción de causas múltiples (genéticas y
evolutivo y que esperamos que en un futuro breve se confirmen. ambientales) que actualmente no podemos determinar. Se han
El objetivo del presente trabajo es revisar los avances recien- descrito multitud de factores de riesgo y protectores genéticos
tes en estudios genéticos y en técnicas de neuroimagen aplica- (nucleares o mitocondriales), epigenéticos (factores que, sin per-
das en la EP, analizar los motivos de realización de dichas prue- tenecer a la cadena del ADN, también se heredan) y ambienta-
bas y discutir su trascendencia en la práctica clínica habitual. les, que, junto con el envejecimiento, pueden contribuir a que
una persona desarrolle o no a lo largo de su vida EP.
Aceptado tras revisión externa: 21.01.09. Aunque el porcentaje es variable en las distintas series, mu-
a chos pacientes tienen o han tenido algún familiar también afec-
Servicio de Neurología. Hospital Príncipe de Asturias. Alcalá de Henares,
Madrid. b Servicio de Radiología. Hospital Mútua de Terrassa. Terrassa, Bar- tado de EP. Eso hace pensar en el posible papel de la genética en
celona, España. esa EP familiar, aunque, verdaderamente, la coincidencia puede
Correspondencia: Dra. Ana Rojo Sebastián. Diciembre, 28C. E-28022 Ma- deberse a que las familias muchas veces pueden compartir de-
drid. E-mail: anarojosebastian@gmail.com terminada exposición a un mismo factor ambiental o simple-
Trabajo presentado en el I Congreso Iberoamericano de Enfermedad de Par- mente a una coincidencia debida al azar. De hecho, en ocasio-
kinson, celebrado en Buenos Aires, Argentina, en octubre de 2007. nes, al estudiar familiares de personas afectas de EP genética
© 2009, REVISTA DE NEUROLOGÍA que desarrollaban datos de parkinsonismo y realizar el estudio
482 REV NEUROL 2009; 48 (9): 482-488
GENÉTICA Y NEUROIMAGEN EN PARKINSON
Tabla I. Distintas formas monogénicas de enfermedad de Parkinson. son patogénicas y ocho, recu-
rrentes [8], y actualmente se
Modo de herencia Acrónimo Proteína alterada Funciones alteradas puede afirmar que la mutación
Autosómico PARK2 Ubiquitinligasa Degradación proteica, estrés oxidativo G22019S en el gen de la dardari-
recesivo y disfunción mitocondrial na es la más frecuente asociada
a la EP. En estos últimos años se
PARK6 PTEN induced kinase Alteración mitocondrial
han realizado 39 estudios de pre-
PARK7 Chaperona-like Respuesta celular al estrés oxidativo, valencia de mutaciones de
(regula la actividad alteración de la síntesis de dopamina PARK8 en 21 países de cuatro
de la tirosinhidroxilasa)
continentes y, aunque la metodo-
PARK9 ATPasa lisosomal Disfunción energética logía es diferente, se han obser-
vado importantes diferencias. La
Autosómico PARK1 α-sinucleína Maduración de las vesículas presinápticas,
dominante regulación de la liberación de neuro- máxima frecuencia se encontró
transmisores, acetilación de histonas en árabes, en un 41% de EP es-
PARK5 Hidrolasa Alteración de la formación
porádica [8] y en un 42% de EP
ubiquitincarboxiterminal de monómeros de ubiquitina familiar en Turquía [9]. Es fre-
cuente también en judíos aske-
PARK8 Cinasa rica en leucina de
un sustrato desconocido
nazíes (20%) [10] y menor en el
sudoeste de Europa (6%). En Es-
PARK13 Proteasa Alteración de la morfología paña, las cifras sitúan la preva-
y la función mitocondrial
lencia de mutaciones en un 8%
Otras Nurr 1 Desarrollo de las neuronas dopaminérgicas en el País Vasco, un 5% en Astu-
rias y menor de un 4% en Cata-
ADN polimerasa Replicación del ADN mitocondrial
luña [11,12]. La prevalencia es
menor en Norteamérica, norte de
Europa y Asia [13]. No hay da-
genético se pudo comprobar que no portaban la mutación (feno- tos de África ni de Sudamérica, y existe muy poca información
copias) [1]. sobre afroamericanos.
El que la EP sea un caso único en la familia no indica que Además de la elevada frecuencia, la relevancia del papel de
forzosamente no se deba a una alteración genética. Puede que la LRKK2 radica en que las mutaciones producen un cuadro de ‘EP
historia familiar se desconozca, que los antecesores hayan falle- típica’, de inicio en edades medias y que responde a levodopa
cido prematuramente, que la familia tenga pocos miembros o (aunque se ha postulado una mayor incidencia de alteraciones
haya habido adopciones o falsas paternidades. También puede comportamentales). La penetrancia de estas mutaciones en LRRK2
que no se hayan diagnosticado de forma adecuada, que la enfer- es baja, aunque no del todo conocida. Se estima que puede osci-
medad se haya manifestado clínicamente diferente en el otro fa- lar entre un 24 y un 30% a los 80 años [14].
miliar (expresividad variable de las mutaciones) o que sea una Además de analizar genes implicados en las formas mono-
EP genética causada por una mutación de novo. génicas de EP, se están estudiando los factores genéticos de
El listado de localización de alteraciones genéticas asocia- riesgo y protectores frente a la EP y el posible papel de esos ge-
das a la EP se encuentra en ampliación y revisión continua [2,3] nes ya establecidos como causantes de formas familiares de EP
(Tabla I). En global, cabe destacar que en la EP ninguna muta- en la etiopatogenia de la ‘EP común’; por ejemplo, si la presen-
ción tiene una penetrancia alta y que la expresividad es variable cia de una mutación patogénica recesiva en un único alelo con-
(la misma mutación incluso en miembros de la misma familia diciona un riesgo. Un reciente estudio no demostró una mayor
puede asociarse a fenotipos clínicos muy diferentes), y que en frecuencia de una mutación en el gen parkina en afectados de EP
formas de inicio temprano y con historia familiar la probabili- que en controles [15], pero sí parece que la variación G2385R
dad de encontrar mutaciones es más elevada [4] . en LRRK2 es un factor de riesgo en la ‘EP común’ en chinos
Algunas de las alteraciones genéticas asociadas a la EP se [16]. También se han encontrado duplicaciones en el gen de si-
han encontrado en muy pocas familias, como la recientemente nucleína en la EP esporádica [17].
ligada al denominado PARK13 [5], pero otras son frecuentes. Estudios muy prometedores analizan las interacciones ge-
Muchas producen un cuadro de parkinsonismo atípico o juve- neticoambientales [18], como los datos en modelos en roedores
nil. Pueden ser heredadas de forma dominante (PARK1/4, 5 y 8) sin el gen parkina, en los que se observa que la susceptibilidad a
o recesiva (PARK2, 6, 7 y 9). Las más frecuentes en nuestro me- una neurotoxina como la rotenona está incrementada [19]. En
dio son las asociadas a mutaciones en el gen de la parkina humanos también se ha descrito que la variante CYP2D6 del ci-
(PARK2) (hasta en un 38% de las formas familiares recesivas en tocromo p450 influye en el daño por exposición a pesticidas y
España [6] en aproximadamente un 15% de las formas fami- tabaco [18], y que variantes en el gen NOS 2A (oxidasa óxido
liares) y, sobre todo, la más recientemente descrita en el gen nítrico) confieren una susceptibilidad diferente al tabaco [20].
LRKK2 (dardarina; PARK8), que se encuentra mutada aproxi-
madamente en un 10% de las formas familiares y en un 6% de
las formas esporádicas. ESTUDIOS DE NEUROIMAGEN
Esta alteración asociada a PARK8 se identificó en el año Las técnicas de neuroimagen estructural y funcional que se han
2004 [7]. El gen esta compuesto de 51 exones y ya se han des- empleado para estudiar la EP son variadas [21,22]. Habitual-
crito 50 variantes en 10 de esos exones. De ellas, se cree que 16 mente, el diagnóstico de EP se sigue emitiendo sobre la base de
REV NEUROL 2009; 48 (9): 482-488 483
A. ROJO, ET AL
los datos clínicos, y se ha establecido claramente una Tabla II. Datos de imagen por resonancia magnética y enfermedad de Parkinson.
alta sensibilidad y especificidad en estudios de correla-
ción con datos anatomopatológicos, sobre todo cuando Resonancia magnética convencional
el diagnóstico se produce en unidades especializadas [23]. Enfermedad de Parkinson
Los múltiples estudios por resonancia magnética
(RM) convencional publicados han establecido diferen- Depósitos de hierro en la SNpc, pérdida de hiperseñal
tes patrones que permiten ayudar a establecer el diag- Pérdida de volumen en la SNpc
nóstico diferencial de la EP frente a otros parkinsonis-
mos degenerativos –parálisis supranuclear progresiva Atrofia multisistémica
(PSP), degeneración corticobasal, atrofia multisistémi- Atrofia y aumento de la hiposeñal en el putamen
ca (AMS), etc.– (Tabla II). En las imágenes por RM en
la EP pueden observarse una serie de cambios, aunque Margen posterolateral hiperintenso por gliosis
no son específicos. Se pueden observar cambios asocia- SNpc normal
dos al depósito de hierro en la sustancia negra que se
visualizan mejor en secuencias con TR largo (eco de Degeneración de fibras pontinas, hiperseñal en cruz
espín, eco T2 y ecogradiente T2) realizadas con alto Parálisis supranuclear progresiva
campo. Para valorar la presencia o no de atrofia, las
nuevas secuencias 3D volumétricas son más sensibles. Atrofia del mesencéfalo
En condiciones normales, la pars compacta de la sus- Atrofia y cambio de señal de colículos
tancia negra (SNpc) muestra una hiperseñal en T2 que
se encuentra limitada lateralmente por la pars reticula- Atrofia frontal
ta y medialmente por el núcleo rojo, el cual se observa Gliosis de la sustancia gris periacueductal
hipointenso en T2. Ya en la juventud puede observarse
una hipointensidad relativa del globo pálido. Esa hi- Degeneración corticobasal
pointensidad de los ganglios basales se incrementa con Atrofia cortical asimétrica frontoparietal
la edad, y llega a afectar al putamen y al caudado en
edades avanzadas [24]. Análisis volumétrico Atrofia cortical en atrofia multisistémica
En la EP puede observarse un menor volumen rela- Pedúnculo cerebeloso superior disminuido
tivo de la SNpc, que pierde su hiperseñal normal. Pue- en la parálisis supranuclear progresiva
den observarse dentro de ella focos parcheados de hi-
Espectroscopia Disminución del cociente acetilaspartato/creatina en la
perseñal que corresponden a gliosis y los cambios de por resonancia protuberancia y el putamen en la atrofia multisistémica
señal debidos al depósito de hierro. Estos cambios se
aprecian mejor en secuencias de inversión-recupera- Inversion recovery ratio Sustancia negra pequeña e irregular en la zona lateral
ción (sustancia negra más pequeña e irregular en la re- Diffusion weighted Coeficiente de difusión aparente mayor en el putamen
gión lateral) y parecen ayudar a diferenciar la EP de en la atrofia multisistémica, y mayor en el putamen,
controles [25]. caudado y pálido en la parálisis supranuclear progresiva
La aplicación de nuevas técnicas por RM (Tabla II) Tensor diffusion Incremento de trace en el putamen
podrá aportar nuevas características diferenciales entre y en el pálido en la atrofia multisistémica
los parkinsonismos degenerativos, como las secuencias Menor fracción de anisotropía en la sustancia
diffusion weighted, que reflejan la limitación de las mo- negra en la enfermedad de Parkinson
léculas de agua por los tractos mielínicos (anisotropía
de difusión). Esta técnica se ha mostrado eficaz en dis- Magnetización transfer Menor en en el putamen, pálido y tálamo
en la parálisis supranuclear progresiva
criminar PSP de EP [26]. En las secuencias tensor dif-
fusion, se valora la movilidad del agua en axones, vasos Menor en el puente, pedúnculo cerebeloso medio,
putamen y giro precentral en la atrofia multisistémica
y células gliales, y permite visualizar vías. En la EP se
ha descrito una menor fracción de anisotropía en la sus- SNpc: sustancia negra pars compacta.
tancia negra [27]. En imágenes por transferencia de
magnetización hay datos diferenciales de la PSP y de la
AMS [28].
Hay también muchos datos del distinto comportamiento Existen muchos datos de técnicas de imagen obtenidas por
funcional de diferentes áreas cerebrales mediante RM [21]. Se tomografía computarizada por emisión de fotón simple (SPECT)
han realizado estudios antes y tras la administración de levodo- o tomografía por emisión de positrones (PET) tras la introduc-
pa u otras terapias, tras realización de distintas tareas motoras ción de diferentes sustancias ligadas a determinados isótopos,
manuales u orofofaciales o de activación mediante tareas cog- como 99Tc, 123I, 201Tl y 132Xe para SPECT, u 11C, 13N , 15O y 18F
nitivas. También aportan interesantes datos funcionales sobre la para PET). Son múltiples los radiotrazadores empleados en es-
diferente captación en determinadas áreas tras realizar modifi- tudiar la EP, y cada uno mide uno o más aspectos de la funcio-
caciones farmacológicas (metilfenidato, cocaína, anfetamina...) nalidad del sistema dopaminérgico u otros sistemas neurotrans-
o tras estimulación magnética transcraneal. Por ejemplo, se ha misores [29] (Tabla III). El transportador de dopamina (DA)
observado una falta de activación del área motora suplementa- constituye un buen lugar de monitorización del estado presináp-
ria posterior, del cíngulo anterior y del córtex prefrontal dorso- tico de la vía nigroestriatal, y son múltiples los estudios con di-
lateral en la EP. ferentes radioligandos empleados para su valoración, bien mar-
484 REV NEUROL 2009; 48 (9): 482-488
GENÉTICA Y NEUROIMAGEN EN PARKINSON
Tabla III. Resumen de diferentes marcadores empleados en técnicas de neuroimagen fun- dos los planteamientos surgidos tras la demos-
cional por SPECT o PET en la enfermedad de Parkinson. tración de esta evidencia. Un reciente estudio
18 no realizado en el seno de un ensayo clínico ha
Metabólicos generales F deoxiglucosa PET
revisado los datos del seguimiento de 155 afec-
99
Tc HMPAO SPECT tos con captación normal en el 123I FP-CIT
99 SPECT. Tras un período medio de 2,4 años, en
Tc ECD SPECT
146 de ellos (97%) se planteó que el diagnóstico
11
Sistema dopaminérgico presináptico C FE-CIT PET inicial había sido erróneo y se había cambiado
transportador de dopamina al de parkinsonismo no degenerativo o temblor
11
F FP-CIT PET
[36]. Los hallazgos radiológicos en las formas
99
Tc trodat PET genéticas de EP son similares a los de la enfer-
medad esporádica [37-40]. Quizás la única sal-
123
I β-CIT SPECT
vedad se encuentra en el parkinsonismo asocia-
123
Sistema dopaminérgico presináptico: I ioflupano SPECT do a mutaciones en parkina, donde los datos son
dopadecarboxilasa más heterogéneos [34,37-40].
123
I FP-CIT SPECT
Los resultados de los análisis de correlación
18
Sistema dopaminérgico presináptico: F DOPA PET entre la captación y la gravedad del cuadro clíni-
transportador de vesículas co son controvertidos. Tampoco todos los resul-
Sistema dopaminérgico postsináptico: 11
C tetrabenacina PET tados de estudios longitudinales muestran una
receptores DA2 similar evolución de la alteración radiológica
123
I-2-espiperona SPECT con el tiempo. No es clara su aportación en
Otros marcadores del 11
C raclopride PET cuanto a la valoración de la eficacia de terapias.
sistema dopaminérgico Por ejemplo, se ha objetivado mejoría de capta-
123
I IBZM SPECT ción sin mejoría clínica y empeoramiento de la
Otros marcadores de distintos sistemas 11
C WAY 5 HT1a, temblor captación en pacientes que, sin embargo, clíni-
neurotransmisores y datos clínicos relacionados camente habían mejorado. Un ejemplo de estas
11
con la enfermedad de Parkinson y marcadores C CRTI 32 NA, depresión discordancias clinicorradiológicas (en este caso,
en investigación sobre etiopatogenia 11 con la captación de 18F DOPA PET) se encontró
C Pittsburgh amiloide, deterioro cognitivo
en el estudio a largo plazo de pacientes someti-
11
C diprenorfina NK1, discinesias dos a infusión intracraneal del factor neurotrófi-
11
C verapamilo, alteración de la BHE co derivado de las células gliales [41].
Analizando todos los datos aportados por
11 18
C-(R) PK11195, microglía activada F DOPA PET, 11C dihidrotetrabenacina PET,
BHE: barrera hematoencefálica; PET: tomografía por emisión de positrones; SPECT: tomografía
123
I β-CIT SPECT y 18F deoxiglucosa PET, un
computarizada por emisión de fotón simple. estudio consensuado por múltiples autores con-
cluye que ninguno de ellos puede considerarse
actualmente biomarcador de la EP [42].
cados con 123I o 99Tc para SPECT, bien con 11C , 18F, 15O o 13N Recientemente se han publicado también muchos estudios
para PET [30-33]. de ecografía transcraneal en los que en los afectados de EP se
En global, estas pruebas aportan datos de que el sistema do- detecta una hiperecogenicidad en el mesencéfalo, sobre todo
paminérgico presináptico está alterado en la mayoría de parkin- en el lado contralateral al hemicuerpo más afecto. Es una ima-
sonismos degenerativos, y de que, mientras que en la EP la gen que puede observarse de forma muy precoz, porque inclu-
marcación de receptores de DA es normal, se encuentra dismi- so se ha detectado en portadores asintomáticos de mutaciones
nuida en la AMS y en la PSP. Las técnicas que marcan el siste- en parkina. Corresponde probablemente a depósitos de hierro,
ma dopaminérgico son muy sensibles, detectan la disminución pero no se incrementa según pasa el tiempo, por lo que no pa-
de la captación de forma muy precoz, incluso antes del inicio rece constituir un buen marcador de progresión [43]. Un estu-
de la clínica en portadores de mutaciones en alfa sinucleína dio apunta que también es válido para diferenciar la EP de la
[34]. La combinación de la realización de dos estudios, uno que AMS [44]. Desgraciadamente, estudios más recientes le restan
valora el sistema presináptico y otro el postisnáptico, incremen- especificidad, porque también se ha observado la alteración en
ta la certeza diagnóstica [35]. La técnica mas implantada en Es- un 13% de controles y en un 40% de depresivos [45]. Los estu-
paña es el 123I-ioflupano-CIT SPECT (DaT-SCAN ®), en la que dios publicados se han realizado con diferentes metodologías y
se mide la unión al transportador de DA de forma sujetiva o formas de análisis, en diferentes poblaciones de afectos de EP
bien cuantificada. Los datos de la ficha técnica del producto (en cuanto a edad, etnia, geografía, clínica…) y comparados
afirman que posee un 97,5% de sensibilidad para diferenciar con distintos grupos control. Deberían realizarse siempre co-
EP, AMS o PSP (disminución de la captación) de controles, rrecciones con la imagen estructural para obviar los cambios
temblor esencial, parkinsonismo psicógeno, farmacológico o explicables por la atrofia. Además, se ha observado que la cap-
vascular, donde la captación es normal. No todo parece tan cla- tación obtenida mediante técnicas funcionales puede cambiar
ro. De hecho, son múltiples los casos de personas afectadas de tras modificaciones farmacológicas o incluso ante determina-
EP en los que se ha objetivado una captación normal. Esas per- dos estados emocionales difícilmente cuantificables, como ba-
sonas han recibido el apelativo de SWEDD (subject without jo efecto placebo [46]. Aún están pendientes resultados de aná-
evidence of dopaminergic degeneration) [36]. Son controverti- lisis coste-eficacia.
REV NEUROL 2009; 48 (9): 482-488 485
A. ROJO, ET AL
En conjunto, no existe ninguna prueba de neuro- Tabla IV. Parkinsonismos con tratamiento etiológico y/o potencialmente reversibles:
imagen totalmente específica para el diagnóstico de la pruebas que habitualmente ofrecen el diagnóstico de estas entidades.
EP.
Enfermedad cerebrovascular RM convencional
Hidrocefalia RM convencional
CONCLUSIONES
Enfermedad de Wilson RM convencional, test genéticos
Una vez revisada la multitud de test genéticos y de
neuroimagen aplicables en personas afectadas de EP, Neurodegeneración con acúmulo de hierro RM convencional, test genéticos
planteamos cuál puede ser su utilidad. Usualmente, (enfermedad de Hallervorden-Spatz)
podemos solicitarlos para ayudar a establecer un diag- Neuroferritinopatía, aceruloplasminemia
nóstico en fases iniciales o para diferenciarlo de otras
entidades que cursen con temblor o parkinsonismo Parkinsonismo psicógeno RM convencional, test genéticos
[47,48]. Como ya se ha mencionado, otras aplicacio- Parkinsonismo por fármacos
nes de determinadas pruebas de neuroimagen funcio-
nal han sido valorar su capacidad para evaluar la pro- Metabolopatías (aciduria glutárica, RM convencional, test genéticos
fucosidosis, síndrome de Gaucher...)
gresión o la respuesta a determinados tratamientos.
Para diagnosticar la EP, usualmente, se emplean Encefalomiopatías mitocondriales RM convencional, test genéticos
criterios clínicos [23,49]. Existe un porcentaje de erro-
Calcificaciones de los ganglios basales RM convencional, test genéticos
res diagnósticos que se minimizan cuando éste se esta-
blece por un experto en trastornos del movimiento, en RM: resonancia magnética.
el que las cifras de error son menores al 10% [23].
El diagnóstico puede ser dificultoso en fases muy
precoces de la enfermedad, y es entonces cuando requerimos la tington o de demencia frontotemporal. En algunos de estos ca-
realización de pruebas confirmatorias. Hay que tener en cuenta sos, puede ser útil emplear otros estudios genéticos diferentes a
que las cifras aportadas de sensibilidad y especificidad de mu- los de la EP. Tras un metaanálisis de 185 estudios realizados con
chas pruebas funcionales se basan en estudios realizados en ca- SPECT empleado para el diagnóstico de EP, en el que única-
sos típicos de EP frente a controles sanos, y que la verdadera mente se seleccionaron como de calidad 32 de ellos, se conclu-
aportación de estas pruebas en casos verdaderamente dudosos o yó que la mayor potencia estadística para establecer un diagnós-
muy precoces es en la actualidad desconocida. Cabe plantearse tico diferencial que se ofrece es con el temblor esencial [50],
también, atendiendo a principios éticos, si establecer un diag- pero, posiblemente, muchos de ellos se podrían haber diagnos-
nóstico en fases muy precoces, cuando la clínica aún no es evi- ticado basándose sólo en los datos clínicos.
dente, tiene en la actualidad algún beneficio para el paciente o Otra posible utilidad práctica sería la de evitar tratamientos
sólo nos esforzamos en solicitar el test movidos por una curiosi- innecesarios, pero cabe plantearse si, ante un síndrome rígido
dad que no tiene en cuenta el posible efecto perjudicial que pue- hipocinético y pese a una imagen funcional normal, no debe en-
de suponer en la persona y que podría verse satisfecha dejando sayarse levodopa o un agonista dopaminérgico. Posiblemente
únicamente transcurrir el tiempo. En algunos casos, la confir- todos estos estudios genéticos y de neuroimagen comiencen a
mación diagnóstica sí que puede ser beneficiosa, al evitar la reali- emplearse para seleccionar subgrupos de pacientes para deter-
zación de otras pruebas innecesarias y eliminar la angustia pro- minadas investigaciones y se deba considerar a las personas
vocada por la incertidumbre. portadoras de mutaciones una población exquisita para el estu-
El principal objetivo práctico hoy en día supone descartar la dio de biomarcadores y de terapias neuroprotectoras. La utili-
presencia de parkinsonismos con un tratamiento etiológico y/o dad puede también variar en función de quién estime su realiza-
potencialmente reversibles. Como de sobra es conocido, mu- ción: el médico, el paciente o su familia, o el investigador que
chas de estas entidades pueden diagnosticarse a través de imá- trabaja en profundizar en los conocimientos etiopatogénicos o
genes por resonancia convencional o mediante otros test genéti- en encontrar un tratamiento neuroprotector.
cos diferentes a los de la EP (Tabla IV). De la lectura de esta ta- Las personas y los familiares de afectados de EP están inte-
bla puede interpretarse que la realización de una prueba de ima- resados en conocer la posible implicación de la genética en su
gen funcional con un marcador del sistema dopaminérgico pue- enfermedad. Una encuesta realizada en Alemania destaca que
de ser la única herramienta para apoyar el diagnóstico de un un 70% de las personas se realizaría un estudio genético, ale-
parkinsonismo psicógeno o inducido por fármacos. gando principalmente razones familiares o conyugales. Su deci-
También puede ser de interés establecer el diagnóstico dife- sión era independiente de las distintas variables sociodemográ-
rencial con otros parkinsonismos degenerativos, como la AMS, ficas y asociadas a la enfermedad [51]. Tras una inesperada alta
la PSP o la degeneración corticobasal, no por que exista una frecuencia de detección de mutaciones en LRKK2 en judíos as-
clara diferenciación actual en la actitud terapéutica, sino por es- kenazíes en Israel, se planteó mediante carta a 554 personas si
tablecer un diferente pronóstico. En este caso, las pruebas que deseaban conocer o no su condición genética. Un 40% afirmó
más apoyo pueden ofrecer son, como ya se ha mencionado, la que deseaba conocerlo. Como variables asociadas a esta res-
RM o las técnicas de SPECT/PET con marcaje del sistema dopa- puesta afirmativa, encontraron una edad joven y una menor du-
minérgico postsináptico, ya que las imágenes obtenidas me- ración de la enfermedad [52]. Muchas veces las personas perte-
diante marcadores presinápticos son muy similares. También necientes a familias en las que hay casos de personas afectadas
puede plantearse la diferenciación de casos inusuales de disto- de EP sufren una inquietud por conocer sobre sí mismos o sobre
nía que responde a levodopa u otras distonías con parkinsonis- su descendencia, y se plantea que la realización de una prueba
mo asociado, así como de casos atípicos de enfermedad de Hun- genética puede ayudar a mejorar su incertidumbre y ansiedad.
486 REV NEUROL 2009; 48 (9): 482-488
GENÉTICA Y NEUROIMAGEN EN PARKINSON
En una respuesta global, sabemos que tienen un mayor riesgo síntomas atípicos que puedan sugerir otro diagnóstico, o ante
de sufrir EP que el resto de la población, que su riesgo acumu- personas que no muestran una adecuada tolerancia o respuesta a
lativo es de un 3-7%, y que en la actualidad no hay una actitud la medicación. Casos en los cuales puede ser también de mucha
que conozcamos que pueda ayudar a prevenirla. Antes de proce- utilidad la objetividad es ante personas que no aceptan el diag-
der al planteamiento de la realización de un estudio genético, nóstico o ante litigios legales.
deberían plantearse los aspectos éticos, legales, sociales, cultu- Una propuesta podría ser que, antes de plantear la realización
rales y religiosos particulares del caso, y asegurarse de la priva- de una prueba a un paciente, pensar si lo que realizamos es un test
cidad, la confidencialidad y el respeto a la elección del pacien- clínico o un test de investigación.
te, dado que los resultados pueden conllevar decisiones vitales y Cuando los resultados tienen un propósito diagnóstico, pre-
reproductivas muy importantes. Asimismo, debe contemplarse ventivo o terapéutico, hablamos de estudios clínicos. Un estudio
la posible extensión de información a otros miembros de la fa- de investigación es aquél que no tiene una aplicación clínica in-
milia y sopesarse el riesgo de que un estudio genético pueda mediata, y se realiza para comprender la enfermedad y contri-
aportar información no deseada (como, por ejemplo, una falsa buir a avanzar y desarrollar estudios clínicos. En este caso, ge-
paternidad) o producir una discriminación en el ámbito laboral neralmente los resultados no deberían conocerse por el paciente
o en la obtención de seguros. o su familia, debe asegurarse la libertad, la confidencialidad y
El consejo genético en EP es complejo. El sustrato genético valorarse la implicación emocional. Debería obtenerse, tras ase-
es múltiple, relativamente reciente y en continua ampliación. La gurar la adecuada interpretación de la información, un consenti-
penetrancia de las mutaciones no se conoce del todo. Actual- miento y establecer un compromiso de ofrecimiento futuro de
mente no existen unas normas generales, y el consejo genético revelación de resultados en caso de tener éstos una repercusión
debe aplicarse de forma individualizada y sin olvidar la siempre clínica.
beneficiosa regla del ‘primum nil nocere’ [2,3,53]. Lo que parece obvio es que la realización de todas estas prue-
En el caso del médico que los solicita con objetivos diag- bas ha aportado grandes adelantos sobre los mecanismos etio-
nósticos, ya se han comentado las limitaciones actuales. Segu- patogénicos implicados en la EP (Tabla I), ha permitido el desa-
ramente el planteamiento debería ser distinto ante un paciente rrollo de modelos transgénicos y la investigación de diferentes
con una enfermedad de inicio juvenil o ante uno en que comien- dianas terapéuticas. Proseguir con estos estudios permitirá re-
za en la senectud, ante una persona con una marcada historia fa- solver muchas de las incógnitas que se han mencionado y en-
miliar de EP, si la enfermedad comienza presentando signos o contrar la terapia definitiva deseada para la EP.
BIBLIOGRAFÍA
1. Tan EK, Jankovic J. Genetic testing in Parkinson disease: promises and Evaluation of LRRK2 G2019S penetrance: relevance for genetic coun-
pitfalls. Arch Neurol 2006; 63: 1232-7. seling in Parkinson disease. Neurology 2007; 68: 1141-3.
2. Klein C, Schlossmacher MG. Parkinson disease, 10 years after its ge- 15. Kay DM, Moran D, Moses L, Poorkaj P, Zabetian CP, Nutt J, et al. Het-
netic revolution. Multiple clues to a complex disorder. Neurology 2007; erozygous parkin point mutations are as common in control subjects as
69: 2093-104. in Parkinson’s patients. Ann Neurol 2007; 61: 47-54.
3. Klein C, Lohmann-Hedrich K. Impact of recent genetic findings in Par- 16. Funayama M, Li Y, Tomiyama H, Yoshino H, Imamichi Y, Yamamoto
kinson’s disease. Curr Opin Neurol 2007; 20: 453-64. M, et al. Leucine-rich repeat kinase 2 G2385R variant is a risk factor for
4. Douglas MR, Lewthwaite AJ, Nicholl DJ. Genetics of Parkinson’s dis- Parkinson disease in Asian population. Neuroreport 2007; 18: 273-5.
ease and parkinsonism. Expert Rev Neurother 2007; 7: 657-66. 17. Ahn TB, Kim SY, Kim JY, Park SS, Lee DS, Min HJ, et al. Alpha-
5. Strauss KM, Martins LM, Plun-Favreau H, Marx FP, Kautzmann S, Berg synuclein gene duplication is present in sporadic Parkinson disease.
D, et al. Loss of function mutations in the gene encoding Omi/HtrA2 in Neurology 2008; 70: 43-9.
Parkinson’s disease. Hum Mol Genet 2005; 14: 2099-111. 18. Mellick GD. CYP450, genetics and Parkinson’s disease: gene X envi-
6. Hoenicka J, Vidal L, Morales B, Ampuero I, Jiménez-Jiménez FJ, ronment interactions hold the key. J Neural Transm Suppl 2006; 70:
Berciano J, et al. Molecular findings in familial Parkinson disease in 159-65.
Spain. Arch Neurol 2002; 59: 966-70. 19. Casarejos MJ, Menéndez J, Solano RM, Rodríguez-Navarro JA, Gar-
7. Paisán-Ruiz C, Jain S, Evans EW, Gilks WP, Simón J, Van der Brug M, cía de Yébenes J, Mena MA. Susceptibility to rotenone is increased in
et al. Cloning of the gene containing mutations that cause PARK8- neurons from parkin null mice and is reduced by minocycline. J Neuro-
linked Parkinson’s disease. Neuron 2004; 44: 595-600. chem 2006; 97: 934-46.
8. Lesage S, Durr A, Tazir M, Lohmann E, Leutenegger AL, Janin S, et al. 20. Singh S, Das T, Ravindran A, Chaturvedi RK, Shukla Y, Agarwal AK, et
French Parkinson’s Disease Genetics Study Group. LRRK2 G2019S as al. Involvement of nitric oxide in neurodegeneration: a study on the ex-
a cause of Parkinson’s disease in North African Arabs. N Engl J Med perimental models of Parkinson’s disease. Redox Rep 2005; 10: 103-9.
2006; 354: 422-3. 21. Piccini P. Neurodegenerative movement disorders: the contribution of
9. Ishihara L, Gibson RA, Warren L, Amouri R, Lyons K, Wielinski C, et al. functional imaging. Curr Opin Neurol 2004; 17: 459-66.
Screening for Lrrk2 G2019S and clinical comparison of Tunisian and 22. Van Eimeren T, Siebner HR. An update on functional neuroimaging of
North American Caucasian Parkinson’s disease families. Mov Disord parkinsonism and dystonia. Curr Opin Neurol 2006; 19: 412-9.
2007; 22: 55-61. 23. Hughes AJ, Daniel SE, Lees AJ. Improved accuracy of clinical diagno-
10. Ozelius LJ, Senthil G, Saunders-Pullman R, Ohmann E, Deligtisch A, sis of Lewy body Parkinson’s disease. Neurology 2001; 57: 1497-9.
Tagliati M, et al. LRRK2 G2019S as a cause of Parkinson’s disease in 24. Bhattacharya K, Saadia D, Eisenkraft B, Yahr M, Olanow W, Drayer
Ashkenazi Jews. N Engl J Med 2006; 354: 424-5. B, et al. Brain magnetic resonance imaging in multiple-system atro-
11. Mata IF, Ross OA, Kachergus J, Huerta C, Ribacoba R, Moris G, et al. phy and Parkinson disease: a diagnostic algorithm. Arch Neurol 2002;
LRRK2 mutations are a common cause of Parkinson’s disease in Spain. 59: 835-42.
Eur J Neurol 2006; 13: 391-4. 25. Minati L, Grisoli M, Carella F, De Simone T, Bruzzone MG, Savoiardo
12. Gaig C, Ezquerra M, Martí MJ, Muñoz E, Valldeoriola F, Tolosa E. M. Imaging degeneration of the substantia nigra in Parkinson disease
LRRK2 mutations in Spanish patients with Parkinson disease: frequen- with inversion-recovery MR imaging. AJNR Am J Neuroradiol 2007;
cy, clinical features, and incomplete penetrance. Arch Neurol 2006; 63: 28: 309-13.
377-82. 26. Seppi K, Schocke MF, Esterhammer R, Kremser C, Brenneis C, Mue-
13. Zabetian CP, Morino H, Ujike H, Yamamoto M, Oda M, Maruyama H, ller J, et al. Diffusion-weighted imaging discriminates progressive supra-
et al. Identification and haplotype analysis of LRRK2 G2019S in Ja- nuclear palsy from PD, but not from the parkinson variant of multiple
panese patients with Parkinson disease. Neurology 2006; 27: 697-9. system atrophy. Neurology 2003; 60: 922-7.
14. Goldwurm S, Zini M, Mariani L, Tesei S, Miceli R, Sironi F, et al. 27. Chan LL, Rumpel H, Yap K, Lee E, Loo HV, Ho GL, et al. Case con-
REV NEUROL 2009; 48 (9): 482-488 487
A. ROJO, ET AL
trol study of diffusion tensor imaging in Parkinson’s disease. J Neurol 41. Lang AE, Gill S, Patel NK, Lozano A, Nutt JG, Penn R, et al. Randomized
Neurosurg Psychiatry 2007; 78: 1383-6. controlled trial of intraputamenal glial cell line-derived neurotrophic
28. Au WL, Adams JR, Troiano A, Stoessl AJ. Neuroimaging in Parkin- factor infusion in Parkinson disease. Ann Neurol 2006; 59: 459-66.
son’s disease. J Neural Transm Suppl 2006; 70: 241-8. 42. Ravina B, Eidelberg D, Ahlskog JE, Albin RL, Brooks DJ, Carbon M,
29. Shih MC, Hoexter MQ, Andrade LA, Bressan RA. Parkinson’s disease et al. The role of radiotracer imaging in Parkinson disease. Neurology
and dopamine transporter neuroimaging: a critical review. Sao Paulo 2005; 64: 208-15.
Med J 2006; 124: 168-75. 43. Berg D, Merz B, Reiners K, Naumann M, Becker G. Five-year follow-
30. Brooks DJ. PET studies on the function of dopamine in health and Parkin- up study of hyperechogenicity of the substantia nigra in Parkinson’s
son’s disease. Ann N Y Acad Sci 2003; 991: 22-35. disease. Mov Disord 2005; 20: 383-5.
31. Brooks DJ. Neuroimaging in Parkinson’s disease. NeuroRx 2004; 1: 44. Walter U, Niehaus L, Probst T, Benecke R, Meyer BU, Dressler D.
243-54. Brain parenchyma sonography discriminates Parkinson’s disease and
32. Colloby S, O’Brien J. Functional imaging in Parkinson’s disease and de- atypical parkinsonian syndromes. Neurology 2003; 60: 74-7.
mentia with Lewy bodies. J Geriatr Psychiatry Neurol 2004; 17: 158-63. 45. Walter U, Hoeppner J, Prudente-Morrissey L, Horowski S, Herpertz SC,
33. Piccini P, Brooks DJ. New developments of brain imaging for Parkin- Benecke R. Parkinson’s disease-like midbrain sonography abnormalities
son’s disease and related disorders. Mov Disord 2006; 21: 2035-41. are frequent in depressive disorders. Brain 2007; 130: 1799-807.
34. Kruger R, Kuhn W, Leenders KL, Sprengelmeyer R, Muller T, Woitalla 46. De la Fuente-Fernández R, Ruth TJ, Sossi V, Schulzer M, Calne DB,
D, et al. Familial parkinsonism with synuclein pathology: clinical and Stoessl AJ. Expectation and dopamine release: mechanism of the pla-
PET studies of A30P mutation carriers. Neurology 2001; 56: 1355-62. cebo effect in Parkinson’s disease. Science 2001; 293: 1164-6.
35. Lorenzo-Bosquet C, Hernández-Vara J, Castell-Conesa J, Miquel-Ro- 47. Bermejo PE, Ruiz-Huete C, Terrón C. Relación entre temblor esencial,
dríguez F. Neuroimagen funcional mediante SPECT en la enfermedad enfermedad de Parkinson y demencia con cuerpos de Lewy. Rev Neu-
de Parkinson y los parkinsonismos. Rev Neurol 2008; 46: 430-5. rol 2007; 45: 689-94.
36. Marshall VL, Patterson J, Hadley DM, Grosset KA, Grosset DG. Two- 48. Kulisevsky J, Linazasoro-Cristóbal G, Luquin MR, Valldeoriola F, Ve-
year follow-up in 150 consecutive cases with normal dopamine trans- la L, eds. I Encuentro Nacional de Expertos en Enfermedad de Parkin-
porter imaging. Nucl Med Commun 2006; 27: 933-7. son. Rev Neurol 2008; 46 (Supl 2): S5-53.
37. Adams JR, Van Netten H, Schulzer M, Mak E, Mckenzie J, Strongosky 49. Gelb DJ, Oliver E, Gilman S. Diagnostic criteria for Parkinson disease.
A, et al. PET in LRRK2 mutations: comparison to sporadic Parkin- Arch Neurol 1999; 56: 33-9.
son’s disease and evidence for presymptomatic compensation. Brain 50. Vlaar AM, Van Kroonenburgh MJ, Kessels AG, Weber WE. Meta-
2005; 128: 2777-85. analysis of the literature on diagnostic accuracy of SPECT in parkin-
38. Khan NL, Jain S, Lynch JM, Pavese N, Abou-Sleiman P, Holton JL, et sonian syndromes. BMC Neurol 2007; 7: 27.
al. Mutations in the gene LRRK2 encoding dardarin (PARK8) cause 51. Jacobs H, Latza U, Vieregge A, Vieregge P. Attitudes of young patients
familial Parkinson’s disease: clinical, pathological, olfactory and func- with Parkinson’s disease towards possible presymptomatic and prena-
tional imaging and genetic data. Brain 2005; 128: 2786-96. tal genetic testing. Genet Couns 2001; 12: 55-67.
39. Khan NL, Scherfler C, Graham E, Bhatia KP, Quinn N, Lees AJ, et al. 52. Moore O, Shifrin C, Levin S, Knaanin J, Gliadi N. Do Ashkenazi Jew
Dopaminergic dysfunction in unrelated, asymptomatic carriers of a patients with Parkinson’s disease want to be acquainted about their
single parkin mutation. Neurology 2005; 64: 134-6. G2019S mutation status in the LRRK2 gene? Mov Disord 2007 (Suppl
40. Shih MC, Felicio AC, De Oliveira Godeiro-Junior C, De Carvalho 16): S131.
Aguiar P, De Andrade LA, Ferraz HB, et al. Molecular imaging in he- 53. Klein C, Schlossmacher MG. The genetics of Parkinson disease: impli-
reditary forms of parkinsonism. Eur J Neurol 2007; 14: 359-68. cations for neurological care. Nat Clin Pract Neurol 2006; 2: 136-46.
THE VALUE OF GENETIC AND NEUROIMAGING STUDIES IN
THE DIFFERENTIAL DIAGNOSIS OF PARKINSON’S DISEASE
Summary. Introduction. Parkinson’s disease (PD) is usually diagnosed on the basis of clinical criteria. Today there are genetic
and neuroimaging tests that can make a valuable contribution to the study of this disease. Aims. To review the recent advances
in genetic studies and in neuroimaging techniques applied to PD, as well as looking at their shortcomings, and to analyse the
reasons for conducting such tests and to discuss their importance in everyday clinical practice, including a series of
reflections on ethical issues. Development. The list of genetic disorders associated with PD is continually being extended and
reviewed, and pathological alterations have been defined in at least 10 genes. The most frequent mutations in our setting are
to be found in the parkin gene (PARK2) and in the LRKK2 gene (PARK8). These mutations have a penetrance that is not very
high and their clinical expression is variable. Images obtained by nuclear resonance, single-photon emission tomography,
positron emission tomography or by cranial sonography provide data that can help in the diagnosis of PD and to differentiate
it from other diseases. None of the techniques is wholly specific, however, and there are clinico-radiological disagreements.
Conclusions. The detection of mutations does not allow a clear prognostic differentiation or a distinct therapeutic attitude to
be established. The value of neuroimaging techniques in very early phases and in dubious cases is still not altogether clear.
Whether establishing a diagnosis in very early phases currently offers the patient any benefits is subject to debate. It would be
advisable to attempt to distinguish between tests that are carried out for clinical reasons and those which are conducted for
research purposes so as to be able to proceed in the most suitable manner. [REV NEUROL 2009; 48: 482-8]
Key words. Diagnosis. Ethics. Genetics. Parkinson’s disease. Resonance. SPECT.
488 REV NEUROL 2009; 48 (9): 482-488
También podría gustarte
- Instructivo 2022 CompletoDocumento39 páginasInstructivo 2022 CompletofelipitodenicoleAún no hay calificaciones
- Cuadernillo de La MDocumento24 páginasCuadernillo de La Mfelipitodenicole100% (1)
- Cuadernillo de La LDocumento24 páginasCuadernillo de La LfelipitodenicoleAún no hay calificaciones
- 756-Texto Del Artículo-3308-1-10-20200713Documento20 páginas756-Texto Del Artículo-3308-1-10-20200713felipitodenicoleAún no hay calificaciones
- Desafio 1Documento8 páginasDesafio 1felipitodenicoleAún no hay calificaciones
- Cuadernillo Fonema M-1Documento16 páginasCuadernillo Fonema M-1felipitodenicole100% (5)
- Mnr502 s3 Taub Others - En.esDocumento10 páginasMnr502 s3 Taub Others - En.esfelipitodenicoleAún no hay calificaciones
- DeglucionDocumento262 páginasDeglucionfelipitodenicoleAún no hay calificaciones
- LabelsDocumento2 páginasLabelsfelipitodenicoleAún no hay calificaciones
- SCBO70AN21Documento4 páginasSCBO70AN21felipitodenicoleAún no hay calificaciones
- Test MmseDocumento3 páginasTest Mmsefelipitodenicole100% (1)
- ES y DemenciaDocumento12 páginasES y DemenciafelipitodenicoleAún no hay calificaciones
- LabelsDocumento2 páginasLabelsfelipitodenicoleAún no hay calificaciones
- Test de PfeifferDocumento2 páginasTest de Pfeifferfelipitodenicole100% (4)
- Escala de DowtonDocumento1 páginaEscala de DowtonfelipitodenicoleAún no hay calificaciones
- Escala Funcional Marcha y EquilibrioDocumento1 páginaEscala Funcional Marcha y EquilibriofelipitodenicoleAún no hay calificaciones
- FichaEscalaMancilla Granada PDFDocumento4 páginasFichaEscalaMancilla Granada PDFfelipitodenicoleAún no hay calificaciones
- Test de Katz PDFDocumento4 páginasTest de Katz PDFfelipitodenicoleAún no hay calificaciones
- Cuestionario PARQ PDFDocumento1 páginaCuestionario PARQ PDFfelipitodenicoleAún no hay calificaciones
- Escala de Dismovilidad de DinamarcaDocumento1 páginaEscala de Dismovilidad de Dinamarcafelipitodenicole100% (3)
- Práctico Movilización Miofascial y Masoterapia PDFDocumento15 páginasPráctico Movilización Miofascial y Masoterapia PDFfelipitodenicoleAún no hay calificaciones
- Cognitivo TEC - ERLADocumento1 páginaCognitivo TEC - ERLAfelipitodenicoleAún no hay calificaciones
- Escala Moral PhiladelphiaDocumento1 páginaEscala Moral PhiladelphiaMadeley Yáñez Navarro0% (1)
- Manejo de Enojo o IraDocumento19 páginasManejo de Enojo o IraLilia N. RodríguezAún no hay calificaciones
- Programa Entrenamiento Golf en CasaDocumento4 páginasPrograma Entrenamiento Golf en CasaLeidy vanesa Grajales patiñoAún no hay calificaciones
- El Pinche Tirano de Carlos CastanedaDocumento3 páginasEl Pinche Tirano de Carlos Castanedaoflorez72Aún no hay calificaciones
- AGUADocumento8 páginasAGUAJosé Paredes DiazAún no hay calificaciones
- Informe CosmeticosDocumento7 páginasInforme CosmeticosAURA VALENTINA LEON SALCEDOAún no hay calificaciones
- 10 Taller Liquidación Horas ExtrasDocumento2 páginas10 Taller Liquidación Horas ExtrasJuan DavidAún no hay calificaciones
- Neuropsiquiatria 1 2012Documento106 páginasNeuropsiquiatria 1 2012Jorg MankeAún no hay calificaciones
- Mito La Madre de AguaDocumento9 páginasMito La Madre de AguaMarely RamirezAún no hay calificaciones
- Aptitud Verbal Juan Manuel Salazar MonjeDocumento7 páginasAptitud Verbal Juan Manuel Salazar MonjejoseAún no hay calificaciones
- Presentacion EscarasDocumento13 páginasPresentacion EscarasNordaydiseño acaAún no hay calificaciones
- Evaluación DiagnosticaDocumento3 páginasEvaluación DiagnosticaLirioluz AmatAún no hay calificaciones
- Monografia de CuchumbayaDocumento4 páginasMonografia de CuchumbayahathollAún no hay calificaciones
- Jesus Esta Vivo!!!!! PDF Nivea de JesusDocumento22 páginasJesus Esta Vivo!!!!! PDF Nivea de JesusNívea De jesusAún no hay calificaciones
- Las Pinturas y BarnicesDocumento7 páginasLas Pinturas y BarnicesenriqueAún no hay calificaciones
- BlindajesDocumento90 páginasBlindajesinmarorAún no hay calificaciones
- Salmo 39Documento7 páginasSalmo 39grodryqpAún no hay calificaciones
- Intestino DelgadoDocumento15 páginasIntestino DelgadoNikoOle Luna RezendiizAún no hay calificaciones
- Proteccion Dentino Pulpar JaciDocumento6 páginasProteccion Dentino Pulpar Jacidave100% (1)
- Manejo Y Actuación Ante La Inversión UterinaDocumento1 páginaManejo Y Actuación Ante La Inversión UterinaAle FermataAún no hay calificaciones
- Estudio de CasoDocumento9 páginasEstudio de Casodaniela huertas teranAún no hay calificaciones
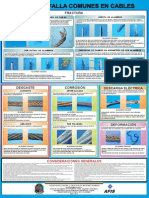
- Cables PDFDocumento1 páginaCables PDFSepulveda JuanAún no hay calificaciones
- Serum CaseroDocumento5 páginasSerum Caserolouisa clarkAún no hay calificaciones
- Informe Visita ObraDocumento29 páginasInforme Visita ObraBrandon RinconAún no hay calificaciones
- Clase TanatologíaDocumento15 páginasClase Tanatologíaema emanuAún no hay calificaciones
- Guia Ciclo Del CarbonoDocumento3 páginasGuia Ciclo Del CarbonoGhis P. PeraltaAún no hay calificaciones
- MetronidazolDocumento5 páginasMetronidazolMaritere Ramirez SosaAún no hay calificaciones
- Estabilidad Del PozoDocumento16 páginasEstabilidad Del PozoLauriTerrazasMartines100% (2)
- Andres HuayllaDocumento6 páginasAndres HuayllaJuan kIAún no hay calificaciones
- Formulario - Lista de Comprobación EPF 1Documento4 páginasFormulario - Lista de Comprobación EPF 1Juan Angel ZuñigaAún no hay calificaciones
- La Neuropsicología Es Una Neurociencia Conductual Que Se Encarga de Estudiar La Relación Del Cerebro y La ConductaDocumento2 páginasLa Neuropsicología Es Una Neurociencia Conductual Que Se Encarga de Estudiar La Relación Del Cerebro y La ConductaPetula Mariana Lopez ReyesAún no hay calificaciones