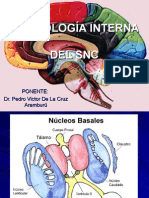
BIOLOGIA ESTRUCTURAL 1
CONCEPTO:
La biología estructural es una rama de la biología molecular, la bioquímica
y la biofísica que estudia la estructura de macromoléculas biológicas tales
como las proteínas y los ácidos nucleicos, el origen de esta estructura y su
relación con la función biológica de las macromoléculas. La biología
estructural es de gran interés para los biólogos, puesto que las proteínas,
el ADN y el ARN llevan a cabo tareas vitales para los procesos celulares y
su función específicas está íntimamente ligada a su conformación
tridimensional; la configuración estructural de las biomoléculas depende a
su vez de su composición básica o secuencia de aminoácidos, en el caso de
las proteínas, o nucleótidos de los ácidos nucleicos.
APLICACIÓN:
Las proteínas, ácidos nucleicos y los complejos macromoleculares que forman orquestan todos los
procesos celulares. El mecanismo de actuación de las macromoléculas está íntimamente ligado a la
disposición de las cadenas de aminoácidos y nucleótidos: la forma de la molécula determina qué
compuestos (hormonas, toxinas, nutrientes, etc.) pueden unirse a ella y qué reacciones químicas es
capaz de realizar o catalizar; el conocimiento de la estructura tridimensional de estas
macromoléculas no solo arroja información sobre los procesos biológicos, sino que también tiene
importantes aplicaciones prácticas.
Diseño de medicamentos
Artículo principal: Diseño de fármaco
Las proteínas tienen un papel importante en los trastornos de la salud. Muchas enfermedades
tienen su causa en cambios en la función de una o varias proteínas, causados por mutaciones
genéticas o alteraciones externas al organismo. Las proteínas también tienen un papel crucial en las
infecciones, como componentes del mecanismo de ataque de bacterias, virus y otros parásitos. La
determinación de la estructura de las moléculas es útil para el diseño de fármacos con la forma y
propiedades óptimas para inhibir la función de las proteínas involucradas en procesos patológicos.
Uno de los primeros ejemplos de medicamentos desarrollados por este método es la dorzolamida,
un inhibidor de la anhidrasa carbónica usado para tratar el glaucoma.23
Ingeniería de proteínas
Artículo principal: Ingeniería de proteínas
Los materiales biológicos poseen propiedades estructurales y catalizadoras que a menudo superan
con creces las de productos sintetizados artificialmente. La biología ayuda tanto a mejorar las
propiedades de biomateriales naturales mediante la ingeniería genética como al desarrollo de
nuevos materiales con las características estructurales y químicas óptimas para la función a la que
estén destinados. Como ejemplo, se puede citar la mejora de las propiedades farmacológicas de la
insulina, cuya estructura se ha modificado para que sea más sencilla su administración por vía
�intravenosa a dosis adecuadas sin que las moléculas se agreguen entre sí.1 El mismo principio se
está a la producción de biosensores para la localización de sustancias como explosivos o toxinas, y el
diagnóstico médico mediante la detección de metabolitos.
HISTORIA:
El descubrimiento de la difracción de rayos X en 1913 y las posibilidades abiertas por esta técnica en
el campo de la determinación de las estructuras de moléculas abrieron las puertas al desarrollo
posterior de la biología estructural. Linus Pauling fue uno de los primeros investigadores en explorar
el vínculo entre la forma y la función de las biomoléculas.12 Los estudios de las proteínas
hemoglobina y mioglobina y la elucidación de la estructura del ADN durante los 50 fueron
determinantes en el establecimiento de la biología estructural como un área clave de la biología
molecular.13 En 1962, Max Perutz y John Kendrew obtuvieron el Premio Nobel de Química y James
Watson, Francis Crick y Maurice Wilkins, el Premio Nobel de Medicina por sus respectivas
investigaciones en ambos proyectos.14 En 1971 se fundó el Banco de Datos de Proteínas (PDB), con
la intención de compilar todos los datos existentes para poder extraer principios generales sobre la
relación función-estructura.15 A finales del siglo XX, varios factores confluyeron para la expansión de
la biología estructural: el crecimiento de la cristalografía de macromoléculas, los avances en
métodos complementarios (principalmente la microscopía electrónica y RNM), el desarrollo de
ordenadores digitales capaces de procesar grandes cantidades de datos, con el resultado del
creciente impacto de las técnicas computacionales, y las posibilidades abiertas por la secuenciación
rápida y barata de los genomas, coincidiendo con las primeras aplicaciones prácticas en química y
medicina.
CONCLUSION:
La biología estructural es la ciencia joven y revolucionaria de la segunda mitad del siglo XX (Watson y
Crick, 1953) que nos reveló la estructura única de la doble hélice del ADN, explicando el mecanismo
de la duplicación del material genético con una escultura molecular maravillosa. Una década más
tarde, y tras una labor ardua y penosa, Kendrew y Perutz revelaron por primera vez, a escala
atómica, las contorsiones viscerales de las estructuras de las primeras proteínas (hemoglobina y
mioglobina). Enterrada en su complejidad atómica (varios miles de átomos), las estructuras
escondían el secreto de su función como transportadoras de oxígeno.
Estos descubrimientos fueron el origen de la multitud de estructuras tridimensionales de
macromoléculas biológicas que se han determinado hasta el momento.
El Protein Data Bank (PDB, accesible en la dirección de Internet [Link]) contiene en la
actualidad más de 40.000 estructuras, y se siguen descubriendo diariamente en los laboratorios del
mundo al ritmo de 5.000 anuales.
Las estructuras iluminan y explican a nivel atómico multitud de fenómenos bioquímicos, genéticos,
biológicos y médicos, y probablemente servirán para descubrir nuevas aplicaciones terapéuticas.
Esta galería enorme de estructuras representa una extensión —a nivel atómico— de la tradición
anatómica que empezó con Andrea Vesalio en el Renacimiento y continuó a nivel celular con George
Palade en la primera mitad del siglo XX.
El bisturí de la biología estructural atómica de nuestro siglo ha resultado ser los intensos Rayos X
emitidos por los sincrotrones. Los sincrotrones actuales son aceleradores de electrones diseñados
especialmente para producir radiaciones con una longitud de onda (propiedad análoga al color en la
�radiación visible) variable que permite analizar estructuralmente una gran variedad de materiales,
tanto biológicos como inertes.
Éste es precisamente el objetivo del sincrotrón ALBA, que se está construyendo en la actualidad en
Cataluña. El proyecto es construir el anillo donde circularán los electrones en una órbita circular y
completar una serie de estaciones alrededor que aprovecharán de forma única las características de
la radiación emitida (longitud de onda, intensidad, enfoque y otras) para efectuar distintos
experimentos. Los experimentos tendrán como objetivo: examinar la organización de la materia
(cristalina o amorfa); obtener la estructura de materiales cristalinos (proteínas, complejos
macromoleculares); identificar los elementos o especies químicas que están presentes, o producir
imágenes detalladas de las muestras, además de muchas otras posibilidades.
¿Hacia dónde irá la biología estructural en nuestro siglo? ¿Será posible que a esta etapa de madurez
extraordinaria le siga un periodo de oscuridad y anonimato, enterrada bajo todas aquellas ciencias a
las que ha transformado? Los mismos biólogos estructurales se están planteando esta pregunta
crítica, ya que los métodos desarrollados en los últimos 40 años para resolver esa multitud de
estructuras al año están ya bien establecidos y codificados en algoritmos y programas de
computadora que las personas no expertas pueden utilizar, sin consultar con los cristalógrafos.
¿Desaparecerá la biología estructural de nuestro catálogo de ciencias dinámicas para esconderse en
una vejez anónima, o resurgirá de nuevo con el impulso de nuevas técnicas?
En cierta forma, la respuesta a esta pregunta está relacionada con la respuesta a una pregunta
simple que se repite en las clases de ciencias naturales a lo largo de todo el proceso educativo:
¿cuáles son los estados de la materia? La respuesta se suele considerar elemental: sólido, líquido y
gaseoso; todo el mundo sabe eso, ¿no? Esa respuesta tan simple no considera explícitamente a los
seres vivos. Ignora la multitud de organismos que pueblan nuestros mares, pululan en el aire o se
multiplican en el suelo. Desde los virus y bacterias diminutos hasta las hermosas ballenas del
océano, e incluyéndonos a nosotros mismos. Nuestros cuerpos tienen consistencia por la presencia
de elementos sólidos (por ejemplo, los huesos), funcionan gracias a la circulación de líquidos vitales
(la sangre) e intercambian con el exterior gases (aire, anhídrido carbónico) que son críticos para los
procesos biológicos.
El intercambio de materia, energía e información con el medio que les rodea es precisamente lo que
caracteriza a los seres vivos y los separa de la materia inerte. Termodinámicamente, los seres vivos
son sistemas abiertos.
Esta característica es la clave para entender el concepto de vivo frente a no vivo, y representa algo
más tangible que los conceptos de espíritu, alma o elán vital, entre otros, que se han usado a lo largo
del tiempo para explicar esa dicotomía fundamental. La combinación de ser sistemas
termodinámicamente abiertos y estar compuestos de entidades moleculares extremadamente
complejas (proteínas, ácidos nucleicos, lípidos, iones, etcétera) caracteriza plenamente a los seres
vivos y apunta a su riqueza estructural y funcional.
Los biólogos estructurales actuales se han dado cuenta de que para entender el funcionamiento de
los organismos más allá de sus partes integrantes tienen que extender sus estudios estructurales en
dos direcciones aparentemente opuestas. En las revistas especializadas se ha sugerido que los
biólogos estructurales actuales han de abandonar los confines de las técnicas que conocen bien
(cristalografía de macromoléculas, microscopía) y navegar hacia el este y el oeste de este meridiano,
tratando de descubrir otros continentes estructurales.
�Por el este, digamos, han de tratar de establecer técnicas experimentales que les permitan obtener
la estructura de entidades moleculares complejas usando muestras sin cristalizar, usándolos
sincrotrones de la cuarta generación o X-ray Free Electrón Láser (XFEL) con unas intensidades y
coherencia muy superiores a las actuales. Los experimentos iniciales para establecer esta técnica
experimental se están llevando a cabo ahora en el más avanzado de los XFEL (llamado FLASH),
recientemente estrenado en Alemania.
Por el oeste, las nuevas técnicas de reconstrucción de imágenes usando radiación de sincrotrones
(Diffraction Enhanced Imaging, DEI) permiten ver de forma detalladísima los órganos y tejidos de
poco contraste (por ejemplo, los pulmones y cartílagos) en estados normales y patológicos.
A medida que los biólogos estructurales naveguen durante el siglo XXI en estas dos direcciones
aparentemente opuestas, se encontrarán más tarde al otro lado de la esfera y se darán cuenta de
que su conocimiento del funcionamiento y operación de los seres vivos será muy superior al que
tenemos en la actualidad. Podrán estudiar en el espacio y en el tiempo la microestructura (el orden
interno, las regularidades, las interacciones entre las piezas moleculares) y además el movimiento de
las moléculas componentes (iones, proteínas, lípidos, etcétera) que les permitirán entender mejor el
funcionamiento de los seres vivos. Podrán estudiar las piezas y la circulación (los flujos) de los
elementos y compuestos químicos dentro de los organismos. Esto les llevará a una biología de
sistemas mucho más rigurosa.
Fábrica de cristales: en el subsuelo, en los riñones y en el laboratorio.
En el año 2000 un par de mineros que exploraba el subsuelo del estado mexicano de Chihuahua
encontró formaciones cristalinas sorprendentes, tanto por su gran tamaño como por su atractivo
visual. Desde ese momento, la cueva de los cristales en el poblado de Naica se convirtió en uno de
los referentes más asombrosos de la formación natural de cristales.
Los cristales de Naica son formaciones de un tipo particular de yeso llamado selenita, las cuales
crecieron durante miles de años. En Huasca de Ocampo, en el estado de Hidalgo, se pueden apreciar
formaciones similares constituidas por basalto, una materia volcánica muy rica en silicatos que
contienen fierro y magnesio. Los prismas basálticos de Huasca de Ocampo y los cristales de selenita
en Naica son ejemplos de cristales naturales.
Estrictamente, se considera como cristal a la estructura que se forma a partir del arreglo periódico y
ordenado de los componentes moleculares que la constituyen. Así, la selenita o el basalto que
forman a los cristales descritos previamente, están orientados de forma ordenada en un vasto
número de capas, las cuales se apilan una sobre otra hasta formar estos cristales que nos asombran
por su belleza y geometría.
La formación de cristales a partir de una molécula sucede en función de la concentración de la
misma en una solución: cuando grandes cantidades de dicha molécula están presentes en un
volumen muy pequeño de agua, es más probable que interaccione entre sí y se oriente en un arreglo
particular y repetitivo. La presencia de sales en la solución también promueve la formación de
cristales al disminuir la interacción entre el agua y la molécula en cuestión. Este es el mismo
principio que rige, por ejemplo, a la formación de ciertos cálculos renales.
En las personas que padecen de la enfermedad conocida como gota, el exceso de ácido úrico
favorece la formación de pequeños cristales en forma de agujas, los cuales crecen y se depositan en
el riñón o en las articulaciones y causan inflamación y dolores severos a los pacientes. Igualmente,
las personas que consumen leche u otra fuente de calcio en exceso son más propensos a desarrollar
�cálculos renales de oxalato de calcio. Los cristales de oxalato de calcio que se forman en los riñones
se excretan generalmente mediante la orina, pero en algunos casos éstos pueden propiciar la
formación de cálculos o “piedras” renales que ocasionan molestias y obstruyen a las vías urinarias.
Además de las moléculas pequeñas como el ácido úrico o las que forman a la selenita y el basalto, las
proteínas también pueden formar cristales. En los laboratorios dedicados a conocer la estructura de
las proteínas esos cristales son muy valiosos pues ofrecen una gran cantidad de información. Por
ejemplo, si se logra purificar alguna proteína de interés y si además podemos concentrarla lo
suficiente, entonces es probable que se inicie un proceso de nucleación, el cual no es otra cosa que
el primer paso en la formación de un cristal. Una vez que el cristal se forma se “pesca” con una asa
milimétrica fabricada de diversos materiales. Es necesario enfriar el cristal hasta -173° C y montarlo
sobre un instrumento que sirve para medir ángulos de manera precisa mientras se mantiene la
misma temperatura al utilizar un flujo de nitrógeno líquido recientemente vaporizado. Mantener al
cristal extremadamente frío es importante porque el paso siguiente consiste en hacer incidir sobre el
cristal un haz de rayos X, cuya energía es muy alta y podría destruirlo. La cristalografía de rayos X
recibe este nombre porque el cristal se irradia con rayos X desde diferentes ángulos de acuerdo con
el número de ejes de simetría presentes en él. Aunque el haz de rayos X se lanza con una dirección
definida, al interaccionar con los electrones de la proteína cristalizada este haz se dispersa, o
difracta, y se desvía en diferentes direcciones.
La manera en la cual un cristal de proteínas difracta a los rayos X es única, y al ser plasmada en un
detector, obtenemos un patrón de difracción que en última instancia revela la posición de cada
átomo presente en la proteína que se analiza. Por supuesto, el patrón de difracción no nos dice
inmediatamente en qué posición está cada átomo: es necesario utilizar algoritmos matemáticos
(transformadas de Fourier, en este caso) para revelar la densidad electrónica de la proteína de
interés. Es a partir de esa densidad electrónica que se propone un modelo estructural de la proteína.
El uso de los rayos X para revelar la estructura de una proteína no es coincidencia, sino que se
utilizan debido a que su longitud de onda es desde 0.01 a 10 nanómetros (un nanómetro es la
millonésima parte de un milímetro), lo cual nos permite tener la resolución suficiente para observar
con detalle atómico a las proteínas u otras biomoléculas.
Viajando desde los pulmones hasta los músculos
Los primeros investigadores que lograron deducir la estructura de una proteína a partir de la
difracción de rayos X fueron John Kendrew y Max Perutz, quienes por este logro recibieron el premio
Nobel de química en 1962. La proteína que Kendrew y Perutz cristalizaron por primera vez fue la
mioglobina, cuya función consiste en recibir al oxígeno que es transportado desde los pulmones
hasta los músculos por la hemoglobina. La mioglobina y la hemoglobina son proteínas que contienen
átomos de fierro, esenciales para su función, y cuya presencia es responsable del color rojo
característico de los músculos y la sangre, respectivamente. Dos años después, en 1964, Dorothy
Crowfoot Hodgkin se convertiría en la tercera mujer de la historia en recibir un premio Nobel,
también en química, debido a que determinó la estructura de la penicilina y de la vitamina B12. La
penicilina es un antibiótico que desde su popularización en la Segunda Guerra Mundial y hasta hace
pocos años fue el medicamento de mayor demanda para tratar infecciones bacterianas.
El trabajo de Hodgkin con la penicilina reveló que este antibiótico contiene una estructura química
que antes del descubrimiento de Hodgkin no se conocía y que en consecuencia no se podía sintetizar
industrialmente para cubrir la demanda de antibióticos. Años después, y mediante otro gran éxito de
�la cristalografía, se descubrió que la penicilina inhibe la proliferación de ciertas bacterias patógenas
al impedir la síntesis de la pared celular, la cual se destruye parcialmente cuando las bacterias se
reproducen y debe reconstruirse en cada bacteria nueva. Desafortunadamente, la automedicación y
el mal uso de la penicilina para tratar infecciones bacterianas condujo a la proliferación de bacterias
resistentes a este antibiótico, pero la información acerca de cómo actúa la penicilina se ha utilizado
para diseñar nuevos fármacos que funcionan con base en el mismo mecanismo de acción. Además
de la penicilina, Hodgkin resolvió la estructura de otras biomoléculas, entre ellas la vitamina B12,
cuya deficiencia en la dieta humana es responsable de la anemia perniciosa, pero quizás el
descubrimiento más notable de Hodgkin en el área de la cristalografía fue la resolución de la
estructura de la insulina, la hormona que en mamíferos regula el metabolismo de los azúcares y cuya
deficiencia, tanto en la síntesis como en su percepción, es responsable de la diabetes mellitus. Para
dilucidar la estructura de la insulina, Hodgkin y varios de sus colegas trabajaron arduamente durante
casi cuarenta años para refinar la técnica de la cristalografía de rayos X, la cual era aún rudimentaria
en esa época al ser una tecnología en pleno desarrollo.
Existen diversas técnicas para resolver la estructura de las proteínas, sin embargo, la cristalografía de
rayos X ha sido de fundamental importancia para conocer la estructura de diversas proteínas y la
manera en la cual ocurren las interacciones proteína-proteína, proteína-fármaco o incluso entre
proteínas y otras macromoléculas biológicas como el ADN.
Como hemos visto, los cristales, ya sea aquellos que se forman a lo largo de miles de años en el
subsuelo, los que ocasionan enfermedades o los que se forman intencionalmente en los
laboratorios, nos sorprenden por su belleza pero también por toda la información que nos
proporcionan; información que en algunos casos se utiliza para entender más de nosotros mismos y
de la amplia gama de procesos biológicos que ocurren en nuestro interior o en el de otros
organismos.
Danza molecular
Si miráramos cualquier parte de un ser vivo a una escala de Ångströms (una diez mil millonésima de
metro), veríamos una danza de átomos y moléculas, desde los iones cruzando la membrana celular
de una neurona, ahora que estás leyendo esto, hasta la molécula de ADN en uno de nuestros
cromosomas, la cual mide centímetros y guarda las instrucciones necesarias para la vida.
En esta danza las moléculas se asocian unas con otras, realizan funciones esenciales para la vida, y se
vuelven a separar; podríamos decir que la salud refleja una danza molecular con una coreografía
armónica, donde cada danzante realiza su parte, justo dónde y cuándo le toca hacerlo. Como
imaginarás, queremos entender lo que nos permite estar sanos y el fundamento molecular de lo que
nos hace enfermar o envejecer. Si comprendemos la danza de las moléculas, podremos entender
cómo funcionamos y tendríamos la capacidad de arreglar lo que falla.
¿Cómo estudiamos a las moléculas y su danza?
Conocer la estructura es un primer paso para entender a las moléculas. Éstas son tan pequeñas que
no se pueden ver con los microscopios normales, por lo que usamos otras herramientas. La
cristalografía de rayos X (CRX) usa luz de una longitud de onda similar a la distancia entre los átomos
de las moléculas para obtener información sobre cómo están dispuestos en el espacio. Como no hay
lentes que recojan esta luz dispersada y la conviertan en una imagen, se usan matemáticas para
hacerla de lente y reconstruir la imagen.
�Esta es la herramienta más exitosa que tenemos para estudiar la estructura de las moléculas de la
vida. El álbum de fotos de las proteínas, ADN y otras moléculas de interés biológico es una base de
datos abierta, internacional, llamada Protein Data Bank (PDB: [Link]). A partir de estas fotos,
se generan imágenes biológicamente correctas de cómo se ve, por ejemplo, el interior de una célula.
Tener un álbum de fotos representa un primer acercamiento a las moléculas de la vida; es útil y nos
enseña detalles asombrosos, pero le falta un ingrediente de todo sistema vivo: el movimiento. La
fotografía de una fiesta nos dice quién estuvo en ella, pero no nos dice lo que ocurrió en el evento o
la dinámica de la fiesta. Para conocerla necesitamos una herramienta que mida cambios moleculares
con respecto al tiempo.
La resonancia magnética nuclear (RMN) nos permite estudiar el ambiente de los núcleos de los
átomos de las moléculas y nos indica cómo esta molécula cambia cuando se acerca otra molécula o
cuando la molécula baila sola. Al igual que la CRX, la RMN usa a las matemáticas para convertir la
información colectada en la estructura de la molécula (depositada también en el PDB), y además
saber qué partes y con qué frecuencia se mueven; esto último es crucial para entender la función de
las biomoléculas. Los movimientos con los que danzan las proteínas ocurren en tiempos que van
desde los picosegundos (un billonésimo de segundo) hasta los segundos. La RMN permite estudiar
todas estas escalas de tiempo, y por eso es una herramienta fundamental de la Biofísica.
Tanto la CRX como la RMN usan cantidades grandes (miles de billones) de moléculas para
estudiarlas. En el primer caso, hay que formar un cristal, que es un arreglo ordenado en el espacio
de muchas copias de la molécula (imagínate un desfile militar, con los soldados formados en un
patrón constante). En el segundo, se usa una alta concentración de la molécula porque las señales
que se miden son pequeñas, y todas estas señales deben sumarse. Esto implica que ambas
herramientas estudian principalmente la pose más frecuente del baile molecular.
Imagina un bailarín que brinca y da un giro en el aire; el tiempo que pasa en el aire es poco
comparado con el tiempo que está en el piso, por lo que la pose más frecuente no describe todo el
proceso. Para estudiar poses poco frecuentes usamos a las computadoras y lo que sabemos de física
y química.
Partiendo de las coordenadas de los átomos de las moléculas, obtenidas del PDB o modeladas por su
similitud con otra molécula conocida, hacemos simulaciones del movimiento de las moléculas en
distintas condiciones. Las dejamos que hagan lo que quieran, o las invitamos a realizar distintos
movimientos, y les preguntamos si les gustan o no. Simulamos el proceso de unión y separación de
las moléculas, aproximándonos a la coreografía molecular que realmente ocurre. Realizamos estos
cálculos en supercomputadoras, como las del Laboratorio Nacional de Supercómputo del Sureste en
Puebla, y el Laboratorio Nacional de Cómputo de Alto Desempeño en la Ciudad de México. Por
supuesto, toda esta información computacional se contrasta con experimentos realizados en el
laboratorio, en un ciclo de generación de ideas y su comprobación experimental.
La Biología Estructural en el campus Chamilpa de la UAEM y Morelos de la UNAM
En el campus Chamilpa de la UAEM existe una de las sedes del Laboratorio Nacional de Estructura de
Macromoléculas, con equipos especializados para experimentos de RMN. Además, está el
Laboratorio de Dinámica de Proteínas, consorcio formado por los laboratorios de los Dres. Carlos
Amero (RMN), Lina Rivillas (espectroscopía de proteínas), Rodrigo Razo (químico medicinal
computacional) y Nina Pastor (modelado molecular), en el que también contamos con
supercómputo. En el mismo campus está el Instituto de Biotecnología de la UNAM, donde está el Dr.
Enrique Rudiño (CRX). Todos nosotros aplicamos las herramientas descritas para entender cómo son
�y cómo funcionan proteínas importantes para la vida e involucradas en diversos problemas de salud
y de biotecnología.