Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tabla Periódica
Cargado por
Cristina Soy YoDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tabla Periódica
Cargado por
Cristina Soy YoCopyright:
Formatos disponibles
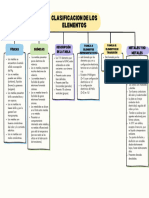
TABLA PERIÓDICA DE LOS ELEMENTOS
EL HIDRÓGENO
no metal
Estructura
electrónica
externa s(1)
Puede formar
iones H+ y H- GRUPO DE LOS
Sus tipos de ANFÍGENOS
Estructura electrónica
compuestos son
externa s(2) p(4)
iónicos (como Oxígeno, azufre y selenio
NaH), covalentes y son no metales.
metálicos (NaH2) Telurio y polonio
semimetales
En general carácter no
metálico del grupo
superior al de los grupos
14 y 15
METALES Muy reactivos (sobre todo
ALCALINOTÉRREOS el oxígeno)
Estructura electrónica
externa s(2)
Más electronegativos que
los alcalinos
Mayor densidad y punto
GRUPOS DE HALÓGENO
de fusión que alcanos
Estructura electrónica
Reactividad menor que GRUPO DE LOS NITROGENOIDES
GRUPO DE LOS CARBONOIDEOS externa s(2) p(5)
alcalinos, que aumenta Estructura electrónica externa s(2) p(3) Mayor carácter no
Estructura electrónica externa s(2) p(2)
con el número atómico. El carácter metálico aumenta claramente con el número metálico del sistema
Transición gradual, elementos no metálicos (Ce, Sí, Ge) y dos
atómico de los elementos. periódico
metales (Sn y Pb)
Muy poco reactivos en condiciones ordinarias Altas energías de
Poco reactivos en condiciones ordinarias ionización
Su reactividad aumenta con la temperatura.
Alta electronegatividad
METALES ALCALINOS
Son agentes oxidantes
Estructura electrónica externa s(1) GRUPO DEL BORO (BOROIDEOS) enérgicos. F2 > Cl2 >
Baja energía de ionización Estructura electrónica externa s(2) p(1) Br2 > I2
Baja electronegatividad GRUPO DE LOS GASES NOBLES
Salvo el boro, semimetálico, los demás Se combinan
Potencial estándar de reducción muy Estructura electrónica externa s(2) p(6) prácticamente con
son metales. Gases monoatómicos
negativo (son buenos agentes reductores) todos los elementos
Reactividad menor que alcalinos, que Reactividad muy estable, prácticamente inertes
Blancos con brillo metálico
Son los más reactivos de la tabla aumenta con el número atómico.
Laura Trueba, Sara Pérez, Celia Pérez
También podría gustarte
- Raid Casa y Jardin JOHNSONDocumento7 páginasRaid Casa y Jardin JOHNSONDionel Lopez HernandezAún no hay calificaciones
- 8vo La Tabla PeriodicaDocumento20 páginas8vo La Tabla PeriodicaHumberto C. Bustos100% (1)
- Máquinas Eléctricas - 03 Propiedades Magnéticas de Los MaterialesDocumento30 páginasMáquinas Eléctricas - 03 Propiedades Magnéticas de Los MaterialesAaron LopezAún no hay calificaciones
- Mapa ConceptualDocumento1 páginaMapa ConceptualFREDIS AGUAS67% (6)
- Tema 3 TeoriaDocumento60 páginasTema 3 TeoriaMiguelAngelFerreteOrtegaAún no hay calificaciones
- 3° Tabla Periódica ModernaDocumento3 páginas3° Tabla Periódica ModernaJaime Fisica RedolfoAún no hay calificaciones
- Tarea 2 - Enlace Químico y Estructura Molecular 2Documento14 páginasTarea 2 - Enlace Químico y Estructura Molecular 2sergio picon100% (1)
- Purple Creative Concept Map ChartDocumento1 páginaPurple Creative Concept Map Chartfatimadiez1205Aún no hay calificaciones
- Quimica TerminadoDocumento8 páginasQuimica Terminadoandriux rodriguezAún no hay calificaciones
- Aporte Tarea4Documento8 páginasAporte Tarea4Juan david0% (1)
- Materiales Metálicos Ia. Aceros.Documento10 páginasMateriales Metálicos Ia. Aceros.Sandy Aracely Laureano ArzapaloAún no hay calificaciones
- REPORTE PRÁCTICA No 6Documento3 páginasREPORTE PRÁCTICA No 6Kaylee FigaroAún no hay calificaciones
- Fase 1 - Trabajo Estructura de La Materia y Nomenclatura.Documento11 páginasFase 1 - Trabajo Estructura de La Materia y Nomenclatura.LeonardoGomezAún no hay calificaciones
- Materiales SemiconductoresDocumento6 páginasMateriales SemiconductoresGustavo FuentesAún no hay calificaciones
- Trabajo Practico Nro 2 TERMINADODocumento5 páginasTrabajo Practico Nro 2 TERMINADOMarito VillalbaAún no hay calificaciones
- La Tabla PeriodicaDocumento13 páginasLa Tabla PeriodicaEdith BlancoAún no hay calificaciones
- Descripción de La Tabla Periódica ActualDocumento1 páginaDescripción de La Tabla Periódica ActualAna HuertasAún no hay calificaciones
- 2.-Diapositivas TABLA PERIODICADocumento18 páginas2.-Diapositivas TABLA PERIODICABrander GómezAún no hay calificaciones
- Fisica 1 PDFDocumento1 páginaFisica 1 PDFMaría CastroAún no hay calificaciones
- La Valencia o Número de Oxidación de Los Elementos Químicos en La Tabla PeriódicaDocumento11 páginasLa Valencia o Número de Oxidación de Los Elementos Químicos en La Tabla PeriódicaSilvherNet JacaltenangoAún no hay calificaciones
- Quimica 2 Mario Andres Calderon LoaizaDocumento41 páginasQuimica 2 Mario Andres Calderon Loaizajuanmontoyaat2Aún no hay calificaciones
- Teórico de Fijación - Configuración Electrónica - Tabla Periódica - 6° Bancario 2023.Documento9 páginasTeórico de Fijación - Configuración Electrónica - Tabla Periódica - 6° Bancario 2023.Estela MirandaAún no hay calificaciones
- Mapa Mental (Materiales Semiconductores)Documento3 páginasMapa Mental (Materiales Semiconductores)Jair MendozaAún no hay calificaciones
- Química General Ing. Industrial S3Documento39 páginasQuímica General Ing. Industrial S3HeliCachayMendozaAún no hay calificaciones
- Santiago Calvo Lopez - MaterialesDocumento2 páginasSantiago Calvo Lopez - Materialesjuan esteban julio romeroAún no hay calificaciones
- Juan Bravo - Tarea S2Documento4 páginasJuan Bravo - Tarea S2Juan Bravo MartinezAún no hay calificaciones
- Quimica 2 Angel Lorena Montoya PardoDocumento41 páginasQuimica 2 Angel Lorena Montoya Pardojuanmontoyaat2Aún no hay calificaciones
- 1.4 Tabla Periódica PDFDocumento12 páginas1.4 Tabla Periódica PDFYaleexa MediinaAún no hay calificaciones
- Mapa Conceptual Interatomicos IntermolecularesDocumento1 páginaMapa Conceptual Interatomicos Intermolecularespedro gonzalezAún no hay calificaciones
- Tarea 2 - G 401582 - 18 - Abner RodriguezDocumento8 páginasTarea 2 - G 401582 - 18 - Abner RodriguezVivian MantillaAún no hay calificaciones
- ARM AR3 ETAPA3 LMyTDocumento7 páginasARM AR3 ETAPA3 LMyTRodríguez Mejorado AmairanyAún no hay calificaciones
- Sulfuro de Bismuto III Magda Raquel LopezDocumento27 páginasSulfuro de Bismuto III Magda Raquel LopezRaquel López67% (6)
- Hoja de Tarea 1 Procesos IndustrialesDocumento18 páginasHoja de Tarea 1 Procesos IndustrialesMaria Laura GonzalezAún no hay calificaciones
- EjerciciosDocumento6 páginasEjerciciosJohana Jacqueline Vazquez VelazquezAún no hay calificaciones
- Taller Resuelto Proceso Fisico QuimicoDocumento4 páginasTaller Resuelto Proceso Fisico QuimicoRONALD QUIROZAún no hay calificaciones
- Sem 01Documento64 páginasSem 01profe2000Aún no hay calificaciones
- Semiconductores - TaggedDocumento64 páginasSemiconductores - TaggedKeoma SarriaAún no hay calificaciones
- Actividades Sobre Tabla PeriodicaDocumento6 páginasActividades Sobre Tabla PeriodicaRuben Osvaldo Gomez OcampoAún no hay calificaciones
- Quimica Trabajo Grupal 2.0Documento5 páginasQuimica Trabajo Grupal 2.0Valeria GomezAún no hay calificaciones
- Materiales Metalicos - ItmDocumento164 páginasMateriales Metalicos - ItmLibiaBaena100% (1)
- Sem 01Documento64 páginasSem 01Nellis BlancoAún no hay calificaciones
- Tema 4Documento71 páginasTema 4abdeltalayuelaAún no hay calificaciones
- QUIMICADocumento13 páginasQUIMICAAntonio HernandezAún no hay calificaciones
- Guía de Trabajo EnlaceDocumento6 páginasGuía de Trabajo Enlacejuan davidAún no hay calificaciones
- Metales y No MetalesDocumento33 páginasMetales y No MetalespamelaAún no hay calificaciones
- Etapa 1 Nomenclatura de CompuestosDocumento3 páginasEtapa 1 Nomenclatura de Compuestosrichard pabon soteloAún no hay calificaciones
- Tema 3a Tabla PeriodicaDocumento12 páginasTema 3a Tabla PeriodicaDaniel SerkinAún no hay calificaciones
- Pilco Alexis Software A Deber1Documento5 páginasPilco Alexis Software A Deber1Netflix Akr3Aún no hay calificaciones
- Tabla Periódica APRENDERDocumento1 páginaTabla Periódica APRENDERSofí EscobarAún no hay calificaciones
- Wuolah Free Sistema PeriodicoDocumento6 páginasWuolah Free Sistema PeriodicoNoa DíazAún no hay calificaciones
- Sem 01Documento64 páginasSem 01NilsAún no hay calificaciones
- Cartel RUIM YulissaDocumento1 páginaCartel RUIM YulissaYulissa GarcíaAún no hay calificaciones
- Repaso para EvaluaciónDocumento2 páginasRepaso para EvaluaciónNicole GualtieriAún no hay calificaciones
- Que Es La Tabla PeriodicaDocumento2 páginasQue Es La Tabla Periodicahygt loploAún no hay calificaciones
- Lecc 1 ADocumento31 páginasLecc 1 AFABIANAún no hay calificaciones
- Electrónica Física PDFDocumento31 páginasElectrónica Física PDFHERNANDEZ1010Aún no hay calificaciones
- Actividad 1.1 QuimicaDocumento2 páginasActividad 1.1 QuimicaLuis GerardoAún no hay calificaciones
- Sem 01Documento64 páginasSem 01profe2000Aún no hay calificaciones
- Estructura Atómica y Tabla Periódica 3Documento3 páginasEstructura Atómica y Tabla Periódica 3Leonel NoyaAún no hay calificaciones
- Sem 02Documento64 páginasSem 02profe2000Aún no hay calificaciones
- Mapa Gases Ideales y Sustancia PuraDocumento1 páginaMapa Gases Ideales y Sustancia PuraArmando Gatiérrez GarciaAún no hay calificaciones
- Geometria MolecularDocumento50 páginasGeometria MoleculargeilermtAún no hay calificaciones
- Tríptico - Baño MariaDocumento2 páginasTríptico - Baño MariaJefferson Caballero airampoAún no hay calificaciones
- Informe Esterificación PDFDocumento15 páginasInforme Esterificación PDFAngie SánchezAún no hay calificaciones
- Actividad 13 Quimica 2° TrimDocumento4 páginasActividad 13 Quimica 2° Trim车GilAún no hay calificaciones
- Material 1. Forma y Polaridad de Las MoléculasDocumento29 páginasMaterial 1. Forma y Polaridad de Las Moléculasandrea nettle bareaAún no hay calificaciones
- 2 1Documento3 páginas2 1WALTER SUEL ARROYOAún no hay calificaciones
- Practica n2 Efecto de PH y T en EnzimasDocumento10 páginasPractica n2 Efecto de PH y T en EnzimasAlberth Fernando Colonia RamirezAún no hay calificaciones
- Intercambio IonicoDocumento20 páginasIntercambio IonicoHolaAún no hay calificaciones
- Gases para Tercero de SecundariaDocumento6 páginasGases para Tercero de SecundariaEdwin EspinoAún no hay calificaciones
- Bitacora Laboratorio 1 y 2Documento11 páginasBitacora Laboratorio 1 y 2DUVAN HOYOS CHADIDAún no hay calificaciones
- Clase 8 Placas Planas SumergidasDocumento19 páginasClase 8 Placas Planas SumergidasJuanJimenezAún no hay calificaciones
- Instituto Tecnológico de La ChontalpaDocumento141 páginasInstituto Tecnológico de La Chontalpagustavo animasAún no hay calificaciones
- Tivela SDocumento2 páginasTivela SerenAún no hay calificaciones
- Nautilus Premium Outboard OilDocumento20 páginasNautilus Premium Outboard OilMario LogachoAún no hay calificaciones
- Encendido y Apagado de Un HPLCDocumento11 páginasEncendido y Apagado de Un HPLCMontse LeónAún no hay calificaciones
- Lab No1 - Ley de Coulomb - 2021Documento5 páginasLab No1 - Ley de Coulomb - 2021RobertoAún no hay calificaciones
- Guia Taller 2 Ciclos BiogeoquimicosDocumento4 páginasGuia Taller 2 Ciclos BiogeoquimicosAlex GonzalezAún no hay calificaciones
- Tema La ExposicionDocumento9 páginasTema La ExposicionCristina Ismelda Perez SosaAún no hay calificaciones
- Python para AstronomiaDocumento22 páginasPython para AstronomiacidzetamizartAún no hay calificaciones
- Determinacion de Acido Acetico en VinagreDocumento9 páginasDeterminacion de Acido Acetico en VinagreFernanda Martinez60% (5)
- 03 Leyes de Hidraulica y NeumaticaDocumento23 páginas03 Leyes de Hidraulica y NeumaticaFernando Fernandez QuispeAún no hay calificaciones
- 3 Servicio Contra IncendioDocumento9 páginas3 Servicio Contra IncendioFlorencia PiriniAún no hay calificaciones
- Ejercicio 4.1Documento3 páginasEjercicio 4.1Karen G RamosAún no hay calificaciones
- Cable WS IndecoDocumento4 páginasCable WS IndecoManuAún no hay calificaciones
- Taller - Difracción de Rayos X - Dias - Carla - P1Documento12 páginasTaller - Difracción de Rayos X - Dias - Carla - P1Hafidt De La CalleAún no hay calificaciones
- Pérez BCE-SDDocumento103 páginasPérez BCE-SDBriyith Quispe MoriAún no hay calificaciones
- UNIVERSIDAD NACIONAL DEL CALLAO Informe Quimica IIDocumento11 páginasUNIVERSIDAD NACIONAL DEL CALLAO Informe Quimica IIQuirod JavierAún no hay calificaciones
- Solidificación de Hierro Nodular PDFDocumento87 páginasSolidificación de Hierro Nodular PDFFernando Rodriguez PachecoAún no hay calificaciones