Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Postulados de Bohr
Cargado por
Ximena Wendolyne Castañeda HernándezDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Postulados de Bohr
Cargado por
Ximena Wendolyne Castañeda HernándezCopyright:
Formatos disponibles
Postulados de Bohr
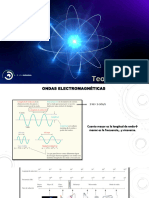
El modelo de Rutherford considera al electrón girando alrededor del núcleo. En estas condiciones el electrón
ha de tener aceleración (centrípeta) y, de acuerdo con la teoría electromagnética, toda carga acelerada
emite radiación. Por tanto, el electrón debería estar emitiendo energía ininterrumpidamente. Esto le haría
perder velocidad, de tal forma que el electrón no podría mantener la órbita y, tal como simula la animación
adjunta, caería finalmente sobre el núcleo. Es decir, el modelo atómico de Rutherford es un modelo
"autodestructivo", que contradice la indudable estabilidad de los átomos. Esta dificultad se combina con el
hecho, evidenciado por los resultados experimentales de los espectros atómicos, de que los átomos emiten y
absorben energía de forma discreta, es decir, sólo para determinadas cantidades que corresponden a niveles
de energía que puede tener el electrón.
I. El electrón gira alrededor del núcleo del átomo en una órbita circular. Las órbitas electrónicas son estacionarias y el
electrón cuando se mueve en ellas, no radia energía.
II. El impulso angular del electrón, L [L= r x p = r x (m· v); para una órbita circular, es L = rmv ] está cuantizado, lo que
significa que de las infinitas órbitas que podría tener, sólo son posibles las que cumplen que el impulso angular es un
múltiplo entero de h/2p (h es la constante de Plank)
III. Cuando un electrón "salta" desde una órbita superior, de energía E2, a otra inferior, de energía E1, la energía liberada se
emite en forma de radiación. La frecuencia (n) de la radiación viene dada por la expresión: E2 - E1 = h.n (h es la constante
de Plank)
También podría gustarte
- 3-Teoría Cuántica-VfinalDocumento48 páginas3-Teoría Cuántica-VfinaljuanixgenoAún no hay calificaciones
- Modelo Atomico de BohrDocumento15 páginasModelo Atomico de BohrAlexander MoranAún no hay calificaciones
- Modelo Nuclear Del ÁtomoDocumento23 páginasModelo Nuclear Del ÁtomoRosarioAún no hay calificaciones
- Modelo Atomico de BohrDocumento14 páginasModelo Atomico de BohrJackson RamirezAún no hay calificaciones
- Teoría Atómica de Bohr y Teoría Atómica de SommerfeldDocumento6 páginasTeoría Atómica de Bohr y Teoría Atómica de SommerfeldIEduardo Gomez SilvaAún no hay calificaciones
- Introduccion BohrDocumento11 páginasIntroduccion BohrJhonatan AlfaroAún no hay calificaciones
- BohrDocumento4 páginasBohrArmando DiazAún no hay calificaciones
- Orbitas Estacionarias Según Modelo Atómico de BohrDocumento2 páginasOrbitas Estacionarias Según Modelo Atómico de BohrJoaquin Antonio Garcia Suarez100% (3)
- 1) Estructura AtómicaDocumento51 páginas1) Estructura AtómicaLucia AlmansaAún no hay calificaciones
- 02 Modelo Bohr2Documento15 páginas02 Modelo Bohr2DanteJaraEspinozaAún no hay calificaciones
- Postulados de BohrDocumento5 páginasPostulados de BohrinspagintAún no hay calificaciones
- Modelo AtómicoDocumento3 páginasModelo AtómicoLuis González MezaAún no hay calificaciones
- Modelo Atomico de BohrDocumento8 páginasModelo Atomico de BohrStefanoRodrigoAún no hay calificaciones
- Modelo Atomico de BohrDocumento8 páginasModelo Atomico de BohrStefanoRodrigoAún no hay calificaciones
- Niels Bohr Sabía Que Las Principales Objeciones Al Modelo Atómico de Rutherford Eran QueDocumento2 páginasNiels Bohr Sabía Que Las Principales Objeciones Al Modelo Atómico de Rutherford Eran QueEdgar Campusano SanchezAún no hay calificaciones
- M Cuantica LibroDocumento162 páginasM Cuantica LibroMiguel PastranaAún no hay calificaciones
- Aportes de Niels Bohr FernandoDocumento5 páginasAportes de Niels Bohr FernandoElkin CastroAún no hay calificaciones
- Tema 2Documento23 páginasTema 2EustaquioAún no hay calificaciones
- Modelos AtómicosDocumento8 páginasModelos AtómicosLeilaAún no hay calificaciones
- Atomos 2Documento16 páginasAtomos 2Fiorella A. Isabella V.Aún no hay calificaciones
- CartografíaDocumento15 páginasCartografíakarinaAún no hay calificaciones
- 1 El Atomo de HidrogenoDocumento18 páginas1 El Atomo de HidrogenoKriz RealesAún no hay calificaciones
- El Átomo MecanoDocumento3 páginasEl Átomo Mecanovalente llenque sanchezAún no hay calificaciones
- SAPIENCIA QUIMICA - Modelos AtómicosDocumento4 páginasSAPIENCIA QUIMICA - Modelos AtómicosbianAún no hay calificaciones
- Espectros y Modelos AtomicosDocumento42 páginasEspectros y Modelos AtomicoscristianAún no hay calificaciones
- Teoría de DALTON.: Rayos CatódicosDocumento8 páginasTeoría de DALTON.: Rayos Catódicosvictor MarceloAún no hay calificaciones
- Teoría Atómica de BohrDocumento4 páginasTeoría Atómica de BohrMiguel Angel ValeAún no hay calificaciones
- Espectroscopía y Modelos AtómicosDocumento47 páginasEspectroscopía y Modelos AtómicosSebastian AgudeloAún no hay calificaciones
- Apuntes de Estructura Atómica. Segunda ParteDocumento6 páginasApuntes de Estructura Atómica. Segunda ParteBrandon PaichoAún no hay calificaciones
- Ochoas 5 (1) .09Documento17 páginasOchoas 5 (1) .09zumbaclauAún no hay calificaciones
- Química General T7-14Documento49 páginasQuímica General T7-14Ilian GilAún no hay calificaciones
- M A Bohr y RutherfDocumento6 páginasM A Bohr y RutherfHector CharreAún no hay calificaciones
- La Cuantización de La Energía-Naturaleza Dual de La MateriaDocumento4 páginasLa Cuantización de La Energía-Naturaleza Dual de La MateriaEduardo VázquezAún no hay calificaciones
- Apunte QuimicaDocumento62 páginasApunte QuimicacokemaxmaxAún no hay calificaciones
- Estructura AtómicaDocumento47 páginasEstructura AtómicaMARIEL BENITEZ DELGADOAún no hay calificaciones
- tp2 MaterialesDocumento14 páginastp2 MaterialesFáti BarrionuevoAún no hay calificaciones
- Q - 5to UNI - Modelos Atómicos (SIN AUDIO)Documento31 páginasQ - 5to UNI - Modelos Atómicos (SIN AUDIO)Juan MaytaAún no hay calificaciones
- El Modelo Atomico de BohrDocumento3 páginasEl Modelo Atomico de BohrFrida LlerenaAún no hay calificaciones
- PREPARATORIO - Espectro de LineasDocumento6 páginasPREPARATORIO - Espectro de LineasEduardo OlallaAún no hay calificaciones
- Modelo de DaltonDocumento5 páginasModelo de Daltonkatiagelvis86% (7)
- Version Final Del Reporte Del Experimento de Frank HertzDocumento12 páginasVersion Final Del Reporte Del Experimento de Frank HertzLaura DanielaAún no hay calificaciones
- Teoría Atómica de BohrDocumento5 páginasTeoría Atómica de BohrCarlos Alamilla RamosAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosJose Ignacio Campos RojasAún no hay calificaciones
- Tema 4. Quimica I - 2018Documento28 páginasTema 4. Quimica I - 2018Alex TorresAún no hay calificaciones
- Apuntes Química Tema 1Documento9 páginasApuntes Química Tema 1MartaAún no hay calificaciones
- Conceptos para Selectividad Química 2ºbachDocumento9 páginasConceptos para Selectividad Química 2ºbachvialmapa5Aún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos AtomicosLissette Espinoza MoralesAún no hay calificaciones
- Tema 2 Modelo Nuclear Del AtomoDocumento16 páginasTema 2 Modelo Nuclear Del Atomokimi VolkovaAún no hay calificaciones
- Modelos AtómicosDocumento9 páginasModelos AtómicosJosé María Jiménez MairelesAún no hay calificaciones
- Temario Química SelectividadDocumento21 páginasTemario Química SelectividadLaura SerraAún no hay calificaciones
- Modelos AtomicosDocumento6 páginasModelos AtomicosYony Mauro Burga ZabaletaAún no hay calificaciones
- Bor HHH HHHHDocumento9 páginasBor HHH HHHHYelssin Tu Angelito Gonzales LuisAún no hay calificaciones
- Sesión #12: Universidad Nacional "San Luis GonzagaDocumento16 páginasSesión #12: Universidad Nacional "San Luis GonzagaHarold Mejia toquioAún no hay calificaciones
- Historia de La Teoria Atomica ModernaDocumento8 páginasHistoria de La Teoria Atomica ModernaEdgar William LajAún no hay calificaciones
- Consultar Qué Es Un Electroscopio y Cuál Es El Principio Físico deDocumento2 páginasConsultar Qué Es Un Electroscopio y Cuál Es El Principio Físico deDaniela Garzon CuadrosAún no hay calificaciones
- Modelos Del Átomo ContinuaciónDocumento34 páginasModelos Del Átomo Continuaciónmartina salasAún no hay calificaciones
- Postulados de BorhDocumento2 páginasPostulados de BorhAnonymous lpNLF6oAún no hay calificaciones
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- Aislantes y ConductoresDocumento1 páginaAislantes y ConductoresXimena Wendolyne Castañeda HernándezAún no hay calificaciones
- Reacciones QuímicasDocumento2 páginasReacciones QuímicasXimena Wendolyne Castañeda HernándezAún no hay calificaciones
- El ColorDocumento1 páginaEl ColorXimena Wendolyne Castañeda HernándezAún no hay calificaciones
- Elementos de Una OndaDocumento1 páginaElementos de Una OndaXimena Wendolyne Castañeda HernándezAún no hay calificaciones
- Sistema Nervioso CentralDocumento16 páginasSistema Nervioso CentralXimena Wendolyne Castañeda HernándezAún no hay calificaciones
- Sistema EndocrinoDocumento38 páginasSistema EndocrinoXimena Wendolyne Castañeda HernándezAún no hay calificaciones