Documentos de Académico
Documentos de Profesional
Documentos de Cultura
El Modelo Atomico de Bohr
Cargado por
Frida Llerena0 calificaciones0% encontró este documento útil (0 votos)
27 vistas3 páginasLa estructura electrónica de un átomo describe la disposición y energía de los electrones alrededor del núcleo. Niels Bohr propuso un modelo atómico basado en tres postulados: 1) los electrones giran en órbitas estacionarias sin emitir energía, 2) los electrones solo pueden girar en órbitas donde su momento angular es un múltiplo entero de h/2π, y 3) cuando un electrón cambia de órbita, la diferencia de energía se emite o absorbe como radiación electromagnética
Descripción original:
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoLa estructura electrónica de un átomo describe la disposición y energía de los electrones alrededor del núcleo. Niels Bohr propuso un modelo atómico basado en tres postulados: 1) los electrones giran en órbitas estacionarias sin emitir energía, 2) los electrones solo pueden girar en órbitas donde su momento angular es un múltiplo entero de h/2π, y 3) cuando un electrón cambia de órbita, la diferencia de energía se emite o absorbe como radiación electromagnética
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
27 vistas3 páginasEl Modelo Atomico de Bohr
Cargado por
Frida LlerenaLa estructura electrónica de un átomo describe la disposición y energía de los electrones alrededor del núcleo. Niels Bohr propuso un modelo atómico basado en tres postulados: 1) los electrones giran en órbitas estacionarias sin emitir energía, 2) los electrones solo pueden girar en órbitas donde su momento angular es un múltiplo entero de h/2π, y 3) cuando un electrón cambia de órbita, la diferencia de energía se emite o absorbe como radiación electromagnética
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
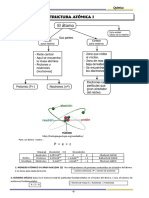
La estructura electrnica de un tomo describe las energas y la
disposicin de los electrones alrededor del tomo. Gran parte de lo que
se conoce acerca de la estructura electrnica de los tomos se averigu
observando la interaccin de la radiacin electromagntica con la
materia.
Sabemos que el espectro de un elemento qumico es caracterstico de
ste y que del anlisis espectroscpico de una muestra puede
deducirse su composicin.
El origen de los espectros era desconocido hasta que la teora atmica
asoci la emisin de radiacin por parte de los tomos con el
comportamiento de los electrones, en concreto con la distancia a la que
stos se encuentran del ncleo.
El fsico dans Niels Bohr ( Premio Nobel de Fsica 1922), propuso
un nuevo modelo atmico que se basa en tres postulados:
Primer Postulado:
Los electrones giran alrededor del ncleo en rbitas estacionarias sin
emitir energa
Segundo Postulado:
Los electrones solo pueden girar alrededor del ncleo en aquellas
rbitas para las cuales el momento angular del electrn es un mltiplo
entero de h/2p.
siendo "h" la constante de Planck, m la masa del electrn, v su
velocidad, r el radio de la rbita y n un nmero entero (n=1, 2, 3, ...)
llamado nmero cuntico principal, que vale 1 para la primera rbita, 2
para la segunda, etc.
Tercer postulado:
Cuando un electrn pasa de una rbita externa a una ms interna, la
diferencia de energa entre ambas rbitas se emite en forma de
radiacin electromagntica.
Mientras el electrn se mueve en cualquiera de esas rbitas no radia
energa, slo lo hace cuando cambia de rbita. Si pasa de una rbita
externa (de mayor energa) a otra ms interna (de menor energa) emite
energa, y la absorbe cuando pasa de una rbita interna a otra ms
externa. Por tanto, la energa absorbida o emitida ser:
En resumen podemos decir que los electrones se disponen en diversas
rbitas circulares que determinan diferentes niveles de energa
También podría gustarte
- Niels Bohr Sabía Que Las Principales Objeciones Al Modelo Atómico de Rutherford Eran QueDocumento2 páginasNiels Bohr Sabía Que Las Principales Objeciones Al Modelo Atómico de Rutherford Eran QueEdgar Campusano SanchezAún no hay calificaciones
- Modelo Atómico de BohrDocumento3 páginasModelo Atómico de Bohrdccg1112Aún no hay calificaciones
- Modelo Atómico de BohrDocumento3 páginasModelo Atómico de BohrManuel PatAún no hay calificaciones
- Modelo Nuclear Del Atomo.Documento44 páginasModelo Nuclear Del Atomo.Joselyn OrtegaAún no hay calificaciones
- Modelo Atomico de BohrDocumento15 páginasModelo Atomico de BohrAlexander MoranAún no hay calificaciones
- Modelo Atomico de BohrDocumento14 páginasModelo Atomico de BohrJackson RamirezAún no hay calificaciones
- Base Experimental de La Teoria Cuantica.Documento11 páginasBase Experimental de La Teoria Cuantica.Karen Alavez100% (1)
- Modelo Mecano CuanticoDocumento46 páginasModelo Mecano CuanticoVíctor Cárcamo Echeverría100% (2)
- Modelo Atómico ActualDocumento4 páginasModelo Atómico ActualLeo SAún no hay calificaciones
- Balotario QuimicaDocumento142 páginasBalotario QuimicaSteven SosaAún no hay calificaciones
- Teoría de BohrDocumento3 páginasTeoría de BohrJuan Diego Guzmán GuerreroAún no hay calificaciones
- Modelo Atómico de BohrDocumento8 páginasModelo Atómico de BohrwillAún no hay calificaciones
- Teoría Cuántica y La Estructura Electrónica de Los ÁtomosDocumento14 páginasTeoría Cuántica y La Estructura Electrónica de Los ÁtomosNayrobi AcostaAún no hay calificaciones
- Modelos AtómicosDocumento8 páginasModelos AtómicosLeilaAún no hay calificaciones
- Apunte QuimicaDocumento62 páginasApunte QuimicacokemaxmaxAún no hay calificaciones
- Sesión #12: Universidad Nacional "San Luis GonzagaDocumento16 páginasSesión #12: Universidad Nacional "San Luis GonzagaHarold Mejia toquioAún no hay calificaciones
- Ochoas 5 (1) .09Documento17 páginasOchoas 5 (1) .09zumbaclauAún no hay calificaciones
- Absorción y Emisión de Radiación ElectromagnéticaDocumento17 páginasAbsorción y Emisión de Radiación ElectromagnéticaGrecia De La CruzAún no hay calificaciones
- Estructura AtomicaDocumento13 páginasEstructura AtomicaAlexander Chavez EspinozaAún no hay calificaciones
- Tema 4. Quimica I - 2018Documento28 páginasTema 4. Quimica I - 2018Alex TorresAún no hay calificaciones
- Modelo Atómico de BohrDocumento3 páginasModelo Atómico de BohrHanamichi Ordnajela López AlcaláAún no hay calificaciones
- Química General T7-14Documento49 páginasQuímica General T7-14Ilian GilAún no hay calificaciones
- Modelos AtomicosDocumento4 páginasModelos AtomicosLissette Espinoza MoralesAún no hay calificaciones
- 3-Teoría Cuántica-VfinalDocumento48 páginas3-Teoría Cuántica-VfinaljuanixgenoAún no hay calificaciones
- Base Experimental de La Teoría CuanticaDocumento5 páginasBase Experimental de La Teoría CuanticaBrenda Liz Ramos100% (1)
- Modelo Atomico de BorhDocumento14 páginasModelo Atomico de BorhArtijopa JatpAún no hay calificaciones
- M A Bohr y RutherfDocumento6 páginasM A Bohr y RutherfHector CharreAún no hay calificaciones
- CartografíaDocumento15 páginasCartografíakarinaAún no hay calificaciones
- Base Experimental de La Teoría CuanticaDocumento6 páginasBase Experimental de La Teoría CuanticaKarina OsorioAún no hay calificaciones
- Estructura Atómica TeoriaDocumento44 páginasEstructura Atómica TeoriaFran BrennanAún no hay calificaciones
- Estructura AtómicaDocumento7 páginasEstructura AtómicaEdgarAgrazAún no hay calificaciones
- Modelo Atomico de BohrDocumento10 páginasModelo Atomico de BohrMelani PeraltaAún no hay calificaciones
- Formulario Fisica ModernaDocumento6 páginasFormulario Fisica ModernaDiego CandoAún no hay calificaciones
- Teoría Atómica de BohrDocumento5 páginasTeoría Atómica de BohrCarlos Alamilla RamosAún no hay calificaciones
- Tema 1 Estructura AtómicaDocumento2 páginasTema 1 Estructura AtómicaanaiscaceresAún no hay calificaciones
- Tema 1.el Atomo Mecano-CuánticoDocumento9 páginasTema 1.el Atomo Mecano-CuánticojavierAún no hay calificaciones
- Modelo Atomico de BohrDocumento33 páginasModelo Atomico de BohrLorena Herrera Hernandez0% (1)
- Examen 2 de QuimicaDocumento7 páginasExamen 2 de QuimicaRicardo SantiagoAún no hay calificaciones
- Modelos AtómicosDocumento4 páginasModelos AtómicosJose Ignacio Campos RojasAún no hay calificaciones
- Modelo Atomico de BhorDocumento13 páginasModelo Atomico de BhorRodolfo Cervantes Amieva ReyesAún no hay calificaciones
- Modelo Atómico de BohrDocumento10 páginasModelo Atómico de BohrEmmanuel Tandaypán Farfán0% (1)
- Modelo Atomico ActualDocumento6 páginasModelo Atomico ActualDiegoAún no hay calificaciones
- Atomo CuanticoDocumento9 páginasAtomo CuanticoVilchis Granados Axel MaximilianoAún no hay calificaciones
- Tema 2Documento23 páginasTema 2EustaquioAún no hay calificaciones
- Cap. 6. Estructura Electrónica ÁtomosDocumento54 páginasCap. 6. Estructura Electrónica ÁtomosMarcia JaraAún no hay calificaciones
- 2.1 Modelos AtómicosDocumento42 páginas2.1 Modelos AtómicosVal MorasAún no hay calificaciones
- Espectros y Modelos AtomicosDocumento42 páginasEspectros y Modelos AtomicoscristianAún no hay calificaciones
- Tema 1 Estructura Atomica y TemarioDocumento16 páginasTema 1 Estructura Atomica y TemarioPablo CarvalloAún no hay calificaciones
- 18 de Septiembre 2019Documento15 páginas18 de Septiembre 2019Anonymous FEkJ6UAún no hay calificaciones
- Modelo Atómico de La Mecánica Cuántica OndulatoriaDocumento13 páginasModelo Atómico de La Mecánica Cuántica OndulatoriaPaúl MartínezAún no hay calificaciones
- Orbitas Estacionarias Según Modelo Atómico de BohrDocumento2 páginasOrbitas Estacionarias Según Modelo Atómico de BohrJoaquin Antonio Garcia Suarez100% (3)
- Modelo Atomico de BohrDocumento8 páginasModelo Atomico de BohrStefanoRodrigoAún no hay calificaciones
- Modelo Atomico de BohrDocumento8 páginasModelo Atomico de BohrStefanoRodrigoAún no hay calificaciones
- Modelos AtomicosDocumento3 páginasModelos Atomicosjulio fragoso0% (1)
- Modelos AtomicosDocumento28 páginasModelos AtomicosNATALY ALMANZA AVILAAún no hay calificaciones
- Mecánica Cuántica. Equipo.1.3Documento1 páginaMecánica Cuántica. Equipo.1.3Hugo Alejandro Garcia UriosteguiAún no hay calificaciones
- Evolución de La Teoria CuanticaDocumento4 páginasEvolución de La Teoria CuanticaLuisa GermanAún no hay calificaciones
- Estructura AtómicaDocumento47 páginasEstructura AtómicaMARIEL BENITEZ DELGADOAún no hay calificaciones
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Telecomunicaciones: Historia y conceptos básicosDe EverandTelecomunicaciones: Historia y conceptos básicosCalificación: 5 de 5 estrellas5/5 (1)
- Acondicionamiento AmbientalDocumento1 páginaAcondicionamiento AmbientalFrida LlerenaAún no hay calificaciones
- SÍLABO TasacionesDocumento2 páginasSÍLABO TasacionesFrida LlerenaAún no hay calificaciones
- 1° Ficha de Plan LectorDocumento1 página1° Ficha de Plan LectorFrida LlerenaAún no hay calificaciones
- Anexo 3 - Ficha Tecnica SSHH Pronied 2016Documento4 páginasAnexo 3 - Ficha Tecnica SSHH Pronied 2016Frida LlerenaAún no hay calificaciones
- Informe #005 Valorizacion 03 (1º Quincena Diciembre)Documento6 páginasInforme #005 Valorizacion 03 (1º Quincena Diciembre)Frida LlerenaAún no hay calificaciones
- Analisis Presupuesto UnitariosDocumento23 páginasAnalisis Presupuesto UnitariosFrida Llerena100% (1)
- Edt ProyectoDocumento1 páginaEdt ProyectoFrida LlerenaAún no hay calificaciones
- ÍndiceDocumento6 páginasÍndiceAlfredo MirandaAún no hay calificaciones
- Ejercicio1 6Documento2 páginasEjercicio1 6Wilson NaulaAún no hay calificaciones
- Resumen de Los Antecedentes de La Mecánica CuánticaDocumento10 páginasResumen de Los Antecedentes de La Mecánica CuánticaAnonymous DCOee86JnAún no hay calificaciones
- Tarea 1.1. Trabajo en ClaseDocumento3 páginasTarea 1.1. Trabajo en ClaseJosé DíazAún no hay calificaciones
- Decoherencia Cuántica ActualizadaDocumento51 páginasDecoherencia Cuántica ActualizadaRonaldito MartinezAún no hay calificaciones
- Experimento Sobre Electricidad EstáticaDocumento7 páginasExperimento Sobre Electricidad EstáticaDanny MartiinezAún no hay calificaciones
- Tarea N°2 Dinamica (Huaroto)Documento7 páginasTarea N°2 Dinamica (Huaroto)Anonymous fyF9NSVAún no hay calificaciones
- 3 Pruebas de Cada TemaDocumento19 páginas3 Pruebas de Cada TemaDavito MartínezAún no hay calificaciones
- Problemas QuímicaDocumento1 páginaProblemas QuímicaJulianaFernanadezGarciaAún no hay calificaciones
- Prueba de Diagnóstico Química Segundo Medio-1Documento14 páginasPrueba de Diagnóstico Química Segundo Medio-1Grace Bustos Medina100% (1)
- Manual 1Documento3 páginasManual 1Alejandro Esteban RamirezAún no hay calificaciones
- Línea Del Tiempo Del ÁtomoDocumento4 páginasLínea Del Tiempo Del ÁtomoLuis Jorge Lozano Domínguez93% (27)
- Cuadro Comparativo TeoriasDocumento1 páginaCuadro Comparativo Teoriasrosy garcia perezAún no hay calificaciones
- 6 Modelos Atomicos IlustradosDocumento6 páginas6 Modelos Atomicos IlustradosGiovanni CruzAún no hay calificaciones
- Guia Basica de Quimica 4Documento3 páginasGuia Basica de Quimica 4ovidio martinez100% (1)
- Teoria de Orbitales AtomicosDocumento7 páginasTeoria de Orbitales AtomicosDark HikaruAún no hay calificaciones
- Expo QuimicaDocumento13 páginasExpo QuimicaRamirez PcivilAún no hay calificaciones
- Triptico Unefco FISICADocumento2 páginasTriptico Unefco FISICAChaquilla Mamani Zenon RudyAún no hay calificaciones
- Configuracion Electronica ProblemasDocumento5 páginasConfiguracion Electronica ProblemasLuis Alfredo CedeñoAún no hay calificaciones
- Postulados de La Mecánica CuánticaDocumento7 páginasPostulados de La Mecánica Cuánticajjjaviii2001Aún no hay calificaciones
- Nuclido Parte 2Documento4 páginasNuclido Parte 2Thania Estefany Bedia AlarcónAún no hay calificaciones
- Construye Un AtomoDocumento3 páginasConstruye Un AtomoMarinaAún no hay calificaciones
- Práctica Del ÁtomoDocumento2 páginasPráctica Del ÁtomoYabel RivasAún no hay calificaciones
- Tema 4 El Átomo. 3º LDocumento3 páginasTema 4 El Átomo. 3º LtunorapAún no hay calificaciones
- Estructura Atomica para Segundo de SecundariaDocumento5 páginasEstructura Atomica para Segundo de SecundariaedisomAún no hay calificaciones
- Solucionario Primer Parcial Quimica General - DDocumento6 páginasSolucionario Primer Parcial Quimica General - DBryan DazaAún no hay calificaciones
- Cuántica MedicinalDocumento2 páginasCuántica MedicinalNicolas MoralesAún no hay calificaciones
- TP 2 Estructura AtomicaDocumento4 páginasTP 2 Estructura AtomicazoeAún no hay calificaciones
- Teoria de Las Cuerdas de EinsteinDocumento1 páginaTeoria de Las Cuerdas de EinsteinAngel L. MoralesAún no hay calificaciones
- Método Extendido de HückelDocumento6 páginasMétodo Extendido de HückelCamila Cabarcas HerreraAún no hay calificaciones