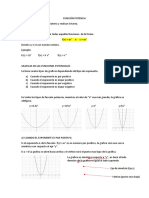
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Taller de Calculo de Moles Quimica 10
Cargado por
monica duranTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Taller de Calculo de Moles Quimica 10
Cargado por
monica duranCopyright:
Formatos disponibles
Actividad 6: Cálculo de moles y gramos de un compuesto
Para el cálculo de moles y gramos de un compuesto se toman como referencia los valores
suministrados en la tabla periódica para la masa atómica de cada elemento, luego este peso se
multiplica por los coeficientes y subíndices presentes en cada molécula.
Ejemplo:
Cl₂ O₇
Cl = 35,45 O = 15,99
Cl2 = 35,45 x2 = 70,9 O₇ = 15,99X7= 111,93
Cl₂O₇ = 70,9 g + 111,93 g = 182.83 g/mol
Tomando como referencia el video de combustión abierta del etanol resuelve los siguientes
ejercicios:
Determina el peso molecular para los elementos y compuestos de la siguiente tabla.
Sustancia Masa (g/mol)
C₂H₅OH
O₂
CO₂
H₂O
En la siguiente ecuación química determina el peso total de los reactivos y de los productos.
C₂H₅ OH + 30₂ = 2CO₂ + 3H₂O
Considerando los resultados de la actividad anterior, responde los siguientes interrogantes,
además que explica de manera escrita la estrategia que se siguió para darle solución a la
situación en cuestión:
23 ¿Cuál es el significado de los coeficientes
estequiométricos en las ecuaciones químicas?
1. ¿Para producir 8 moles de CO2, cuántas moles de CH3OH y O2 se requieren?
2. ¿10 moles de etanol (CH3OH) con cuántas moles de oxígeno (O2) reaccionan?
3. ¿128 gramos de etanol (CH3OH) con cuántos gramos de oxígeno reaccionan?
24 ¿Cuál es el significado de los coeficientes
estequiométricos en las ecuaciones químicas?
4. ¿Cuántos gramos de oxígeno y etanol se requieren para producir 264 de CO2?
5. ¿Si se tiene en un recipiente 4 moles de etanol interaccionando con 14 moles de oxígeno, cuál
de los dos reactivos se consumen primero y por qué? ¿Cuántas moles del reactivo en exceso quedan
sin reaccionar, por qué?
Otro ejemplo de resolución de cálculos estequiométricos gramo a gramo:
¿Qué cantidad de oxígeno es necesaria para reaccionar con 100 gramos de carbono produciendo
dióxido de carbono?
Masa atómica del oxígeno = 15,9994.
Masa atómica del carbono = 12,0107.
La reacción es:
C + O₂ → CO₂
25 ¿Cuál es el significado de los coeficientes
estequiométricos en las ecuaciones químicas?
Para formar una molécula de dióxido de carbono, hacen falta un átomo de carbono y dos de oxíge-
no, o lo que es lo mismo, un mol de carbono y dos mol de oxígeno.
1 mol de carbono → 2 mol de oxígeno
12,0107 gramos de carbono → 2 • 15,994 gramos de oxígeno
100 gramos de carbono → x gramos de oxígeno
Despejando x:
2 • 15,9994 gramos de oxígeno • 100 gramos de carbono
x=
12,0107 gramos de carbono
Realizadas las operaciones:
x = 266,41 gramos de oxígeno
26 ¿Cuál es el significado de los coeficientes
estequiométricos en las ecuaciones químicas?
También podría gustarte
- Taller Sobre Estequiometría y Reactivo LimitanteDocumento1 páginaTaller Sobre Estequiometría y Reactivo LimitanteJaimeZambranoAún no hay calificaciones
- Reacciones Químicas: Clasificación y EjemplosDocumento4 páginasReacciones Químicas: Clasificación y EjemplosSúper masters proAún no hay calificaciones
- Practica RedoxDocumento2 páginasPractica RedoxalvaroqeqeAún no hay calificaciones
- Ejercicios Reactivo LimitanteDocumento1 páginaEjercicios Reactivo LimitanteConstanza Rojos Almuna100% (1)
- Proyectos de educación ambiental: la utopía en la escuela: Naturaleza y sociedadDe EverandProyectos de educación ambiental: la utopía en la escuela: Naturaleza y sociedadAún no hay calificaciones
- Clasificacion de Reacciones QuimicasDocumento10 páginasClasificacion de Reacciones QuimicasChristopher Jair Cruz Garcia100% (1)
- Guía de concentración químicaDocumento3 páginasGuía de concentración químicacarolina100% (1)
- Guía de Química Secundaria Tercer, Cuarto y Quinto BloqueDocumento12 páginasGuía de Química Secundaria Tercer, Cuarto y Quinto BloqueMiguel GonzalezAún no hay calificaciones
- Cálculos estequiométricos y masas molaresDocumento3 páginasCálculos estequiométricos y masas molaresSAt41Aún no hay calificaciones
- Seminario Sem 12 Quimica Organica II AgostoDocumento2 páginasSeminario Sem 12 Quimica Organica II AgostoBrainBerniePeñaPeinadoAún no hay calificaciones
- Fórmulas empíricas y moleculares a partir de análisis químicosDocumento13 páginasFórmulas empíricas y moleculares a partir de análisis químicosArturo Vera PazAún no hay calificaciones
- Guía de Unidades Químicas de Concentración.Documento4 páginasGuía de Unidades Químicas de Concentración.Thony BehAún no hay calificaciones
- Estructura orgánica y grupos funcionalesDocumento3 páginasEstructura orgánica y grupos funcionalesFrancisco AlexisAún no hay calificaciones
- Evolución del modelo atómico desde Dalton a SchrödingerDocumento14 páginasEvolución del modelo atómico desde Dalton a Schrödingerddaniel184279Aún no hay calificaciones
- Taller Nomenclatura Quimica InorganicaDocumento3 páginasTaller Nomenclatura Quimica InorganicaSilvia Dayana Arenas PintoAún no hay calificaciones
- Quiz Recup Aldehidos y CetonasDocumento1 páginaQuiz Recup Aldehidos y CetonasAlexander Daza0% (1)
- Taller de Las Des de Los Alquenos y Alquinos.Documento4 páginasTaller de Las Des de Los Alquenos y Alquinos.Wilner Gonzalez Borja50% (2)
- Planeacion Didactica Ciencias Bloque 4 Secuencia 20Documento2 páginasPlaneacion Didactica Ciencias Bloque 4 Secuencia 20bernardo rubioAún no hay calificaciones
- Concentraciones químicasDocumento5 páginasConcentraciones químicasSusiEcheverri100% (1)
- Guía fotosíntesis bachilleratoDocumento8 páginasGuía fotosíntesis bachilleratoJesus TrianaAún no hay calificaciones
- 11 - Química - Guia 3 - Alcoholes Fenoles Aldehidos Cetonas Ácidos Carboxílicos ÉteresDocumento19 páginas11 - Química - Guia 3 - Alcoholes Fenoles Aldehidos Cetonas Ácidos Carboxílicos ÉteresLaura BazánAún no hay calificaciones
- Trabajo Practico 3 - Escalas de PHDocumento7 páginasTrabajo Practico 3 - Escalas de PHMauricio ZapataAún no hay calificaciones
- Ejercicios Estequiometricos 3ro 2016Documento26 páginasEjercicios Estequiometricos 3ro 2016DAESAún no hay calificaciones
- Nomenclatura química inorgánicaDocumento26 páginasNomenclatura química inorgánicaNubia Patricia Parada Rivera100% (1)
- Ejercicios resueltos de aldehidos y cetonasDocumento2 páginasEjercicios resueltos de aldehidos y cetonasAfir MinayaAún no hay calificaciones
- Ejercicios Unidades de ConcentracionDocumento3 páginasEjercicios Unidades de ConcentracionJessica WiederholdAún no hay calificaciones
- Taller de DisolucionesDocumento3 páginasTaller de DisolucionesAndrea GomezAún no hay calificaciones
- AlquinosDocumento14 páginasAlquinosALCIRA ACHATAAún no hay calificaciones
- Químicas Orgánicas Cuestionario NomenclaturaDocumento4 páginasQuímicas Orgánicas Cuestionario NomenclaturaJair Jesus Quito Neira0% (1)
- Calculo Del Mol Opcion MultipleDocumento15 páginasCalculo Del Mol Opcion MultipleRulo CaAún no hay calificaciones
- Practica QuímicaDocumento15 páginasPractica Químicaheidi monestelAún no hay calificaciones
- TALLER Quimica Tabla PeriodicaDocumento22 páginasTALLER Quimica Tabla PeriodicaPableinsDannielAún no hay calificaciones
- Taller Repaso EstequiometriaDocumento2 páginasTaller Repaso EstequiometriaFreddy Mendez SarmientoAún no hay calificaciones
- Guía 5 Química Ley de Conservación de La MasaDocumento6 páginasGuía 5 Química Ley de Conservación de La Masanidiad_15Aún no hay calificaciones
- Guia 1 y 2 Quimica - Grado DecimoDocumento3 páginasGuia 1 y 2 Quimica - Grado Decimoalma luciaAún no hay calificaciones
- Columna de DensidadesDocumento2 páginasColumna de DensidadesfridaylaikaAún no hay calificaciones
- Soluciones CBCDocumento3 páginasSoluciones CBCMaría Gabriela MuñozAún no hay calificaciones
- Concepto de MolDocumento4 páginasConcepto de MolJeremy LevyAún no hay calificaciones
- EVALUACIÓN de Formula Minima y Molecular GRADO DECIMODocumento1 páginaEVALUACIÓN de Formula Minima y Molecular GRADO DECIMOLisbethOrtegaAguasAún no hay calificaciones
- Coloquios 2019 PDFDocumento78 páginasColoquios 2019 PDFJoharis Escobar AscencioAún no hay calificaciones
- Prueba Soluciones Quimicas 2 MDocumento2 páginasPrueba Soluciones Quimicas 2 MDaniel P. RojasAún no hay calificaciones
- Prueba Formativa RedoxDocumento4 páginasPrueba Formativa Redoxclaudiolineros89Aún no hay calificaciones
- Preguntas de Química OrgánicaDocumento13 páginasPreguntas de Química OrgánicaFamilia Solis SobarzoAún no hay calificaciones
- Halogenacion de Alquenos Bacicidad de Las AminasDocumento11 páginasHalogenacion de Alquenos Bacicidad de Las AminasAndrea AriasAún no hay calificaciones
- Alcanos Alquenos y AlquinosDocumento4 páginasAlcanos Alquenos y AlquinosMaria Fernanda TorresitaAún no hay calificaciones
- Guía de Química II para exámenes parcialesDocumento4 páginasGuía de Química II para exámenes parcialesEnrique SalazarAún no hay calificaciones
- Cuestionario Acidos y BasesDocumento2 páginasCuestionario Acidos y BasesErnesto ZavalaAún no hay calificaciones
- Taller de AlcoholesDocumento12 páginasTaller de AlcoholeseicochaAún no hay calificaciones
- Prueba Disoluciones Unidades de Concentración II 2° Medio Fila BDocumento2 páginasPrueba Disoluciones Unidades de Concentración II 2° Medio Fila BDaniela Andrea Aros BarriosAún no hay calificaciones
- Unidades Físicas de ConcentraciónDocumento4 páginasUnidades Físicas de ConcentraciónLuis GuzmanAún no hay calificaciones
- Guia Autoaprendizaje Estudiante 8vo Grado Ciencia f3 s12Documento7 páginasGuia Autoaprendizaje Estudiante 8vo Grado Ciencia f3 s12Oscar SánchezAún no hay calificaciones
- Fórmula empírica y cálculos químicosDocumento4 páginasFórmula empírica y cálculos químicosVictoria Mellinas AlvarezAún no hay calificaciones
- Cinética química: Estudio de la velocidad de las reaccionesDocumento7 páginasCinética química: Estudio de la velocidad de las reaccionesIrving DiazAún no hay calificaciones
- Las Reacciones Químicas en Nuestro EntornoDocumento7 páginasLas Reacciones Químicas en Nuestro EntornoDavu SitoAún no hay calificaciones
- Reactivo limitanteDocumento14 páginasReactivo limitanteLuis Maldonado100% (1)
- Hidrocarburos AromaticosDocumento37 páginasHidrocarburos AromaticosValentina OrtizAún no hay calificaciones
- Unidad-Didactica (Reacción Química)Documento5 páginasUnidad-Didactica (Reacción Química)Yoyito Marulanda Yoyito MarulandaAún no hay calificaciones
- Ejercicios de Moles Paso A PasoDocumento8 páginasEjercicios de Moles Paso A PasoMiguel Ángel Rodriguez GuevaraAún no hay calificaciones
- Ejercicios de Porcentaje de RendimientoDocumento1 páginaEjercicios de Porcentaje de RendimientoCarolina Valdez RochaAún no hay calificaciones
- 4 DFD 47Documento8 páginas4 DFD 47monica duranAún no hay calificaciones
- Colegio HispanoamericanoDocumento1 páginaColegio Hispanoamericanomonica duranAún no hay calificaciones
- Formato Lista de Chequeo Estado de Equipos CríticosDocumento1 páginaFormato Lista de Chequeo Estado de Equipos CríticosSantos MoralesAún no hay calificaciones
- A3d4d9 1Documento1 páginaA3d4d9 1monica duranAún no hay calificaciones
- Material Checklist Inspeccion Motoniveladoras CaterpillarDocumento3 páginasMaterial Checklist Inspeccion Motoniveladoras Caterpillarmonica duran100% (1)
- Preoperacionales TornoDocumento19 páginasPreoperacionales TornoTANIA STEFANNY ZARATE OYAGAAún no hay calificaciones
- Formato Lista de Chequeo Estado de Equipos CríticosDocumento1 páginaFormato Lista de Chequeo Estado de Equipos CríticosSantos MoralesAún no hay calificaciones
- Formatos de IpDocumento9 páginasFormatos de IpYasira Aleman LauraAún no hay calificaciones
- Material Checklist Inspeccion Motoniveladoras CaterpillarDocumento3 páginasMaterial Checklist Inspeccion Motoniveladoras Caterpillarmonica duran100% (1)
- Formatos de IpDocumento9 páginasFormatos de IpYasira Aleman LauraAún no hay calificaciones
- Formato Lista de Chequeo Estado de Equipos CríticosDocumento1 páginaFormato Lista de Chequeo Estado de Equipos CríticosSantos MoralesAún no hay calificaciones
- Lista ChequeoDocumento4 páginasLista ChequeoFRANKLIN RAMIREZ HERNANDEZAún no hay calificaciones
- Taller sobre cambios en la adolescenciaDocumento7 páginasTaller sobre cambios en la adolescenciamonica duranAún no hay calificaciones
- Material Partes Componentes Motoniveladora Komatsu Ingles Espanol Traducciones Glosario VocabularioDocumento6 páginasMaterial Partes Componentes Motoniveladora Komatsu Ingles Espanol Traducciones Glosario VocabularioAldo TitoAún no hay calificaciones
- Material Inspeccion Seguridad Mantenimiento MotoniveladoraDocumento2 páginasMaterial Inspeccion Seguridad Mantenimiento MotoniveladoraxxxxxxAún no hay calificaciones
- Preoperacionales TornoDocumento19 páginasPreoperacionales TornoTANIA STEFANNY ZARATE OYAGAAún no hay calificaciones
- Material Checklist Inspeccion Motoniveladoras CaterpillarDocumento3 páginasMaterial Checklist Inspeccion Motoniveladoras Caterpillarmonica duran100% (1)
- Cómo influyen los enlaces de carbonoDocumento6 páginasCómo influyen los enlaces de carbonomonica duranAún no hay calificaciones
- d8edee0ba08d130f8788f11208203efaDocumento13 páginasd8edee0ba08d130f8788f11208203efamonica duranAún no hay calificaciones
- Quimica Organica 11Documento4 páginasQuimica Organica 11monica duranAún no hay calificaciones
- Partes de Una MotoniveladoraDocumento1 páginaPartes de Una MotoniveladoraDante Lopez Ramos91% (23)
- 4 DFD 47Documento8 páginas4 DFD 47monica duranAún no hay calificaciones
- Taller de Solociones QuimicaDocumento5 páginasTaller de Solociones Quimicamonica duranAún no hay calificaciones
- Material Checklist Inspeccion Motoniveladoras CaterpillarDocumento3 páginasMaterial Checklist Inspeccion Motoniveladoras Caterpillarmonica duran100% (1)
- Medidas locales para mitigar el cambio climáticoDocumento5 páginasMedidas locales para mitigar el cambio climáticomonica duranAún no hay calificaciones
- Moles Quimica 10Documento3 páginasMoles Quimica 10monica duranAún no hay calificaciones
- Material Inspeccion Seguridad Mantenimiento MotoniveladoraDocumento2 páginasMaterial Inspeccion Seguridad Mantenimiento MotoniveladoraxxxxxxAún no hay calificaciones
- Preoperacionales TornoDocumento19 páginasPreoperacionales TornoTANIA STEFANNY ZARATE OYAGAAún no hay calificaciones
- Material Checklist Inspeccion Motoniveladoras CaterpillarDocumento3 páginasMaterial Checklist Inspeccion Motoniveladoras Caterpillarmonica duran100% (1)
- CD 10206Documento134 páginasCD 10206Jontn RomanzAún no hay calificaciones
- Estandarizacion de Test de Dependencia Al CelularDocumento23 páginasEstandarizacion de Test de Dependencia Al CelularMILUSCA HUMPIRYAún no hay calificaciones
- Afinidad Electronica 123PDFDocumento8 páginasAfinidad Electronica 123PDFRicardo MarianoAún no hay calificaciones
- TEMA 1. MASTER EN SECUNDARIAalDocumento41 páginasTEMA 1. MASTER EN SECUNDARIAaljuanAún no hay calificaciones
- Modelado de Sistemas EléctricosDocumento4 páginasModelado de Sistemas EléctricosISmael MEdina LOpezAún no hay calificaciones
- Cómo y Con Qué Se Hace El VidrioDocumento11 páginasCómo y Con Qué Se Hace El VidrioCristina Acosta PierolaAún no hay calificaciones
- Secuencia de Español sobre anuncios clasificados y cartas de opiniónDocumento12 páginasSecuencia de Español sobre anuncios clasificados y cartas de opiniónEstefania RodriguezAún no hay calificaciones
- Ebook 2Documento13 páginasEbook 2DanielaAún no hay calificaciones
- Técnica e Instrumento de Recolección de DatosDocumento3 páginasTécnica e Instrumento de Recolección de DatosAlvaro BritoAún no hay calificaciones
- Ensayo de torsión en aluminioDocumento23 páginasEnsayo de torsión en aluminioVilitzaAún no hay calificaciones
- Mihc Ekin 1Documento24 páginasMihc Ekin 1anjicel12aAún no hay calificaciones
- Proposiciones Categoricas Ejercicio 1 AuraDocumento10 páginasProposiciones Categoricas Ejercicio 1 AuraAura GuzmanAún no hay calificaciones
- Perfiles longitudinales fotogrametriaDocumento27 páginasPerfiles longitudinales fotogrametriaGabriel SanchezAún no hay calificaciones
- Análisis de diagramas de dispersión obtenidos mediante MASW para determinar el perfil de velocidades VS en un sitio de estudioDocumento15 páginasAnálisis de diagramas de dispersión obtenidos mediante MASW para determinar el perfil de velocidades VS en un sitio de estudioMartínez Olmos OsirisAún no hay calificaciones
- Gloria Itzel Rios Salinas - Matematicas 1º Grado Jaime Vivas Ficha 3Documento4 páginasGloria Itzel Rios Salinas - Matematicas 1º Grado Jaime Vivas Ficha 3Marco Antonio Chan UcanAún no hay calificaciones
- Trazado y EscalasDocumento25 páginasTrazado y EscalasLucas PeresonAún no hay calificaciones
- ADEL35LZ EspañolDocumento1 páginaADEL35LZ EspañolJhon GarciaAún no hay calificaciones
- Termometria 2018Documento2 páginasTermometria 2018Ronald ChoqueAún no hay calificaciones
- Procesos Extractivos I - Cap. IIDocumento63 páginasProcesos Extractivos I - Cap. IIfranklin palacios quispeAún no hay calificaciones
- Mecanismos conservación alimentosDocumento2 páginasMecanismos conservación alimentosDiana MejíaAún no hay calificaciones
- Incertidumbre de La MedicionDocumento88 páginasIncertidumbre de La MedicionGerman DiazAún no hay calificaciones
- Parte IV Relatos de BelcebuDocumento13 páginasParte IV Relatos de BelcebuCarlos De La GarzaAún no hay calificaciones
- Practica # 3. Determinación Del Calor de ReacciónDocumento7 páginasPractica # 3. Determinación Del Calor de ReacciónSantiago CazorlaAún no hay calificaciones
- CodigosDocumento19 páginasCodigosRichar ArturoAún no hay calificaciones
- Linea Del AtomoDocumento1 páginaLinea Del AtomoHarold Ulises Monsivais LópezAún no hay calificaciones
- Teoria de Arreglos PDFDocumento7 páginasTeoria de Arreglos PDFPipiNewellsAún no hay calificaciones
- AjaxDocumento123 páginasAjaxhipolito100% (1)
- 7 - 10mo - Funcion PotenciaDocumento13 páginas7 - 10mo - Funcion PotenciaGonzalo OñateAún no hay calificaciones
- IPv4 y IPv6Documento5 páginasIPv4 y IPv6David Alexander Monroy MirandaAún no hay calificaciones
- Ejercicios Combinatoria EnumerativaDocumento2 páginasEjercicios Combinatoria EnumerativaMilagros VegaAún no hay calificaciones