Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tipos de enlaces químicos y sus características
Cargado por
RICHARD VILLARDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Tipos de enlaces químicos y sus características
Cargado por
RICHARD VILLARCopyright:
Formatos disponibles
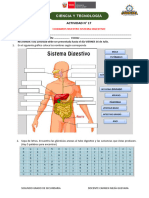
ENLACES QUÍMICOS
TIPOS DE ENLACE:
Se denomina enlace químico a toda
fuerza que mantiene unidos los átomos de los
elementos para formar moléculas. Los átomos y
moléculas forman enlaces químicos con la
finalidad de adquirir un estado de menor
energía, para tener mayor estabilidad. En el
caso de los átomos, la estabilidad se refleja en
un cambio de su configuración electrónica
externa debido que completa su octeto
electrónico.
REGLA DEL OCTETO: Los átomos tienden a
perder, ganar o compartir electrones en forma
tal que queden con un total de 8 electrones en
su nivel energético más exterior, esta
configuración les proporciona gran estabilidad.
IONES: átomos o conjunto de átomos que
poseen carga eléctrica.
Catión: ion con carga positiva. Ejemplo:
1.-ENLACES INTERATÓMICOS:
Ca+2 ion calcio, NH4+ ion amonio.
Anión: ion con carga negativa. Ejemplo:
1.1.-ENLACE IÓNICO: Se origina cuando se
Br- ion bromuro, ClO2- ion clorito
transfiere uno o varios electrones de un átomo a
EJEMPLOS: El sodio tiene un potencial de
otro. Debido al intercambio electrónico, los
ionización bajo y puede perder fácilmente su
átomos se cargan positiva y negativamente,
electrón 3s:
estableciéndose así una fuerza de atracción
electrostática que los enlaza. Se forma entre dos
Na0 → Na+ + 1e-
átomos con una apreciable diferencia de
1s2 2s2 → 1s2 2s2 + 1e-
electronegatividades, los elementos de los
2p6 3s1 2p6
grupos I y II A forman enlaces iónicos con los
Átomo Ion de
elementos de los grupos VI y VII A. En
de sodio sodio
compuestos binarios, la diferencia de
electronegatividad que existe entre ellos es
La estructura electrónica del ion sodio resultante
mayor a 1,7. Ejemplo:
es exactamente igual a la del gas noble neón.
Este ion es una especie muy estable.
Otros elementos ganan electrones para llenar la
capa de valencia y alcanzar la configuración
estable de 8 electrones. El cloro es un ejemplo:
1.2.-ENLACE COVALENTE: Se presenta cuando
Cl0 → 1e- + Cl-
2 2 6 se comparten uno o más pares de electrones
1s 2s 2p → + 1s 2s2 2p6
2
2 5 entre dos átomos cuya diferencia de
3s 3p 3s2 3p6
electronegatividad es pequeña. Por su polaridad
Átomo de Ion cloruro pueden ser:
cloro
A)E. C. polar: Se establece entre átomos
NOTACIÓN DE LEWIS: Es la representación con electronegatividades próximas pero
mediante puntos o aspas de los electrones de no iguales. Ejemplo:
valencia (electrones del último nivel). Ejemplo:
Cl → 1s2, 2s2, 2p6, 3s2, 3p5
Todos los elementos que pertenecen a un mismo B) E. C. Apolar: Se establece entre átomos
grupo tienen la misma notación de Lewis. con igual electronegatividad. Átomos del
mismo elemento presentan este tipo de
enlace. Ejemplo:
Prof. Richard Heber Villar Salazar 4
4
Por su procedencia pueden ser:
A) E. C. Puro: Es cuándo los átomos
aportan uno o más electrones de valencia
de manera equitativa. Ejemplo la B) ENLACE PENTE DE HIDRÓGENO: El
molécula de H2 gaseoso. hidrógeno queda con una densidad de
carga positiva, y es atraído por un par de
electrones no compartidos, de un átomo
electronegativo, con lo que se produce el
B) E. C. Coordinado o dativo: Se establece puente o enlace. Este último átomo debe
por compartición de electrones entre dos tener un volumen pequeño para que su
átomos pero un átomo aporta el par de densidad de carga sea grande y pueda
electrones compartidos. Ejemplo: ejercer la atracción electroestática
requerida por un átomo de hidrógeno. Es
el caso del flúor, el oxígeno y el
nitrógeno. El cloro, por ejemplo, debido a
su gran volumen, nunca podrá participar
en este tipo de enlace.
Por el número de enlaces pueden ser:
A) E. C. Simple: Es cuando se presenta un
enlace covalente de átomo a átomo,
participan solamente un par de
C) FUERZAS DIPOLO –DIPOLO: Es una
electrones. Ejemplo: ,Cl2, H3PO4
fuerza de atracción eléctrica entre los
polos opuestos de moléculas polares.
Estas fuerzas disminuyen rápidamente
con la distancia, es decir a mayor
distancia dipolo – dipolo menor fuerza de
atracción.
B) E. C. Doble: Es cuando se presenta 2
enlaces covalentes de átomo a átomo,
participan 2 pares de electrones.
Ejemplo: O2.
D) FUERZAS DE VAN DER WAALS: Es la
atracción que existe entre los núcleos de
los átomos de una molécula con las
nubes electrónicas de los átomos vecinos
de otras moléculas. Estas fuerzas son las
C) E. C. Triple: Es cuando se presenta 3 responsables de muchos fenómenos
enlaces covalentes de átomo a átomo, físicos y químicos como la adhesión, el
participan 3 pares de electrones. rozamiento, la difusión, la tensión
Ejemplo: N2, superficial y la viscosidad.
2.- ENLACES INTERMOLECULARES:
A) ENLACE METÁLICO: Es propio de los
elementos metálicos, se origina por la
facilidad que tienen los electrones
periféricos de pasar de un átomo a otro.
Prof. Richard Heber Villar Salazar 4
4
ENLACE QUÍMICO D) sp2,sp, sp3
E) sp3, sp2,sp
1. Un elemento químico posee dos isótopos
cuyos números de masa suman 138 y poseen 9. Un elemento representativo del quinto
70 neutrones en total. Indique el número de periodo de la Tabla Periódica posee la
electrones de valencia. notación Lewis:
A) 3 B) 4 C) 5 D) 6 E) 7
2. El último electrón en la configuración de un
elemento posee el estado cuántico (4, 1, 0,
-1/2). Señale la notación Lewis del elemento.
Indique el número atómico:
A) 53 B) 52 C) 51 D) 50 E) 49
3. Indique el número de enlaces sigma en cada
10. Indique la forma geométrica de las
uno de los siguientes compuestos:
siguientes moléculas:
I. N2O3 II. SiO2 III. C2H4
1. BeCl2 2. BF3 3. SO2 4. CH4 5. NF3
A) 1,2,3 B) 5,2,3 C) 5,3,4 D) 4,2,5
6. H2S 7. PCl5 8. SF6 9. HCN 10. HCHO
E) 4,2,4
4. Señale el número de enlaces dativos en cada
11. En la siguiente figura, se representa a la
caso:
molécula de ácido hipocloroso, aquí
observamos que entre el hidrógeno y el
I. Cl207 II. P2O5 III. H2SO4
cloro se realiza un enlace covalente simple
A) 6,2,1 B) 6,3,2 C) 5,3,2 D) 6,2,0
alcanzando el hidrógeno su dueto respectivo
E) 6,2,2
y el cloro también alcanza su:
A) Dueto
5. De los siguientes compuestos:
B) Cuarteto
C) Sexteto
I. NF5 II. H2 III. BeCl2 IV. O2
D) Octeto
¿Cuáles no cumplen con la regla del octeto?
E) O y P
A) I,II B) II,III C) I,II,III D) Sólo IV
E) Todos
6. Indique la hibridación del Nitrógeno en 12. Si el potasio tiene 0,8 de
cada caso: electronegatividad y el cloro tiene 3,2 su
enlace es de tipo:
I. N2 II. NH3 III. N2O3 A) Covalente
B) Iónico
A) sp,sp2,sp3 B) sp,sp3,sp2 C) sp2,sp,sp3 C) Metálico
D) sp,sp2,sp2 E) sp,sp3,sp3 D) Coordinado
E) Molecular
7. Un elemento químico A de número atómico
33 se une a otro elemento químico B de 13. De los siguientes compuestos binarios,
número atómico 53, señale la hibridación del los que tienen fuerte carácter iónico son:
átomo central. I. NH3 II. CO2 III. NaCl
A) Solo I
A) sp B) sp2 C) sp3 D) sp3 d2 B) Sólo II
E) sp3 d C) Solo III
D) I y II
8. En el compuesto orgánico señalado indique la E) Todas
hibridación de cada Carbono mostrado (I),
(II), (III), respectivamente:
14. El enlace que se forma entre los iones de
A) sp, sp2, sp3 carga opuesta se denomina:
B) sp,sp3,sp2 A) Metálico
C) sp3,sp2,sp2
Prof. Richard Heber Villar Salazar 4
4
B)
Covalente
C)
Iónico
D)
Covalente coordinado
E)
Molecular
15. La molécula de hidrógeno es diatómica.
El enlace que forma entre los átomos es:
A) Iónico
B) Metálico
C) Puente de hidrógeno
D) Covalente
E) Polar
16. En un enlace covalente ocurre que:
A) Los átomos se mantienen unidos por
fuerzas contrarias
B) Hay transferencia de electrones
C) No forman verdaderas moléculas
D) Cada átomo aporta un electrón del par
que se comparte
E) Ninguno
17. Un enlace entre carbono e hidrógeno es
de carácter polar PORQUE El par de
electrones compartidos entre carbono e
hidrógeno es retenido parcialmente por el
carbono. ( ) ( ).
18. En la siguiente reacción química:
2 Na + O → Na2O
Se produce enlace:
A) Metálico
B) Covalente
C) Covalente polar
D) Covalente simple
E) Iónico
“No hay que confundir nunca el conocimiento
19. Siendo el ión hidrógeno H+, una especie con la sabiduría. El primero nos sirve para
inestable en solución acuosa, no puede ganarnos la vida; la sabiduría nos ayuda a vivir.
existir libre sino asociada con una molécula (Sorcha Carey)”
de agua, presentándola entre ellas un
enlace de tipo:
A) Iónico
B) Covalente simple
C) Covalente coordinado
D) Covalente no polar
E) Covalente Pi
20. En el CH4 el átomo de carbono presenta
hibridación.............por lo tanto la forma de
la molécula es.............
A) Sp1 diagonal
B) Sp2 trigonal
C) Sp2 tetragonal
D) Sp3 tetragonal
E) Sp3 trigonal
Prof. Richard Heber Villar Salazar 4
4
También podría gustarte
- Guia-de-Enlace-Quimico-de-SeptimoDocumento4 páginasGuia-de-Enlace-Quimico-de-SeptimoJose Gregorio OrtegaAún no hay calificaciones
- Enlaces Quimicos Informacion para Las AlumnasDocumento3 páginasEnlaces Quimicos Informacion para Las AlumnasKarlaAún no hay calificaciones
- Guía Taller Química - Enlaces QuímicosDocumento6 páginasGuía Taller Química - Enlaces Químicossai201575% (4)
- Enlace QuimicoDocumento18 páginasEnlace QuimicoYesenia GarciaAún no hay calificaciones
- Enlaces QuimicosDocumento29 páginasEnlaces Quimicosplanetashop976Aún no hay calificaciones
- Unidad 4-ENLACES QUIMICOS-Parte 1Documento55 páginasUnidad 4-ENLACES QUIMICOS-Parte 1Sintia RedAún no hay calificaciones
- 4 Enlaces - QuimicosDocumento21 páginas4 Enlaces - QuimicosConstructora InsajAún no hay calificaciones
- 2-Enlaces Quimicos MBDocumento6 páginas2-Enlaces Quimicos MBferhumanistaAún no hay calificaciones
- Enlace QuímicoDocumento3 páginasEnlace QuímicoPENELOPE MARTINEZAún no hay calificaciones
- Enlace CovalenteDocumento3 páginasEnlace CovalentedayannaAún no hay calificaciones
- Cuadro Comparativo Fuerzas Intramoleculares e Intermoleculares.Documento4 páginasCuadro Comparativo Fuerzas Intramoleculares e Intermoleculares.Krystel Dariana Valiente Hernández BAún no hay calificaciones
- Marco TeóricoDocumento2 páginasMarco TeóricoANYELI LUCIANO FLORESAún no hay calificaciones
- Glosario Nº3Documento8 páginasGlosario Nº3Nicolas CocoAún no hay calificaciones
- 3ro Abl Enlace Quimico-Estructura de LewisDocumento3 páginas3ro Abl Enlace Quimico-Estructura de Lewisrokiquino5Aún no hay calificaciones
- Guia de Quimica SeptimoDocumento5 páginasGuia de Quimica SeptimoYeison PedrazaAún no hay calificaciones
- Unidad VI QMA-103, 201, 110Documento20 páginasUnidad VI QMA-103, 201, 110Maximo adames alvaradoAún no hay calificaciones
- Química Orgánica General (0101723). Guía Tema 1: Tipos de Enlaces QuímicosDocumento22 páginasQuímica Orgánica General (0101723). Guía Tema 1: Tipos de Enlaces QuímicosmaeloAún no hay calificaciones
- Teoría de Enlace QuímicoDocumento3 páginasTeoría de Enlace QuímicoFabián Andrés QuinteroAún no hay calificaciones
- Investigación Sobre Enlaces QuímicosDocumento4 páginasInvestigación Sobre Enlaces QuímicosAngel ViverosAún no hay calificaciones
- Enlace QuímicoDocumento11 páginasEnlace QuímicoMaría Francisco SánchezAún no hay calificaciones
- Enlace Quimico - OK PDFDocumento35 páginasEnlace Quimico - OK PDFYves Olivier Brard AracenaAún no hay calificaciones
- Actividad #3 - EnlacesDocumento6 páginasActividad #3 - EnlacesJEAN PIERRE ROJAS BAEZAún no hay calificaciones
- Guía Enlace Químico 2021Documento5 páginasGuía Enlace Químico 2021Maria CardenasAún no hay calificaciones
- Química Orgánica: Enlaces QuímicosDocumento23 páginasQuímica Orgánica: Enlaces QuímicosJesus Daniel OrtizAún no hay calificaciones
- Actividad4 QuimicaDocumento11 páginasActividad4 QuimicafabiolaAún no hay calificaciones
- Enlace Químico y Fuerzas IntermolecularesDocumento80 páginasEnlace Químico y Fuerzas IntermolecularesJhojan Darkar CalderonAún no hay calificaciones
- Uindad 2 Enlaces Químicos y El Estado Sólido1Documento52 páginasUindad 2 Enlaces Químicos y El Estado Sólido1OMAR PEÑUÑURI MIRANDAAún no hay calificaciones
- Uniones QuìmicasDocumento28 páginasUniones QuìmicasAlu AbadieAún no hay calificaciones
- Semana01 2Documento55 páginasSemana01 2Manuel Nicolas Sanchez100% (1)
- Actividad4 QuímicaDocumento11 páginasActividad4 QuímicaLuis Angel Gárate Chambilla100% (3)
- FICHA RESUMEN DE ENLACE QUIMICO 1 (Reparado)Documento4 páginasFICHA RESUMEN DE ENLACE QUIMICO 1 (Reparado)Jan End Liam Parlov RGAún no hay calificaciones
- Tema Enlace QuimicoDocumento33 páginasTema Enlace QuimicoLaura Laiolo MorenoAún no hay calificaciones
- Unidad 3. Enlaces QuimicosDocumento9 páginasUnidad 3. Enlaces QuimicosCharles Zepeda100% (2)
- Quimica 10° #33Documento7 páginasQuimica 10° #33abel hernandezAún no hay calificaciones
- Cuadernillo Uniones Químicas 41 2023Documento11 páginasCuadernillo Uniones Químicas 41 2023Sweet CeecyAún no hay calificaciones
- Enlaces QuimicosDocumento8 páginasEnlaces QuimicosJosé Carlo Vallecillo LizardoAún no hay calificaciones
- Presentacion Enlace Quimico (Apunte 2) v2 FinalDocumento75 páginasPresentacion Enlace Quimico (Apunte 2) v2 FinalAnto SanitáAún no hay calificaciones
- Química General T4Documento11 páginasQuímica General T4John Ramos JapaAún no hay calificaciones
- 1.7 Enlaces QuímicosDocumento57 páginas1.7 Enlaces QuímicosEmi ZárateAún no hay calificaciones
- 5tasemanacepreunmsm 140212082022 Phpapp02Documento6 páginas5tasemanacepreunmsm 140212082022 Phpapp02Araceli Guerrero ApolinarioAún no hay calificaciones
- UnionesDocumento19 páginasUnionesSandra HambergAún no hay calificaciones
- Q1 - Uniones QuimicasDocumento37 páginasQ1 - Uniones QuimicasMars LolxAún no hay calificaciones
- Tipos de enlace interatómico y sus característicasDocumento2 páginasTipos de enlace interatómico y sus característicasFABIO ALEXANDER RUIZ V.Aún no hay calificaciones
- Electronegatividad y Enlaces QuímicosDocumento18 páginasElectronegatividad y Enlaces QuímicosDayana Vázquez gordilloAún no hay calificaciones
- Enlace Químico I: Fundamentos Teóricos y ClasificaciónDocumento3 páginasEnlace Químico I: Fundamentos Teóricos y ClasificaciónAngelitoLeónAún no hay calificaciones
- Guia 2 Química 8 Enlaces QuimicosDocumento3 páginasGuia 2 Química 8 Enlaces Quimicosjose valderramaAún no hay calificaciones
- Semana 6 Acompañamiento Virtual Quìmica OnceDocumento5 páginasSemana 6 Acompañamiento Virtual Quìmica OnceJuan David Jaramillo RodriguezAún no hay calificaciones
- Sesion 06 - Enlace QuimicoDocumento74 páginasSesion 06 - Enlace QuimicoDANY HANCCOAún no hay calificaciones
- Los Covalentes, Enlaces Iónicos, Enlace Metálico, Electronegatividad y ElectropositividadDocumento11 páginasLos Covalentes, Enlaces Iónicos, Enlace Metálico, Electronegatividad y ElectropositividadCristina PerezAún no hay calificaciones
- Enlaces QuímicosDocumento5 páginasEnlaces QuímicosLucia SalinasAún no hay calificaciones
- Unidad 04 Enlace QuímicopptxDocumento40 páginasUnidad 04 Enlace QuímicopptxjoelquimicoAún no hay calificaciones
- Configuración ElectrónicaDocumento18 páginasConfiguración ElectrónicaJessicaAún no hay calificaciones
- Enlace QuimicoDocumento8 páginasEnlace Quimicovictor castillaAún no hay calificaciones
- Enlaces Químicos y Estructuras de LewisDocumento54 páginasEnlaces Químicos y Estructuras de LewisMiguelAngelCaviedesAún no hay calificaciones
- QuímicaDocumento6 páginasQuímicaJavier Castillo PérezAún no hay calificaciones
- Enlace IónicoDocumento1 páginaEnlace Iónicoandres santiagoAún no hay calificaciones
- Tema 4Documento18 páginasTema 4alejasp1708Aún no hay calificaciones
- Quimica Semana 6 - 2021 IIIDocumento5 páginasQuimica Semana 6 - 2021 IIICarlos A. Villanueva HilaroAún no hay calificaciones
- PPT Clase - Enlaces QuímicosDocumento18 páginasPPT Clase - Enlaces QuímicosTrinidad GutiérrezAún no hay calificaciones
- Actividad 17Documento3 páginasActividad 17RICHARD VILLARAún no hay calificaciones
- Actividad 16Documento4 páginasActividad 16RICHARD VILLARAún no hay calificaciones
- La Ciencia - La Física - MagnitudesDocumento6 páginasLa Ciencia - La Física - MagnitudesRICHARD VILLARAún no hay calificaciones
- Densidad RealDocumento1 páginaDensidad RealRICHARD VILLARAún no hay calificaciones
- Alcohol en Gel CaseroDocumento12 páginasAlcohol en Gel CaseroRICHARD VILLARAún no hay calificaciones
- De Qué Tamaño Es La PoblaciónDocumento2 páginasDe Qué Tamaño Es La PoblaciónRICHARD VILLARAún no hay calificaciones
- Sesión de Aprendizaje N 3Documento4 páginasSesión de Aprendizaje N 3RICHARD VILLARAún no hay calificaciones
- Ficha Informativa #16Documento5 páginasFicha Informativa #16RICHARD VILLARAún no hay calificaciones
- Sesión de Aprendizaje #16Documento3 páginasSesión de Aprendizaje #16RICHARD VILLARAún no hay calificaciones
- Sesión de Aprendizaje N 4Documento2 páginasSesión de Aprendizaje N 4RICHARD VILLARAún no hay calificaciones
- Crecimiento de Plantas en Diversas GravedadesDocumento1 páginaCrecimiento de Plantas en Diversas GravedadesRICHARD VILLARAún no hay calificaciones
- CINEMÁTICADocumento11 páginasCINEMÁTICARICHARD VILLARAún no hay calificaciones
- Absorción de La LuzDocumento1 páginaAbsorción de La LuzRICHARD VILLARAún no hay calificaciones
- Cultivo Casero de LegumbresDocumento2 páginasCultivo Casero de LegumbresRICHARD VILLARAún no hay calificaciones
- Funciones Oxigenadas 15Documento6 páginasFunciones Oxigenadas 15RICHARD VILLARAún no hay calificaciones
- Contaminación ambiental: efectos invernadero, lluvia ácida y smogDocumento6 páginasContaminación ambiental: efectos invernadero, lluvia ácida y smogRICHARD VILLARAún no hay calificaciones
- Equilibrio Quimico Ácidos y Bases 12Documento7 páginasEquilibrio Quimico Ácidos y Bases 12RICHARD VILLARAún no hay calificaciones
- 14 - HidrocarburosDocumento9 páginas14 - HidrocarburosXDjkrizz ArteagaAún no hay calificaciones
- Sistema Internacional de Unidades Densidad - Temperatura Materia EnergiaDocumento141 páginasSistema Internacional de Unidades Densidad - Temperatura Materia EnergiaRudy Anthoni Mamani CoilaAún no hay calificaciones
- BIOLOGIA IntegralDocumento173 páginasBIOLOGIA IntegralRICHARD VILLARAún no hay calificaciones
- Soluciones IIIDocumento4 páginasSoluciones IIIRICHARD VILLARAún no hay calificaciones
- La tabla periódica actualDocumento3 páginasLa tabla periódica actualRICHARD VILLARAún no hay calificaciones
- Expo de Espina BifidaDocumento10 páginasExpo de Espina BifidaRICHARD VILLARAún no hay calificaciones
- Nomenclatura InorganicaDocumento5 páginasNomenclatura InorganicaRICHARD VILLARAún no hay calificaciones
- Química Orgánica IIDocumento4 páginasQuímica Orgánica IIRICHARD VILLARAún no hay calificaciones
- Galleta de LúcumaDocumento6 páginasGalleta de LúcumaRICHARD VILLARAún no hay calificaciones
- Química NuclearDocumento3 páginasQuímica NuclearRICHARD VILLARAún no hay calificaciones
- Esclerosis MúltipleDocumento13 páginasEsclerosis MúltipleRICHARD VILLARAún no hay calificaciones
- Epilepsia ExposiciónDocumento8 páginasEpilepsia ExposiciónRICHARD VILLARAún no hay calificaciones
- VERPOGELIDocumento6 páginasVERPOGELIRICHARD VILLARAún no hay calificaciones
- Guia InecuasionesDocumento5 páginasGuia InecuasionesAlekos PanagulisAún no hay calificaciones
- Metodología CartesianaDocumento7 páginasMetodología CartesianaGloria SandovalAún no hay calificaciones
- Sabes Qué Es Un SapiosexualDocumento3 páginasSabes Qué Es Un SapiosexualEl_BohemioAún no hay calificaciones
- Guía 8-Parcial 3Documento20 páginasGuía 8-Parcial 3JesusAún no hay calificaciones
- Cohecho en ColombiaDocumento5 páginasCohecho en ColombiaJosé JuliánAún no hay calificaciones
- Tesis Cú Sánchez Alma PatriciaDocumento133 páginasTesis Cú Sánchez Alma PatriciaArleking No ExisteAún no hay calificaciones
- Comparatives and SuperlativesDocumento3 páginasComparatives and SuperlativesFernando Alameda TorijanoAún no hay calificaciones
- La fé bíblica (EmunahDocumento9 páginasLa fé bíblica (EmunahUrfiles Perez PerezAún no hay calificaciones
- Resortes Mecánicos: Diseño y AnálisisDocumento54 páginasResortes Mecánicos: Diseño y Análisisfpayares4619Aún no hay calificaciones
- Resolución de casos penales: Teoría estratificada del delitoDocumento13 páginasResolución de casos penales: Teoría estratificada del delitoGrace PerezAún no hay calificaciones
- Gottfried Wilhelm LeibnizDocumento6 páginasGottfried Wilhelm Leibnizsantiago 88Aún no hay calificaciones
- SialolitiasisDocumento11 páginasSialolitiasiskevin ramirez alonsoAún no hay calificaciones
- TOPOGRAFICODocumento11 páginasTOPOGRAFICOcarlos peñaAún no hay calificaciones
- Cuaderno de Navidad Orientación Andújar Quinto PRIMARIADocumento16 páginasCuaderno de Navidad Orientación Andújar Quinto PRIMARIAMaestro LuisAún no hay calificaciones
- El ex jesuita Mariátegui pide justicia ante las Cortes de CádizDocumento73 páginasEl ex jesuita Mariátegui pide justicia ante las Cortes de CádizJulio Alberto CarrerasAún no hay calificaciones
- Trabajo de Naylet. Politicas de Salud en VenezuelaDocumento19 páginasTrabajo de Naylet. Politicas de Salud en Venezueladofrela100% (2)
- Monografía de XochimilcoDocumento40 páginasMonografía de Xochimilcozac_kuk100% (4)
- ¿Qué Es La SabiduriaDocumento3 páginas¿Qué Es La SabiduriaAmelia FloresAún no hay calificaciones
- Derechos de familia homoparentalDocumento5 páginasDerechos de familia homoparentalBenjamín T.Aún no hay calificaciones
- Aful Tarde - Semana 8Documento3 páginasAful Tarde - Semana 8Sengundo Rojas RamosAún no hay calificaciones
- Auditoria OperacionalDocumento38 páginasAuditoria OperacionalFabian_Antonio_2623100% (5)
- Modulo 1 CavitaciónDocumento14 páginasModulo 1 CavitaciónAdriana Yepez100% (3)
- Primer paso hacia el progresoDocumento102 páginasPrimer paso hacia el progresoEducaCardenasIstSanPedro100% (1)
- Plan de ClaseDocumento4 páginasPlan de ClaseOrtega MarcoAún no hay calificaciones
- Cuadro Comparativo e Informe Ismael Agustin SilvaDocumento4 páginasCuadro Comparativo e Informe Ismael Agustin SilvaVíctor Esau VoctorAún no hay calificaciones
- UntitledDocumento38 páginasUntitledZara LXAún no hay calificaciones
- Pasantia Completa..Documento55 páginasPasantia Completa..Julio César BorgesAún no hay calificaciones
- Hacedor de Caminos - ADocumento1 páginaHacedor de Caminos - AMarlon ObandoAún no hay calificaciones
- Dirección Regional de Educación Huánuco (Diapositivas)Documento7 páginasDirección Regional de Educación Huánuco (Diapositivas)Eliseo Rojas MuñozAún no hay calificaciones
- CARNAVALESDocumento8 páginasCARNAVALESNataly Mera VelaAún no hay calificaciones