Documentos de Académico
Documentos de Profesional
Documentos de Cultura
UribeVegaAxel Tarea Previa 2
Cargado por
Axel Uribe VegaDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
UribeVegaAxel Tarea Previa 2
Cargado por
Axel Uribe VegaCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
FACULTAD DE QUÍMICA
DEPARTAMENTO DE QUÍMICA INORGÁNICA Y NUCLEAR
1310 QUÍMICA INORGÁNICA I (LABORATORIO)
TAREA PREVIA 2
Nombre del alumno: Uribe Vega Axel
Contesta adecuadamente las siguientes preguntas.
1.- Define cada una de las siguientes interacciones intermoleculares:
a) Ion – dipolo.
b) Dipolo – dipolo.
c) Ion – dipolo inducido.
d) Dipolo – dipolo inducido.
e) Dipolo instantáneo – dipolo inducido.
a) Interacción dónde hay fuerzas de atracción entre un ion (catión o anión) y
una molécula polar con momento dipolar permanente. La intensidad de ésta
depende de la carga y tamaño del ion, así como el momento dipolar y tamaño
de la molécula.
b) Interacción dónde se atraen moléculas polares mutuamente, entre mayor
momento dipolar, mayor la fuerza. Al ser un proceso electroestático se puede
explicar con la ley de Coulomb.
c) Interacción dónde un ion se acerca a una molécula y cambia la distribución
electrónica de este por la fuerza que ejerce al acercarse.
d) Es similar a la interacción ion-dipolo, solo que esta vez una molécula polar se
acerca a nuestra molécula y este es el culpable de la distorsión de su distribución
electrónica. Ambas interacciones dependen de la polarizabilidad (que tan fácil
es cambiar su distribución electrónica) de la molécula al que se le acerquen.
e) Interacción que se produce entre moléculas o átomos que no presentan
ninguna carga ni momento dipolar permanente, comúnmente se forma primero
un dipolo instantáneo para que posteriormente genere un dipolo inducido. Esto
genera fuerzas de dispersión las cuales explican la atracción entre moléculas no
polares.
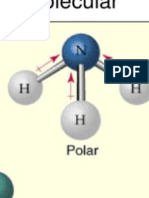
2.- ¿Cómo se determina la polaridad de una molécula?
El momento dipolar nos ayuda para determinar el grado de polaridad de
moléculas, se determina experimentalmente y depende de la magnitud de las
cargas y la distancia que las separa. Aunque para conocer teóricamente si una
molécula tiene momento dipolar o no, utilizamos las estructuras de Lewis de
manera en que obtenemos un vector resultante de la suma de momentos
dipolares o puede ser el caso en el que todos se cancelen, denotando que este
es igual a 0. Para conocer el momento dipolar de un enlace utilizamos la
expresión: 𝜇 = 𝑄 × 𝑟 donde Q es la magnitud de la carga y r la longitud entre
cargas, este valor es reportado la mayoría de las veces en Debye [C x m].
3.- Describe la interacción por puente de hidrógeno y menciona en qué tipos de moléculas (o casos)
se presenta.
Es un tipo de interacción fuerte de atracción dipolo-dipolo entre un átomo de
hidrógeno proveniente de un enlace polar y un átomo electronegativo de O, N
o F. Posteriormente se forman moléculas muy polares dónde un átomo de
hidrógeno tiene una carga positiva que puede acercarse fácilmente a la parte
negativa del dipolo cercano.
4.- Clasifica las siguientes especies como iónicas, polares o no polares:
a) Agua.
b) Etanol.
c) Hexano.
d) Amonio.
e) Benceno.
f) Éter etílico.
a) Polar
b) Polar
c) No polar
d) Iónica
e) No polar
f) Polar
5.- Indica el tipo de interacción que se manifiesta entre los siguientes pares de especies:
a) Agua – Etanol.
b) Hexano – Yodo.
c) Acetona – Éter etílico.
d) Benceno – Cloruro.
e) Acetona – Hexano.
f) Amonio – Etanol.
a) puente de hidrogeno
b) dipolo instantáneo-dipolo inducido
c) dipolo-dipolo
d) ion-dipolo inducido
e) dipolo-dipolo inducido
f) ion-dipolo
6.- Ordena las interacciones mencionadas en la pregunta anterior de mayor a menor fuerza de
interacción (únicamente coloca el inciso correspondiente. Ej. a) > d) > b), etc).
a)>f)>c)>d)>e)>b)
NOTA: Recuerda incluir bibliografía al final de este cuestionario.
Referencias bibliográficas
• Chang, R. (2010). Química. Mc. Graw Hill, Interamericana Editores, SA de CV
10ma. Edición. México.
• S/N. (2009). Unidad, Fuerzas intermoleculares. CDMX, México: Facultad de
Química UNAM. Recuperado de:
http://depa.fquim.unam.mx/amyd/archivero/pptEnlaceQuimico1_29101.pdf
• S/N. (2015). Fuerzas intermoleculares. CDMX, México: Facultad de Química
UNAM. Recuperado de:
http://depa.fquim.unam.mx/amyd/archivero/interaccionesintermoleculares_31777.p
df
También podría gustarte
- Práctica #5 Fuerzas IntermolecularesDocumento9 páginasPráctica #5 Fuerzas IntermolecularesEmmanuel Osorno CaroAún no hay calificaciones
- Antecedentes Práctica 2 Fuerzas Intermoleculares y Solubilidad PDFDocumento5 páginasAntecedentes Práctica 2 Fuerzas Intermoleculares y Solubilidad PDFKazuyaUedaTatsuyaAún no hay calificaciones
- Presiones Semana Tres Escuintla (16-07-2022)Documento6 páginasPresiones Semana Tres Escuintla (16-07-2022)AmbrosiaAún no hay calificaciones
- LQI-I - Tarea Previa 2 PDFDocumento3 páginasLQI-I - Tarea Previa 2 PDFArantxa EscobedoAún no hay calificaciones
- Seminario N°5 - Fuerzas Intermoleculares - Problemas ResueltosDocumento9 páginasSeminario N°5 - Fuerzas Intermoleculares - Problemas ResueltosPatricio AlmadaAún no hay calificaciones
- Guía Fuerzas IntermolecularesDocumento12 páginasGuía Fuerzas IntermolecularesPaulina Constenla SaideAún no hay calificaciones
- 01 - Interacciones MolecularesDocumento43 páginas01 - Interacciones MolecularesPAM LAZAROAún no hay calificaciones
- Material+Teórico +interaccioDocumento5 páginasMaterial+Teórico +interaccioJuan Ignacio RochaAún no hay calificaciones
- Prop FisicasDocumento11 páginasProp Fisicasnbbq4trtzgAún no hay calificaciones
- 07 - Clase Polaridad-FIDocumento51 páginas07 - Clase Polaridad-FINicolas MuñozAún no hay calificaciones
- 7 Fuerzas Intermoleculares.Documento25 páginas7 Fuerzas Intermoleculares.carlosmenAún no hay calificaciones
- 003 Fuerzas Del Estado Líquido y NaturalezaDocumento5 páginas003 Fuerzas Del Estado Líquido y NaturalezaXNX PATOAún no hay calificaciones
- Clase 6 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2015Documento34 páginasClase 6 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2015Feña Ibarra FuentesAún no hay calificaciones
- Fuerzas Intermoleculares 2310Documento39 páginasFuerzas Intermoleculares 2310carlos rodriguezAún no hay calificaciones
- Teorias Valencias Fuerzas Intermoleculares.Documento10 páginasTeorias Valencias Fuerzas Intermoleculares.Shirley BustamanteAún no hay calificaciones
- Fuerza Ion DipoloDocumento4 páginasFuerza Ion Dipolohugo montesAún no hay calificaciones
- Fuerzas IntermolecularesDocumento13 páginasFuerzas Intermoleculareserick joelAún no hay calificaciones
- Guía Fuerzas Intermoleculares PDFDocumento12 páginasGuía Fuerzas Intermoleculares PDFpalomaAún no hay calificaciones
- Fuerzas de LondonDocumento10 páginasFuerzas de Londonjesus adrianAún no hay calificaciones
- 4-2 Interacciones Moleculares NaturalezaDocumento16 páginas4-2 Interacciones Moleculares NaturalezaJorge Alfonso Patiño FlorezAún no hay calificaciones
- Presentación Unidad 4 - Fuerzas IntermolecularesDocumento21 páginasPresentación Unidad 4 - Fuerzas IntermolecularesLucas SabchezAún no hay calificaciones
- Clase 6 CB33 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2017Documento34 páginasClase 6 CB33 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2017luisAún no hay calificaciones
- 5 4-QuimicaDocumento3 páginas5 4-QuimicaSelene Vilca PoloAún no hay calificaciones
- Introducción A Las Fuerzas IntermolecularesDocumento5 páginasIntroducción A Las Fuerzas IntermolecularesMágicos OchentasAún no hay calificaciones
- Taller 1 CorteDocumento4 páginasTaller 1 CorteDavid UreñaAún no hay calificaciones
- Tensoactivos y EmulsionesDocumento37 páginasTensoactivos y EmulsionesGestión HumanaAún no hay calificaciones
- 12) Fuerzas IntermolecularesDocumento6 páginas12) Fuerzas Intermolecularessoledadfigueroa717Aún no hay calificaciones
- Antecedentes Práctica 2 Fuerzas Intermoleculares y Solubilidad PDFDocumento5 páginasAntecedentes Práctica 2 Fuerzas Intermoleculares y Solubilidad PDFKazuyaUedaTatsuyaAún no hay calificaciones
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS IntermolecularesLacochoncita LilitAún no hay calificaciones
- 4 Fuerzas IntermolecularesDocumento2 páginas4 Fuerzas IntermolecularesCami Arce GariAún no hay calificaciones
- Tarea1 ConstanteLeando 5420Documento4 páginasTarea1 ConstanteLeando 5420leandro constanteAún no hay calificaciones
- LiquidosDocumento67 páginasLiquidosAlfonso RodríguezAún no hay calificaciones
- Informe Líquidos Los Sólidos (Fuerzas Inter e Intramoleculares)Documento10 páginasInforme Líquidos Los Sólidos (Fuerzas Inter e Intramoleculares)HARRISON STEVE LIBERATO CASTROAún no hay calificaciones
- Fuerzas de Van Der WaalsDocumento11 páginasFuerzas de Van Der Waalsl23030197Aún no hay calificaciones
- Fuerzas IntermolecularesDocumento6 páginasFuerzas IntermolecularesJhoanaTapiaHAún no hay calificaciones
- QuimicaDocumento7 páginasQuimicaAngel Josafat Vidaña GarciaAún no hay calificaciones
- Quimica Monografia 2 Sin CaraDocumento7 páginasQuimica Monografia 2 Sin CaraDanna ValeeryAún no hay calificaciones
- Fuerzas IntermolecularesDocumento38 páginasFuerzas Intermolecularesmichael15201150% (2)
- Fuerza IntermolecularDocumento9 páginasFuerza IntermolecularOmar GaliciaAún no hay calificaciones
- Quà Mica I BQ UD 6 PDFDocumento58 páginasQuà Mica I BQ UD 6 PDFPaulaAún no hay calificaciones
- Química General Evaluación - SegundoDocumento22 páginasQuímica General Evaluación - SegundoJenny Amparo Gutierrez MartinezAún no hay calificaciones
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS IntermolecularesEduardo OrozcoAún no hay calificaciones
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS IntermolecularesDionyMilagrosAún no hay calificaciones
- Laboratorio #2 - Enlaces y Fuerzas de AtraccionDocumento11 páginasLaboratorio #2 - Enlaces y Fuerzas de AtraccionMaria Paula LuboAún no hay calificaciones
- Unidad 8fuerzas IntermolecularesDocumento30 páginasUnidad 8fuerzas IntermolecularesMaria Stella Avendaño HerreraAún no hay calificaciones
- Semana 5 Fuerzas Intermoleculares 2024-1Documento28 páginasSemana 5 Fuerzas Intermoleculares 2024-1PRINS JEREMY VILLEGAS JULCAAún no hay calificaciones
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS IntermolecularesKsaNova J Harold HrAún no hay calificaciones
- Enlaces QuimicosDocumento10 páginasEnlaces QuimicosAndres RangelAún no hay calificaciones
- Tema II - Estructura y Propiedades (2020)Documento37 páginasTema II - Estructura y Propiedades (2020)Mica CaceresAún no hay calificaciones
- Biofisica Carga ElectricaDocumento9 páginasBiofisica Carga ElectricaSharonmcAún no hay calificaciones
- Trabajo 3 Tecnologia de Los MaterialesDocumento5 páginasTrabajo 3 Tecnologia de Los MaterialesLeonardoAún no hay calificaciones
- Quimica OrganicaDocumento48 páginasQuimica OrganicaGabriel Berrios SantanderAún no hay calificaciones
- Practica de Laboratorio NDocumento5 páginasPractica de Laboratorio NLOGAN INMORTAL SSAún no hay calificaciones
- Actividad 2 Cambio de Fase y Fuerzas Intermoleculares BisDocumento6 páginasActividad 2 Cambio de Fase y Fuerzas Intermoleculares BisJosué ChimarroAún no hay calificaciones
- Tema II - Estructura y Propiedades (2016) PDFDocumento34 páginasTema II - Estructura y Propiedades (2016) PDFCamila EscobarAún no hay calificaciones
- Tema 4 EnlaceDocumento34 páginasTema 4 EnlaceEdna NaviaAún no hay calificaciones
- Practica Laboratorio 4 - Villafuerte Duran Brigith ClarisaDocumento14 páginasPractica Laboratorio 4 - Villafuerte Duran Brigith ClarisaClarisa Villafuerte DuranAún no hay calificaciones
- Qi, 1 4Documento12 páginasQi, 1 4Ale GonzalezAún no hay calificaciones
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Casopráctico2 UribeVegaDocumento5 páginasCasopráctico2 UribeVegaAxel Uribe VegaAún no hay calificaciones
- El Origen de Los Elementos en Tres Actos.Documento5 páginasEl Origen de Los Elementos en Tres Actos.Axel Uribe VegaAún no hay calificaciones
- Informe 1 LesQSDocumento5 páginasInforme 1 LesQSAxel Uribe VegaAún no hay calificaciones
- Curva de Calibración: Punto de Fusión Experimental Vs TeóricoDocumento2 páginasCurva de Calibración: Punto de Fusión Experimental Vs TeóricoAxel Uribe VegaAún no hay calificaciones
- Determinación de La Constante de ResistividadfqbrDocumento11 páginasDeterminación de La Constante de ResistividadfqbrAxel Uribe VegaAún no hay calificaciones
- Determinantes Slater PDFDocumento2 páginasDeterminantes Slater PDFAxel Uribe VegaAún no hay calificaciones
- Tipos de ViscosímetrosDocumento18 páginasTipos de ViscosímetrosJhonatan Meza AparicioAún no hay calificaciones
- Perfil de Proyecto de AsipoDocumento11 páginasPerfil de Proyecto de AsipoVilcazan Huayta JuanAún no hay calificaciones
- Ejercicios Resueltos Campo GravitatorioDocumento18 páginasEjercicios Resueltos Campo GravitatorioSara López-SerranoAún no hay calificaciones
- Guia 1 Dinamica 2018-0Documento10 páginasGuia 1 Dinamica 2018-0Ðiegø Luis Rojas0% (1)
- Actividad Ondas 11°Documento5 páginasActividad Ondas 11°MATEO CANTE GARZONAún no hay calificaciones
- Procesos IndustrialesDocumento7 páginasProcesos IndustrialesJosé Manuel Carvajal VásquezAún no hay calificaciones
- Estudio de CasosDocumento37 páginasEstudio de CasosSteven ParedezAún no hay calificaciones
- SEDIMENTACION Borrador 1Documento33 páginasSEDIMENTACION Borrador 1carlosAún no hay calificaciones
- Mario Bonilla Sarta - de - PerforacionDocumento48 páginasMario Bonilla Sarta - de - PerforacionRodrigo Bravo Rodrigo BravoAún no hay calificaciones
- Momentos de Inercia de Sólidos - PresentaciónDocumento43 páginasMomentos de Inercia de Sólidos - PresentaciónRosa Luz0% (1)
- FisicaDocumento5 páginasFisicaFranco SilvaAún no hay calificaciones
- Tema5 Electrotecnia PDFDocumento78 páginasTema5 Electrotecnia PDFgupazin75gmail100% (2)
- Teoría Básica de La Corriente ContinuaDocumento18 páginasTeoría Básica de La Corriente ContinuaAndrés Gregorio de las Heras YanzonAún no hay calificaciones
- Campo Electrico Distribuciones Continuas CargaDocumento9 páginasCampo Electrico Distribuciones Continuas CargaSebastian segoviaAún no hay calificaciones
- Expo - Half BridgeDocumento14 páginasExpo - Half BridgeMábelgAún no hay calificaciones
- 04 - Prueba MosfetDocumento41 páginas04 - Prueba MosfetMirgen MirandaAún no hay calificaciones
- Amortiguadas OscilacionesDocumento3 páginasAmortiguadas OscilacionesJean Franco RiveraAún no hay calificaciones
- Electricidad TallerDocumento6 páginasElectricidad TallerBreiner SerranoAún no hay calificaciones
- Activ3 Fisic10a 20200327130025Documento9 páginasActiv3 Fisic10a 20200327130025Reina Estrella100% (1)
- Analisis Del Transistor en CADocumento3 páginasAnalisis Del Transistor en CAJez HernandezAún no hay calificaciones
- Primera Practica Virtual Instalaciones ElectricasDocumento5 páginasPrimera Practica Virtual Instalaciones ElectricasCarlos YauriAún no hay calificaciones
- Control de Velocidad de Un Motor A.C MonofacicoDocumento14 páginasControl de Velocidad de Un Motor A.C Monofacicofloresnataniel100% (1)
- Dinámica de Fluidos Viscosos PDFDocumento23 páginasDinámica de Fluidos Viscosos PDFWilmer Castellanos FelipeAún no hay calificaciones
- Analogias Electricas PDFDocumento14 páginasAnalogias Electricas PDFFlor Barcia VeraAún no hay calificaciones
- 1° Ciencias Naturales 3 PeriodoDocumento37 páginas1° Ciencias Naturales 3 PeriodoJose HernandezAún no hay calificaciones
- Ejercicios de DinamicaDocumento8 páginasEjercicios de DinamicajhossueAún no hay calificaciones
- La INGENIERÍA para Analizar CIRCUITOS ELÉCTRICOS MECATRÓNICOS PDFDocumento158 páginasLa INGENIERÍA para Analizar CIRCUITOS ELÉCTRICOS MECATRÓNICOS PDFGustavo SuarezAún no hay calificaciones
- MasividadDocumento6 páginasMasividadPablo Andrés Sepúlveda MerinoAún no hay calificaciones