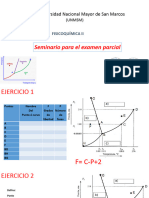
Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Homework L-V Non-Ideal Equilibria PDF
Cargado por
gina perezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Homework L-V Non-Ideal Equilibria PDF
Cargado por
gina perezCopyright:
Formatos disponibles
JAPM
Facultad de Ingeniería
Programa de Ingeniería Química
Termodinámica Química II
Taller de equilibrio de fase líquido-vapor y propiedades cologativas
Las siguientes actividades tienen como objetivo entender la importancia
del equilibrio de fases líquido-vapor no ideal. Además de comprender los
conceptos asociados y derivados del estudio termodinámico de este tipo
partícular de equilibrio, el cual es vital en la formación de Ingenieros
Químicos.
1. Los datos del equilibrio líquido-vapor del disulfuro de carbono CS 2
(A)-acetona C3H6O (B) a 35.17 °C se presentan en la tabla 1.
Calcular:
a) El coeficiente de actividad de cada sustancia utilizando la ley
de Raoult general.
b) El coeficiente de actividad utilizando la ley de Henry.
Tabla 1. Datos del equilibrio a 35.17 °C del disulfuro de carbono
CS2 (A)-acetona C3H6O (B)
PA [torr] 0.00 119.7 258.4 323.3 361.3 394.2 426.9 446.9 464.9 490.0 496.2 512.3
PB [torr] 344.5 327.8 295.4 275.2 262.1 247.6 227 207.7 180.2 120.3 85.9 0.00
XA 0.00 0.0670 0.1857 0.2761 0.3551 0.4530 0.6124 0.7220 0.8280 0.9242 0.9549 1.00
YA 0.00 0.2574 0.4666 0.5403 0.5795 0.6141 0.6529 0.6827 0.7207 0.8029 0.8523 1.00
2. Determinar los coeficientes de actividad utilizando el convenio I y
II para el sistema cloroformo (A) acetona (B) a 35.17 °C. En la
tabla 2 se presentan los datos del equilibrio líquido vapor del
sistema cloroformo (A) acetona (B).
Tabla 2. Datos del equilibrio líquido-vapor del sistema cloroformo
(A) acetona (B) a 35.17 °C.
PA [torr] 0.00 9.5 31.7 50.7 74.3 111.5 130.6 169.6 224.4 224.2 265.6 293.1
PB [torr] 344.5 322.6 276.3 240.9 197.9 144.2 118.8 79.2 37.5 38.4 13.9 0.00
XA 0.00 0.0603 0.1818 0.2657 0.3664 0.4930 0.5531 0.6610 0.7997 0.8047 0.9179 1.00
YA 0.00 0.0285 0.1029 0.1738 0.2729 0.4360 0.5237 0.6817 0.8566 0.8536 0.9500 1.00
3. Identificar que tipo de desviación de la ley de Raoult (positiva o
negativa) que le corresponde a el ejercicio 1 y 2. Se sugiere
realizar las gráficas de presión vs fracción molar y el diagrama de
fases binario. Explíque sus resultados.
Responda falso (F) o verdadero (V)
Suponga que una mezcla equimolar de benceno y tolueno a 80 °C se
calienta hasta 95 °C.
4. A 95 °C la fracción molar del benceno en la fase líquida y la fase
vapor es 0.42 y 0.63 respectivamente ( ).
JAPM
5. Con base en la regla de la palanca a 95 °C la cantidad relativa de
la fase vapor con respecto a la fase líquida es 0.615 ( ).
EQUIBRIO LÍQUIDO VAPOR
BENCENO-TOLUENO P=101.325KPa
115.0
110.0
105.0
100.0
95.0
T °C
90.0
85.0
80.0
75.0
0.000 0.100 0.200 0.300 0.400 0.500 0.600 0.700 0.800 0.900 1.000
X,Y
6. Deducción de las expresiones de las siguientes propiedades
coligativas:
a) Elevación del punto de ebullición.
b) Presión osmótica.
Nota
1. Las anteriores actividades son complementarias de la información
compartida en la plataforma SICVI-657 de la Universidad del
Atlántico. Los trabajos deben ser enviados al siguiente correo:
joseperez@mail.uniatlantico.edu.co
2. Los trabajos se deben realizar de manera individual para evitar la
reunión de estudiantes y la concurrencia de personas, de tal manera
que se pueda evitar el contagio de COVID-19 y, que la probabilidad
de adquirir dicha enfermedad sean bajas.
3. Fecha de entrega 20 de marzo antes de 12:00 meridiano hora
colombiana, los trabajos enviados desde las 12:01 pm serán
calificados con notas menores a 4.99 según la hora de entrega.
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Seminario Tema 4 2024Documento4 páginasSeminario Tema 4 2024miguembaeAún no hay calificaciones
- Curso Práctico de Química GeneralDe EverandCurso Práctico de Química GeneralCalificación: 4 de 5 estrellas4/5 (4)
- Taller Velocidad de ReaccionDocumento4 páginasTaller Velocidad de ReaccionJavier ClarosAún no hay calificaciones
- Flujo de fluidos e intercambio de calorDe EverandFlujo de fluidos e intercambio de calorCalificación: 1 de 5 estrellas1/5 (1)
- Guía 1. Equilibrio de FasesDocumento4 páginasGuía 1. Equilibrio de FasesLesly Conkolor0% (1)
- Guia Ejercicios QUI230Documento56 páginasGuia Ejercicios QUI230Manuel Curitol Piutrin0% (1)
- Formalismo y métodos de la termodinámica. Volumen 1De EverandFormalismo y métodos de la termodinámica. Volumen 1Aún no hay calificaciones
- Preguntas Tipo para El Examen Parcial de Fisicoquimica IIDocumento35 páginasPreguntas Tipo para El Examen Parcial de Fisicoquimica IIAyudaFIQ-SMAún no hay calificaciones
- Problemario Destilación PDFDocumento13 páginasProblemario Destilación PDFLiriamAún no hay calificaciones
- Sem Nº2 - Cinética Química - Leyes de Velocidad 2021Documento9 páginasSem Nº2 - Cinética Química - Leyes de Velocidad 2021Abi YamiAún no hay calificaciones
- Guía 1 - FlashDocumento11 páginasGuía 1 - FlashJuan ManuelAún no hay calificaciones
- Informe 2 - Determinación Propiedades Físicas - NTGDocumento6 páginasInforme 2 - Determinación Propiedades Físicas - NTGNelson Traña100% (1)
- 1386515402.seminario Nº4Documento3 páginas1386515402.seminario Nº4Soledad Taipe VallejosAún no hay calificaciones
- Cinética Química ProblemasDocumento23 páginasCinética Química ProblemasCarmen de TorresAún no hay calificaciones
- Taller FasesDocumento3 páginasTaller Faseslaura100% (1)
- Imprimir LizDocumento19 páginasImprimir LizChristian Mendez UtcaniAún no hay calificaciones
- Problemas de Cinética QuímicaDocumento4 páginasProblemas de Cinética QuímicajuanesoteAún no hay calificaciones
- Serie 2 2015 ADocumento4 páginasSerie 2 2015 ACristian ArámbulaAún no hay calificaciones
- ProblemarioET 2016ADocumento13 páginasProblemarioET 2016ADaniel MoralesAún no hay calificaciones
- Tercer Examen FisicoquimicaDocumento1 páginaTercer Examen FisicoquimicaErik victor Anchivilca ZavaletaAún no hay calificaciones
- Sistema Benceno ToluenoDocumento4 páginasSistema Benceno Toluenoanghelu50% (2)
- Discusion 2Documento8 páginasDiscusion 2Dee-Deecita ItiAún no hay calificaciones
- 1386515402.seminario Nº4Documento3 páginas1386515402.seminario Nº4Soledad Taipe VallejosAún no hay calificaciones
- Ing. Reacci N Qu Mica. Problemas Cin Tica Qu Mica AplicadaDocumento8 páginasIng. Reacci N Qu Mica. Problemas Cin Tica Qu Mica AplicadaMartinez KalelAún no hay calificaciones
- Problemas2 QA2017IDocumento4 páginasProblemas2 QA2017IAlexandra BarrigaAún no hay calificaciones
- Seminario de Cinetica QuimicaDocumento34 páginasSeminario de Cinetica QuimicaBriggit Gamarra Flores0% (1)
- Diagrama de FasesDocumento15 páginasDiagrama de FasesEl DOn100% (1)
- Serie Eq. Liq.-Vap. 18 - IIDocumento2 páginasSerie Eq. Liq.-Vap. 18 - IIjuan islasAún no hay calificaciones
- Post3 Termo2Documento10 páginasPost3 Termo2Valeria AlpucheAún no hay calificaciones
- Problemas Tema 1 QuifiDocumento3 páginasProblemas Tema 1 Quifimaritoreg12Aún no hay calificaciones
- Ejercicios 2° UnidadDocumento5 páginasEjercicios 2° UnidadNataly Verastegui CastañedaAún no hay calificaciones
- Serie N°3: Equilibrio de Fases CondensadasDocumento3 páginasSerie N°3: Equilibrio de Fases CondensadasValeska La GloriosaAún no hay calificaciones
- Tercer Parcial Termo IIDocumento3 páginasTercer Parcial Termo IIVíctor Hugo Castro TavaresAún no hay calificaciones
- Hoja de Ejercicios22 - 23Documento2 páginasHoja de Ejercicios22 - 23Carolina Caballero MedinaAún no hay calificaciones
- Tarea de Equilibrio de 2 ComponentesDocumento3 páginasTarea de Equilibrio de 2 ComponentesMaribel MamaniAún no hay calificaciones
- Trabajo Autónomo 1 SolucionesDocumento23 páginasTrabajo Autónomo 1 SolucionesMikaela RivadeneiraAún no hay calificaciones
- Propiedades ColigativasDocumento13 páginasPropiedades Coligativasbrendads89100% (6)
- 2 Disoluciones Ideales Reales EjerciciosDocumento7 páginas2 Disoluciones Ideales Reales Ejerciciososkarg4420Aún no hay calificaciones
- FisicoquímicaDocumento3 páginasFisicoquímicaLuis RodríguezAún no hay calificaciones
- Serie Equilibrio de FasesDocumento2 páginasSerie Equilibrio de FasesSteven Rodríguez Fabián0% (1)
- Informe 4. Equilibrio Sólido-Líquido EutécticoDocumento5 páginasInforme 4. Equilibrio Sólido-Líquido EutécticoAstrid BallenAún no hay calificaciones
- aRELACIÃ - N DE PROBLEMAS 2023-24 - DESTILACIÃ - NDocumento9 páginasaRELACIÃ - N DE PROBLEMAS 2023-24 - DESTILACIÃ - NpachimolAún no hay calificaciones
- Serie Equilibrio FasesDocumento9 páginasSerie Equilibrio FasesReza Alcivar SaulAún no hay calificaciones
- TALLER No 2Documento4 páginasTALLER No 2Cristian DiazAún no hay calificaciones
- IR2 - Deber 2 - Datos Del Reactor BatchDocumento3 páginasIR2 - Deber 2 - Datos Del Reactor BatchSteven MenaAún no hay calificaciones
- Taller Fases 2018 PDFDocumento4 páginasTaller Fases 2018 PDFÁngelAún no hay calificaciones
- SEIDER Product and Process Design PriDocumento30 páginasSEIDER Product and Process Design PriGersonHarrimanAún no hay calificaciones
- Guia Cinética IDocumento4 páginasGuia Cinética IGiuliana valenzuelaAún no hay calificaciones
- Recovered Word 5Documento12 páginasRecovered Word 5Elvis Caballero TocasAún no hay calificaciones
- Cinetica Química EjerciciosDocumento8 páginasCinetica Química EjerciciosJose LozanoAún no hay calificaciones
- Informe 04 Fisicoquimica IIDocumento16 páginasInforme 04 Fisicoquimica IILucía Molina RamírezAún no hay calificaciones
- Guia de Ejercicios de Cinetica Química (Ceing 2021)Documento8 páginasGuia de Ejercicios de Cinetica Química (Ceing 2021)jose jimenezAún no hay calificaciones
- 2datos Del Simulador de ProiiDocumento9 páginas2datos Del Simulador de Proiipolamorales115Aún no hay calificaciones
- Problemas de Destilacion FlashDocumento4 páginasProblemas de Destilacion FlashDivita ArandaAún no hay calificaciones
- Discusion 2Documento8 páginasDiscusion 2Luis Enrique100% (1)
- Exemple 2 Reactor BATCH NaOH Acetato de EtiloDocumento11 páginasExemple 2 Reactor BATCH NaOH Acetato de Etilokatrina SamirAún no hay calificaciones
- Equilibrio Líquido-VaporDocumento16 páginasEquilibrio Líquido-VaporrborbollavAún no hay calificaciones
- Tomo IiDocumento196 páginasTomo IiAbraham Juarez LuisAún no hay calificaciones
- Como El Guia Escapa de Los Brazos Del Protagonista Obsesionado 1Documento299 páginasComo El Guia Escapa de Los Brazos Del Protagonista Obsesionado 1mddgrcvAún no hay calificaciones
- Cuadro Comparativo Grecia y Roma (Angel Domínguez OrozcoDocumento2 páginasCuadro Comparativo Grecia y Roma (Angel Domínguez OrozcoAngel Dominguez50% (2)
- Diario - 2 6 22Documento12 páginasDiario - 2 6 22FernandoAún no hay calificaciones
- Envase Pet Ámbar 60 MLDocumento3 páginasEnvase Pet Ámbar 60 MLDavid CampuésAún no hay calificaciones
- 678343963.búsqueda y Recuperación Del Sujeto A Lo Largo de Algunos Desarrollos Semióticos PDFDocumento11 páginas678343963.búsqueda y Recuperación Del Sujeto A Lo Largo de Algunos Desarrollos Semióticos PDFLuis GómezAún no hay calificaciones
- Planificamos ActividadesDocumento4 páginasPlanificamos Actividadeszulmy guerreroAún no hay calificaciones
- S07. s1. Tarea Académica Diálogo Entre Autores.Documento7 páginasS07. s1. Tarea Académica Diálogo Entre Autores.Luis David ChafloqueAún no hay calificaciones
- SEPU-MC-04 Calculo de Barra de 10 KVDocumento3 páginasSEPU-MC-04 Calculo de Barra de 10 KVErika Buenalaya CangalayaAún no hay calificaciones
- Guia de RadioDocumento17 páginasGuia de RadioJiskah BastiAún no hay calificaciones
- Evaluación Del Estado de Salud Del Árbol de Bonga PDFDocumento22 páginasEvaluación Del Estado de Salud Del Árbol de Bonga PDFVeronica BrownAún no hay calificaciones
- Los Libros CanonicosDocumento22 páginasLos Libros Canonicosmalcantara81Aún no hay calificaciones
- Anexo 3.3 - Instructivo Manejo Adecuado de Desechos - Lic. Gabriela EspinozaDocumento27 páginasAnexo 3.3 - Instructivo Manejo Adecuado de Desechos - Lic. Gabriela EspinozaCarmen RivasAún no hay calificaciones
- Clase 6 - Microbiología PeriodontalDocumento23 páginasClase 6 - Microbiología PeriodontalDominic SalgadoAún no hay calificaciones
- Ciudadania Principio de Igualdad en La Constitución Del EcuadorDocumento4 páginasCiudadania Principio de Igualdad en La Constitución Del EcuadorMateoTrujilloAún no hay calificaciones
- Seguridad Informática AvanzadaDocumento2 páginasSeguridad Informática AvanzadaRonald GuerreroAún no hay calificaciones
- Google MapsDocumento31 páginasGoogle MapsJosé lenin López Pérez 3AAún no hay calificaciones
- LORENA PLESNICAR (2013) - Los y Las Jovenes en El Discurso de Los Anos 1980 de La UnescoDocumento17 páginasLORENA PLESNICAR (2013) - Los y Las Jovenes en El Discurso de Los Anos 1980 de La UnescoFelipe TobarAún no hay calificaciones
- Anexo 2 Tarea 3Documento2 páginasAnexo 2 Tarea 3kata morenoAún no hay calificaciones
- Cuestionario Inicial 4 Laboratorio de Fundamentos de Mecánica FES AragonDocumento8 páginasCuestionario Inicial 4 Laboratorio de Fundamentos de Mecánica FES AragonJosué González MacíasAún no hay calificaciones
- Definicion de ConcentracionDocumento5 páginasDefinicion de ConcentracionJorge Eddy Chacacanta CondoAún no hay calificaciones
- Licitacion Publica Grupo 1Documento44 páginasLicitacion Publica Grupo 1Alexandra Ramos RojasAún no hay calificaciones
- Ideas para Traer Invitados A Mi Casa de PazDocumento2 páginasIdeas para Traer Invitados A Mi Casa de PazgustavoduranAún no hay calificaciones
- Proyecto Terminal de Titulacion Ricardo Francisco Hernandez AcevesDocumento396 páginasProyecto Terminal de Titulacion Ricardo Francisco Hernandez Acevesbrandin100% (1)
- HEGEL InformeDocumento4 páginasHEGEL InformehugoAún no hay calificaciones
- La Tesis de Juegos LudicosDocumento52 páginasLa Tesis de Juegos LudicosHenry PalmaAún no hay calificaciones
- Guia Comunicacion Sena III 2021 DECIMODocumento6 páginasGuia Comunicacion Sena III 2021 DECIMOdavid juian diaz manriqueAún no hay calificaciones
- RFID FinalDocumento23 páginasRFID FinalGro Gro100% (1)
- Funciones y Modelos MatemáticosDocumento25 páginasFunciones y Modelos MatemáticosMario LAún no hay calificaciones
- Unidos para Complacerla - Stasia BlackDocumento437 páginasUnidos para Complacerla - Stasia BlackMica Bredael100% (4)
- Predimensionado de Una Losa de Un TableroDocumento15 páginasPredimensionado de Una Losa de Un TablerojosefoofAún no hay calificaciones
- Recupera tu mente, reconquista tu vidaDe EverandRecupera tu mente, reconquista tu vidaCalificación: 5 de 5 estrellas5/5 (6)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (64)
- Psicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaDe EverandPsicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaCalificación: 4.5 de 5 estrellas4.5/5 (766)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (202)
- Resetea tu mente. Descubre de lo que eres capazDe EverandResetea tu mente. Descubre de lo que eres capazCalificación: 5 de 5 estrellas5/5 (196)
- Tus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadDe EverandTus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadCalificación: 4.5 de 5 estrellas4.5/5 (1831)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaDe EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaCalificación: 5 de 5 estrellas5/5 (1871)
- El poder del optimismo: Herramientas para vivir de forma más positivaDe EverandEl poder del optimismo: Herramientas para vivir de forma más positivaCalificación: 5 de 5 estrellas5/5 (16)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaDe EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaCalificación: 5 de 5 estrellas5/5 (2)
- Yo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)De EverandYo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)Calificación: 5 de 5 estrellas5/5 (7)
- No desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaDe EverandNo desperdicies tus emociones: Cómo lo que sientes te acerca a Dios y le da gloriaCalificación: 5 de 5 estrellas5/5 (13)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Una mente en calma: Técnicas para manejar los pensamientos intrusivosDe EverandUna mente en calma: Técnicas para manejar los pensamientos intrusivosCalificación: 4.5 de 5 estrellas4.5/5 (142)
- Las Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishDe EverandLas Cinco Leyes Biológicas De La Naturaleza: La Nueva Medicina (Color Edition) SpanishCalificación: 4.5 de 5 estrellas4.5/5 (3)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Cómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.De EverandCómo Acertar en tu Nueva Relación de Pareja: Todas las claves para saber si tu relación tiene futuro... o te conviene salir corriendo de ahí.Calificación: 4.5 de 5 estrellas4.5/5 (7)
- ¿Por qué mis padres no me aman?: Empezando a sanarDe Everand¿Por qué mis padres no me aman?: Empezando a sanarCalificación: 4.5 de 5 estrellas4.5/5 (33)
- Teoría polivagal práctica y terapiaDe EverandTeoría polivagal práctica y terapiaCalificación: 5 de 5 estrellas5/5 (4)
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Influencia. La psicología de la persuasiónDe EverandInfluencia. La psicología de la persuasiónCalificación: 4.5 de 5 estrellas4.5/5 (14)
- Libro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRADe EverandLibro de Trabajo DE LA TERAPIA DE ACEPTACIÓN Y COMPROMISO (ACT). UNA GUÍA COMPLETA PARA CAMBIAR EL MINDFULNESS Y RECUPERARSE DE LA ANSIEDAD, LA DEPRESIÓN, LOS ATAQUES DE PÁNICO Y LA IRACalificación: 4 de 5 estrellas4/5 (26)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- La violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaDe EverandLa violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaCalificación: 4 de 5 estrellas4/5 (2)