Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Analisis Fisico y Organoléptico de Muestra de Agua
Analisis Fisico y Organoléptico de Muestra de Agua
Cargado por
German Aldayr Caro FongDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Analisis Fisico y Organoléptico de Muestra de Agua
Analisis Fisico y Organoléptico de Muestra de Agua
Cargado por
German Aldayr Caro FongCopyright:
Formatos disponibles
LABORATORIO DE QUÍMICA ORGÁNICA
DETERMINACIÓN DEL PUNTO DE EBULLICIÓN DE UNA SUSTANCIA ORGÁNICA.
DOCENTE: ING. CLAUDIA HERRERA H.
1- Objetivo
Determinar la temperatura de ebullición de algunos líquidos puros y analizar su relación con el
grupo funcional o el tamaño de la molécula.
2- Marco teórico
Temperatura de ebullición
La temperatura de ebullición es aquella a la cual la presión de vapor del líquido es igual a la
presión externa. En este punto, el vapor no solamente proviene de la superficie sino que
también se forma en el interior del líquido produciendo burbujas y turbulencia que es
característica de la ebullición. La temperatura de ebullición permanece constante hasta que
todo el líquido se haya evaporado.
El punto de ebullición que se mide cuando la presión externa es de 1 atm se denomina
temperatura normal de ebullición y se sobreentiende que los valores que aparecen en las tablas
son puntos normales de ebullición.
3 - Materiales y equipo
Glicerina o agua como medios de calentamiento, Termómetro, Beaker de 100 ml, tubo de
ensayo, Capilares, Soporte universal, pinzas para tubo de ensayo, tapón de caucho, Mechero,
fósforos y bandas de caucho o hilo de coser y muestras problema.
4- Procedimiento
A un tubo de ensayo se añaden 2 ó 3 ml del líquido problema, se introduce un capilar sellado
por uno de sus extremos de modo que el extremo abierto toque el fondo del tubo y luego se
adiciona el termómetro. El sistema se coloca en un baño de glicerina o de agua dependiendo
del punto de ebullición que se vaya a medir, tal como se ilustra en la figura 1.
Figura 1. Montaje para la temperatura de ebullición
Se calienta gradualmente hasta que del capilar se desprenda un rosario continuo de burbujas.
En seguida se suspende el calentamiento y en el instante en que el líquido entre por el capilar se
lee la temperatura de ebullición.
5- Resultados
Anotar en la tabla 1 los datos obtenidos en el experimento y completar los otros datos de la
literatura.
Tabla 1. Temperaturas de ebullición
Teb normal Teb , °C
Reactivo Polaridad
°C (laboratorio)
6- Preguntas de análisis
6.1- ¿Por qué la temperatura de ebullición se mide justo cuando el líquido asciende por el
interior del capilar?. Explique.
6.2 ¿Qué relación existe entre el punto de ebullición y el número de carbonos en una función
química específica? (Tenga en cuenta el grupo funcional de las sustancias problema asignadas)
6.3- Investigue qué son sustancias polares y no polares. ¿Qué relación tiene la polaridad con el
punto de ebullición?
6.4- Cuando una o dos gotitas de un líquido muy volátil se colocan sobre la piel y se dejan
evaporar, se experimenta una sensación de enfriamiento. ¿Por qué?
6.5- Tome los datos obtenidos por los otros grupos y grafique los puntos de ebullición
(Temperatura en °C) vs cantidad de carbonos. ¿Cómo se puede interpretar la tendencia
de la gráfica?
También podría gustarte
- Ley de Enfriamiento de NewtonDocumento7 páginasLey de Enfriamiento de NewtonbrayanAún no hay calificaciones
- Problemario 1Documento3 páginasProblemario 1JorgeAún no hay calificaciones
- Hoja de Vida Blainer de Jesus Lara PerezDocumento3 páginasHoja de Vida Blainer de Jesus Lara Perezluis carlosAún no hay calificaciones
- Plan de Trabajo de Ciencia de Los Materiales 2020Documento2 páginasPlan de Trabajo de Ciencia de Los Materiales 2020luis carlosAún no hay calificaciones
- Informe 1 Alistamiento y Uso de La Estacion Metorologica y Rosa de Vientos 3Documento10 páginasInforme 1 Alistamiento y Uso de La Estacion Metorologica y Rosa de Vientos 3luis carlosAún no hay calificaciones
- Informe Tecnico Calidad de AireDocumento72 páginasInforme Tecnico Calidad de Aireluis carlos0% (1)
- Informe de Estacion Meteorologica y Rosa de Los Vientos.Documento9 páginasInforme de Estacion Meteorologica y Rosa de Los Vientos.luis carlosAún no hay calificaciones
- NOx y SOxDocumento13 páginasNOx y SOxluis carlosAún no hay calificaciones
- 8vo Informe - Incidencia Del Gradiente de Velocidad en La Floculacion KariDocumento10 páginas8vo Informe - Incidencia Del Gradiente de Velocidad en La Floculacion Kariluis carlosAún no hay calificaciones
- Taller - Ejercicios LLuvia EscorrentíaDocumento1 páginaTaller - Ejercicios LLuvia Escorrentíaluis carlosAún no hay calificaciones
- Pa3 Ingeniería Electrica 2023Documento19 páginasPa3 Ingeniería Electrica 202370111811Aún no hay calificaciones
- D-3 Mandos FinalesDocumento41 páginasD-3 Mandos FinalesLuis Angel Vargas AlburquequeAún no hay calificaciones
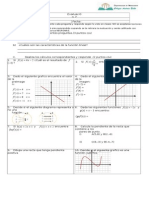
- Evaluacion 2 Funcion Lineal y AfinveroDocumento4 páginasEvaluacion 2 Funcion Lineal y AfinveromtabustosAún no hay calificaciones
- MÓDULO CARLA Ecuaciones PDFDocumento2 páginasMÓDULO CARLA Ecuaciones PDFItalo Jesus Cabrera CalderonAún no hay calificaciones
- Resumen Analisis Del MovimientoDocumento11 páginasResumen Analisis Del MovimientoAriadna SalzmanAún no hay calificaciones
- Líneas de TransmisiónDocumento21 páginasLíneas de TransmisiónCristian Kevin Rojas JaramilloAún no hay calificaciones
- Acido FosforicoDocumento8 páginasAcido FosforicoJuan King Rojas AlvarezAún no hay calificaciones
- Teoría de GrafosDocumento13 páginasTeoría de GrafosCarlos Ninaja GutierrezAún no hay calificaciones
- Metodo Hardy CroossDocumento5 páginasMetodo Hardy CroossFercho SaucedoAún no hay calificaciones
- Propiedades Del Concreto FrescoDocumento14 páginasPropiedades Del Concreto Frescolayalme100% (1)
- GM-04 Guia Metodologica Calculo Del Sistema de Puesta A TierraDocumento57 páginasGM-04 Guia Metodologica Calculo Del Sistema de Puesta A TierraFreddy GomezAún no hay calificaciones
- Estudio Del Desarrollo Del Niño MeeceDocumento24 páginasEstudio Del Desarrollo Del Niño MeeceJuanis Martinez CarbajalAún no hay calificaciones
- REOLOGIADocumento15 páginasREOLOGIAAlvaro JhovannyAún no hay calificaciones
- Documento Modificacion ClimaDocumento326 páginasDocumento Modificacion Climamonica310189100% (1)
- Analisis PseudotridimensionalDocumento9 páginasAnalisis Pseudotridimensionaljorge.jimenez100% (1)
- Actividad 2 Investigación de Las Leyes de Reflexión y RefracciónDocumento5 páginasActividad 2 Investigación de Las Leyes de Reflexión y RefracciónYAUDIEL DE JESUS HERNANDEZ HERNANDEZAún no hay calificaciones
- Monografia Alta TensionDocumento56 páginasMonografia Alta TensionVictor Bouroncle100% (2)
- Cartas Psicrométricas FelderDocumento2 páginasCartas Psicrométricas FelderRaul SalgadoAún no hay calificaciones
- Qué Es El Número AtómicoDocumento4 páginasQué Es El Número AtómicoYohana CPAún no hay calificaciones
- Motrocidad en El NiñoDocumento0 páginasMotrocidad en El NiñoMartin RownsAún no hay calificaciones
- Calculo y Dibujo de Una Triangulacion-Logo-Upn-FelixgarciaDocumento28 páginasCalculo y Dibujo de Una Triangulacion-Logo-Upn-FelixgarciaGuillermo Luque PampamallcoAún no hay calificaciones
- Máquinas de Corriente Alterna Simétrica Trifásica ResumenDocumento10 páginasMáquinas de Corriente Alterna Simétrica Trifásica ResumenPivan Hernández ArmijoAún no hay calificaciones
- Ácido AspárticoDocumento6 páginasÁcido AspárticoAngelaGabrielaSanchezLopezAún no hay calificaciones
- Cap 4 Conductos CerradosDocumento17 páginasCap 4 Conductos CerradosMaría Fernanda Ortiz EcheverríaAún no hay calificaciones
- Problemas de Física Iv Unidad IDocumento3 páginasProblemas de Física Iv Unidad IOlenka MorenoAún no hay calificaciones
- INV 172-E-07 y INV 161-E-07Documento21 páginasINV 172-E-07 y INV 161-E-07Angélica RincónAún no hay calificaciones
- BarografoDocumento8 páginasBarografoYeimy MontesinoAún no hay calificaciones
- AgregadosDocumento65 páginasAgregadosRossenia Coaguila OviedoAún no hay calificaciones