Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Tarea 2. Electroquímica PDF
Tarea 2. Electroquímica PDF
Cargado por
Salvador Zúñiga0 calificaciones0% encontró este documento útil (0 votos)
14 vistas1 páginaTítulo original
Tarea 2. Electroquímica.pdf
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
14 vistas1 páginaTarea 2. Electroquímica PDF
Tarea 2. Electroquímica PDF
Cargado por
Salvador ZúñigaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
Electroquímica y corrosión.
Ejercicios de tarea
Realice los siguiente ejercicios, determinando lo que se solicita, incluya la metodología
detallada que realizó para la correcta solución.
1. Para calibrar una celda de conductividad, se utiliza una solución de cloruro de
potasio estándar 0.01 M cuya conductividad molar es 140.84x10-4 sm2mol-1,
obteniéndose una resistencia de 1.35576 Ohm. En un ensayo posterior a la misma
celda se introduce una solución de ácido acético de concentración 0.001 M y se
determina una resistencia de 1175.0446 Ohm. El área efectiva de los electrodos es
0.785398 m2.
a. Determine el valor de la constante de la celda, así como la distancia efectiva entre
los electrodos.
b. Determine el grado de disociación del ácido acético y el valor de su pKa.
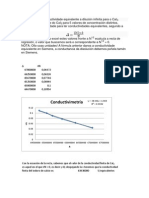
2. Se ha de determinar la conductividad molar a dilución infinita de para el bromuro
de litio. Para ello se calibra la celda de conductividad con una solución estándar de
cloruro de potasio 0.1 M de conductividad molar 112.856 Scm 2mol-1 registrándose
una resistencia de 0.0886 Ohm. Posteriormente se ingresan una serie de soluciones
de bromuro de litio y se obtienen los siguientes resultados:
C (mol/L) 0.001 0.003 0.005 0.007 0.009 0.02
R (Ω) 10.5463 4.1574 2.8531 2.3077 2.0268 1.9703
a. Calcule la constante de la celda.
b. Obtenga el valor de la conductividad molar a dilución infinita.
3. En la celda de problema anterior se estudia la resistencia de una serie de soluciones
de ácido bromoacético, obteniendo los siguientes resultados:
C (mol/L) 0.00001 0.0001 0.0009 0.001 0.005 0.009 0.01
R (Ω) 832.2195 232.0186 74.3716 70.4831 31.1993 23.2052 22.0075
a. Determine el valor de la conductividad molar límite.
b. Calcule el valor del pKa del ácido y compárelo con el reportado en literatura.
c. Calcule el grado de disociación a cada concentración.
También podría gustarte
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- PC PDFDocumento2 páginasPC PDFBrandonAún no hay calificaciones
- Guia de Ejercicios CompletaDocumento10 páginasGuia de Ejercicios CompletaSTEPHANIE SANCHEZ CASTRILLON0% (1)
- Lista de Problemas Segundo Parcial.Documento3 páginasLista de Problemas Segundo Parcial.Julio ToledoAún no hay calificaciones
- PRACTICA 2 CONDUCTIVIDAD DE SOLUCIONES ELECTROLITICAS-1 AdalidDocumento9 páginasPRACTICA 2 CONDUCTIVIDAD DE SOLUCIONES ELECTROLITICAS-1 AdalidJoel ArismendiAún no hay calificaciones
- Serie 1 ElectroquimicaDocumento2 páginasSerie 1 ElectroquimicaGuillermo Martinez MoruaAún no hay calificaciones
- Ejercicios Soluciones Elec.Documento11 páginasEjercicios Soluciones Elec.ValeriaAún no hay calificaciones
- G5.II-Conductividad y Cinética ElectroquímicaDocumento3 páginasG5.II-Conductividad y Cinética Electroquímicamariasolruiz1984Aún no hay calificaciones
- Problemas TecnicasDocumento8 páginasProblemas TecnicasAsd SdfAún no hay calificaciones
- Practica 2do Parcial PDFDocumento4 páginasPractica 2do Parcial PDFmary kely chambi choqueAún no hay calificaciones
- ElectrolisisDocumento1 páginaElectrolisisscarlay gutierrezAún no hay calificaciones
- P-3 EltqmcDocumento3 páginasP-3 EltqmcMercedes PinedoAún no hay calificaciones
- Seminarios 1 A 4Documento7 páginasSeminarios 1 A 4populus1234Aún no hay calificaciones
- ProblemasDocumento2 páginasProblemasdaniaAún no hay calificaciones
- Serie 1 2020-2 Ma-JueDocumento2 páginasSerie 1 2020-2 Ma-JueJesús Yair Ramirez VillalobosAún no hay calificaciones
- Química Básica G1 - Rev1Documento3 páginasQuímica Básica G1 - Rev1Jose Luis Alva JulcaAún no hay calificaciones
- Serie 9 PDFDocumento1 páginaSerie 9 PDFViviana AndreaAún no hay calificaciones
- Ejercicios Tema7Documento9 páginasEjercicios Tema7Ximena AcAún no hay calificaciones
- Taller 5Documento3 páginasTaller 5jhonathan100% (1)
- ConductimetriaDocumento22 páginasConductimetriaJorge Llerena Arroyo100% (1)
- Conductividad EléctricaDocumento23 páginasConductividad EléctricaMiluska PumalequeAún no hay calificaciones
- Conductometr à ADocumento1 páginaConductometr à A5qkxnjxsxfAún no hay calificaciones
- Ejercicios Electroquímica-Material ComplementarioDocumento6 páginasEjercicios Electroquímica-Material ComplementarioMIRIAM MEJIA DIAZ0% (1)
- Aplicación de Medidas Conductimétricas en La Determinación de Variables Fisicoquímicas para Diferentes ElectrolitosDocumento8 páginasAplicación de Medidas Conductimétricas en La Determinación de Variables Fisicoquímicas para Diferentes ElectrolitosNahomi CordobaAún no hay calificaciones
- Problemas Disoluciones+CineticaDocumento4 páginasProblemas Disoluciones+CineticahumanAún no hay calificaciones
- Examen Parcial 1, 20-2. Conduct., Coulomb. y Voltamperometría.Documento9 páginasExamen Parcial 1, 20-2. Conduct., Coulomb. y Voltamperometría.Marisol CGAún no hay calificaciones
- ElectroquimicaDocumento2 páginasElectroquimicaDaphne Merino NúñezAún no hay calificaciones
- Ejercicios 2Documento2 páginasEjercicios 2Jose Antonio VazquezAún no hay calificaciones
- Conductivímetria-Carlos CarballoDocumento2 páginasConductivímetria-Carlos CarballoCarlos Carballo RodriguezAún no hay calificaciones
- Ejercicios de Evaluación INEVALDocumento5 páginasEjercicios de Evaluación INEVALManuelvillafuerte100% (1)
- Idoc - Pub Problemas Resueltos 2 ExamenDocumento13 páginasIdoc - Pub Problemas Resueltos 2 ExamenSteicy PerezAún no hay calificaciones
- ProblemasDocumento15 páginasProblemasCarmen Williana Moncada QuinteroAún no hay calificaciones
- Problemas Resueltos 2 ExamenDocumento13 páginasProblemas Resueltos 2 Examenronald2682Aún no hay calificaciones
- CONDUCTIMETRÍA Análisis de FármacosDocumento2 páginasCONDUCTIMETRÍA Análisis de FármacosjuanAún no hay calificaciones
- Guia de Problemas de ElectroquímicaDocumento3 páginasGuia de Problemas de ElectroquímicaMaría Argomedo ReyesAún no hay calificaciones
- Ejercicios de IonesDocumento5 páginasEjercicios de IonesGraielita100% (1)
- PRACTICA 2electroq LabDocumento10 páginasPRACTICA 2electroq LabWilma Yola MamaniAún no hay calificaciones
- Conductividad Tema N # 2-1Documento16 páginasConductividad Tema N # 2-1ydleyaganiso7Aún no hay calificaciones
- Seminario 2 Redox 2021Documento3 páginasSeminario 2 Redox 2021gaAún no hay calificaciones
- Labo 5 FicoDocumento8 páginasLabo 5 FicoGuillermo de la CruzAún no hay calificaciones
- Serie de Problemas de Conductividad Iónica y ElectrólisisDocumento4 páginasSerie de Problemas de Conductividad Iónica y ElectrólisisJosue Hernandez MrkzAún no hay calificaciones
- Ejercicios para El Taller de La Práctica Calificada 02: FisicoquímicaDocumento5 páginasEjercicios para El Taller de La Práctica Calificada 02: FisicoquímicaEdgard ChavzAún no hay calificaciones
- Ejercicios Listis Por MiDocumento3 páginasEjercicios Listis Por MiBluenoxyp666Aún no hay calificaciones
- QM-2512 Tarea 1Documento2 páginasQM-2512 Tarea 1Johan RojasAún no hay calificaciones
- Conductividad de Las Soluciones ElectroliticasDocumento15 páginasConductividad de Las Soluciones ElectroliticasAbigail Ancasi LauraAún no hay calificaciones
- Guía de 1º - RecuperaciónDocumento9 páginasGuía de 1º - RecuperaciónJesús Marcos Segura MartínAún no hay calificaciones
- Captura 2022-12-13 A Las 21.03.59Documento8 páginasCaptura 2022-12-13 A Las 21.03.59irenekitty6Aún no hay calificaciones
- Problemas Reacciones Bimoleculares PDFDocumento5 páginasProblemas Reacciones Bimoleculares PDFDanielle Domingueez0% (1)
- Guía de Problemas Complementaria 2Documento3 páginasGuía de Problemas Complementaria 2Froilan Taipe QuiritaAún no hay calificaciones
- Ejercicios PolímerosDocumento9 páginasEjercicios PolímerosAstrid AngelAún no hay calificaciones
- Manual de Practicas Electrometalurgía2015-1Documento15 páginasManual de Practicas Electrometalurgía2015-1Carlos Alberto Soto RamirezAún no hay calificaciones
- Discusion 2Documento8 páginasDiscusion 2Dee-Deecita ItiAún no hay calificaciones
- Química Analítica Instrumental 01 2019 IDocumento23 páginasQuímica Analítica Instrumental 01 2019 IAlex valdezAún no hay calificaciones
- Segundo Examen Parcial QMC 1400Documento1 páginaSegundo Examen Parcial QMC 1400Harold Cesar Gabriel HerreraAún no hay calificaciones
- Microsoft Word - Repartido N 1 Transporte Ionico 2010Documento4 páginasMicrosoft Word - Repartido N 1 Transporte Ionico 2010Santiago MedinaAún no hay calificaciones
- Ejercicios de Principios de Análisis Químico KPS, Complejos, Electroquímica II 2020Documento1 páginaEjercicios de Principios de Análisis Químico KPS, Complejos, Electroquímica II 2020sofiaAún no hay calificaciones
- Electroquimica InformeDocumento13 páginasElectroquimica InformeUlises Ramírez MatheyAún no hay calificaciones
- Informe MezclaDocumento22 páginasInforme MezclaPaola DoğranmışAún no hay calificaciones
- Ejercicios 3Documento3 páginasEjercicios 3Jose Antonio VazquezAún no hay calificaciones
- Trabajos de RaptorDocumento4 páginasTrabajos de RaptorSalvador ZúñigaAún no hay calificaciones
- Informe 8 Bombas en Serie y en Paralelo CompletoDocumento22 páginasInforme 8 Bombas en Serie y en Paralelo CompletoSalvador Zúñiga100% (1)
- Inv. Prev. Cis Transimprimir PDFDocumento7 páginasInv. Prev. Cis Transimprimir PDFSalvador ZúñigaAún no hay calificaciones
- ¿Quién Fue Clavado en El Madero? Yahshua Hanotzri V'Melej HayehudimDocumento4 páginas¿Quién Fue Clavado en El Madero? Yahshua Hanotzri V'Melej HayehudimSalvador Zúñiga100% (1)
- 1421 08 Fisica OndasDocumento6 páginas1421 08 Fisica OndasSalvador ZúñigaAún no hay calificaciones
- Investigacion Previa Alquenos y AlquinosDocumento7 páginasInvestigacion Previa Alquenos y AlquinosSalvador ZúñigaAún no hay calificaciones
- Serie 2 Electroquímica PDFDocumento2 páginasSerie 2 Electroquímica PDFSalvador ZúñigaAún no hay calificaciones
- Manual Area ElectroquimicaDocumento74 páginasManual Area ElectroquimicaSalvador ZúñigaAún no hay calificaciones
- Tarea Celdas ElectroquímicasDocumento2 páginasTarea Celdas ElectroquímicasSalvador ZúñigaAún no hay calificaciones
- Tarea Celdas Electroquímicas PDFDocumento2 páginasTarea Celdas Electroquímicas PDFSalvador ZúñigaAún no hay calificaciones
- Serie 5 Balance de Materia y EnergíaDocumento5 páginasSerie 5 Balance de Materia y EnergíaSalvador ZúñigaAún no hay calificaciones
- P Ka'sDocumento6 páginasP Ka'sSalvador ZúñigaAún no hay calificaciones
- Informe Experimental No.4Documento1 páginaInforme Experimental No.4Salvador ZúñigaAún no hay calificaciones
- Catalogo PQM 2014 r3c BDocumento98 páginasCatalogo PQM 2014 r3c BSalvador ZúñigaAún no hay calificaciones