Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Guias Micro Tps y Seminario
Cargado por
Lujana RomanoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Guias Micro Tps y Seminario
Cargado por
Lujana RomanoCopyright:
Formatos disponibles
Microbiologa de Alimentos
2011
GUA DE TRABAJOS PRCTICOS Y
SEMINARIOS
FACULTAD DE CIENCIAS EXACTAS Y NATURALES
UNIVERSIDAD NACIONAL DE MAR DEL PLATA
Microbiologa de Alimentos
Trabajo Prctico N 1: Anlisis microbiolgico de aguas de consumo
Toma de muestra
Cantidad no inferior a 150 ml, en frasco estril, no deben estar completamente llenos, de
manera de poder agitar su contenido.
a) Muestra de agua de canilla: Abrir la canilla y dejar correr el agua 2 3 min., cerrar,
limpiar con un algodn embebido en alcohol y flamear a fondo la abertura de salida. Dejar
correr el agua unos segundos ms y llenar el frasco con un chorro dbil para evitar
salpicaduras. Tapar y enviar al laboratorio.
b) Muestra de pozo: Hacer funcionar la bomba durante 5 min. Esterilizar la boca de
salida de agua. Dejar funcionar 5 min. ms y tomar la muestra.
Transporte y conservacin
El transporte debe efectuarse lo ms pronto posible. Si no se realiza el anlisis antes de 1
hora, refrigerar la muestra.
No debern transcurrir ms de 10 horas entre la toma de muestra y el envo al laboratorio.
Recuento en placa
Da una estimacin del nmero de bacterias aerobias y anaerobias facul-tativas,
heterotrficas presentes en el agua.
Tcnica: 1 ml del agua en examen (pipeta estril) se coloca en placa de Petri estril. Luego
se aade medio de cultivo: agar para recuento en placa o agar tripticase soja o plate count
agar (PCA) fundido y enfriado a 40-45 C. Mezclar por rotacin, dejar so-lidificar e
invertir las placas. Incubar a 32-35 C durante 48 horas.
Contar las colonias desarrolladas con ayuda de lupa o cuenta colonias. Se elegirn las
placas que tengan entre 30 y 300 colonias y se informa el nmero de unidades formadoras
de colonias por ml de muestra (UFC/ml)
Si la muestra est muy contaminada, hacer diluciones. En este caso multiplicar el nmero
de colonias por la inversa de la dilucin,
Ej. : Dilucin 10
-1
= valor ledo 45 colonias
n de UFC/ ml = 45 x 10 = 450
Lmite: 500 UFC / ml. Se aconseja una nueva toma de muestra.
Recuento de bacterias coliformes totales
Tcnica del nmero ms probable (NMP)
El grupo coliforme comprende todas las bacterias de forma bacilar, aerobias y anaerobias
facultativas, no esporuladas, que fermenten lactosa con formacin de gas dentro de las 48
horas, a 32-35C.
El NMP no es una real enumeracin de bacterias sino una estimacin basada sobre
frmulas estadsticas de probabilidad.
Ensayo presuntivo
El caldo que se va a utilizar vara segn los mtodos: caldo lauril triptosa (APHA), caldo
Mac Conkey (Ministerio de Salud Britnico) o caldo lactosa bilis verde brillante 2 %.
Se siembra una serie de 3 5 tubos de caldo doble concentracin, que contienen 10 ml de
medio, provistos de campanitas Durham, con porciones de 10 ml de muestra.
Se siembran luego 2 series de 3 5 tubos conteniendo 5ml de caldo simple concentracin,
con 1 ml y 0.1ml respectivamente, incubar 24-48 horas, a 35C.
Los tubos que presentan formacin de gas y viraje del indicador o enturbia-miento se
consideran positivos, y a partir de ellos se lee el NMP en tablas.
Ensayo completo: Test de Mackenzie
De cada uno de los tubos positivos del ensayo presuntivo, sembrar un tubo de caldo lactosa
bilis verde brillante (CLBVB) o de EC (segn APHA) y un tubo de agua triptona para
indol. El primer tubo se incuba a 44-44.5 C, 24 horas y el agua triptona a 37 C. Si se hace
de un solo tubo de los que dieron positivo el test presuntivo, se informa contiene o no
contiene coliformes fecales.
Se puede determinar tambin el NMP de coliformes fecales sembrando en CLBVB toda la
serie de tubos e incubando a 44,5 C, 24 horas. Se anota el N de tubos positivos y se
busca el NMP en la tabla.
Investigacin de Pseudomonas aeruginosa
Se siembra una porcin de 50 ml de muestra (agua o soda) en un erlenmeyer que contiene
50 ml de caldo nutritivo doble concentracin (para evitar la dilucin de las sustancias
nutritivas). Se incuba a 37 C, durante 24 horas y luego 4 5 das ms, a temperatura
ambiente, agitando cada tanto para mejorar la aerobiosis, lo cual favorece el crecimiento
de esta bacteria.
Si da positivo al cumplirse el tiempo de incubacin aparece un pigmento verde azulado
difusible en el medio.
Si da negativo, puede aparecer turbiedad o no, pero no se observa ninguna coloracin
verdosa. Se informa entonces ausencia de P. aeruginosa en 50 ml de muestra.
Si se presume la presencia del microorganismo, se realizan ensayos confirmatorios
sembrando en medios especficos.
Agar cetrimida: Se repica en este medio por estriado, y se incuba a 41.5C 0.5C,
durante 48 hs.; Pseudomona aeruginosa aparece como colonias incoloras hasta amarillento
parduzco. A veces forma pigmento en este medio.
Agar P para Pseudomonas: Este medio estimula la formacin del pigmento piocianina
(azul verdoso), siendo esta prueba muy importante porque P. aeruginosa es la nica del
gnero que forma piocianina. Tambin forma pioverdina que es un pigmento amarillo
verdoso fluorescente, pero ste es tambin formado por otras Pseudomonas.
En agar P se incuba 48 horas y hasta 1 semana a 37C. Se producen colonias azul verdoso,
verde o rojo, hasta pardo. El pigmento verde azulado difunde en el medio.
Extraccin del pigmento: La piocianina caracterstica de Pseudomona aeruginosa, es
soluble en cloroformo, mientras que los otros pigmentos como fluorescena son solubles
en agua. Del caldo sembrado inicialmente, tomar una alcuota (2 ml) o directamente
pigmento proveniente del medio P, al que se le agrega el cloroformo (1 ml), se pasa a un
tubo de ensayo, se agita y se dejan separar las dos capas. Piocianina pasar a la fase
clorofrmica dando un tinte azul-verdoso.
Caldo acetamida: Se inocula con un cultivo puro y se incuba durante 24-36 horas a 35-
37C. P.aeruginosa produce NH
3
a partir de la acetamida, alcalinizando el medio.
Preparar simultneamente un blanco, es decir, un tubo que contiene el medio sin sembrar e
incubar en las mismas condiciones.
Prueba de la oxidasa: Pseudomonas aeruginosa es oxidasa positiva.
Reactivo: Oxalato o clorhidrato de tetrametil-parafenilen-diamina.
La prueba se realiza habitualmente por dos mtodos: 1) la tcnica directa en placa, en la
cual se aaden 2 o 3 gotas de reactivo directamente sobre las colonias aisladas que se
desarrollan en el agar, y 2) el procedimiento indirecto con tiras de papel, en el cual se
aaden unas gotas de reactivo a las tiras de papel de papel de filtro y luego con un ansa de
acero una porcin de colonia se dispersa sobre el papel impregnado con el reactivo.
Interpretacin: Las colonias que posean actividad oxidasa desarrollan un color azul oscuro
en el sitio de inoculacin en el trmino de 10 seg.
Microbiologa de Alimentos
Trabajo Prctico N 2: DESCRIPCIN DE LA MORFOLOGA
MACROSCPICA Y MICROSCPICA DE MICROORGANISMOS
Introduccin
La TINCIN DE GRAM es la tincin diferencial ms utilizada en Bacteriologa pues
permite separar las bacterias en dos grandes grupos, las Gram positivas y las Gram-
negativas. Otro tipo de tincin, muy utilizada, es la tincin simple, que se utiliza para
observar las distintas formas que presentan los microorganismos.
Las bacterias se presentan con una morfologa definida que est determinada por su
pared rgida. Se pueden presentar como esfricas, ovaladas, denominndose cocos. Si la
forma es cilndrica se denominan bacilos o bastones. Estos bastones pueden ser rectos,
curvos o con forma de espiral, en este ltimo caso les llamamos espirilos. Las clulas
bacterianas pueden mantenerse unidas en grupos despus de que se han dividido, pero
conservando siempre la independencia una clula de otra. Cocos o bacilos pueden
agruparse en cadenas, en el caso de los cocos, cuando se presentan as agrupados, se
denominan estreptococos. Tambin se pueden presentar como diplococos. Si los
planos de divisin son variados pueden agruparse en ttradas o como racimos,
denominndose estafilococos. Los bacilos pueden ser muy cortos, recibiendo el nombre
de cocobacilos, otras veces pueden ser muy largos, Los extremos pueden ser
redondeados o rectos, pueden presentarse aislados, en largas cadenas o pueden
agruparse en empalizadas.
Objetivos
Reconocer macroscpicamente las clases de desarrollo bacteriano en medios
slidos y lquidos.
Aprender sobre el uso correcto del microscopio ptico.
Clasificar a las bacterias en Gram positivas y Gram negativas.
Identificar microscpicamente morfologas bacterianas empleando diferentes
tcnicas de coloracin.
Observacin Macroscpica
Observacin del crecimiento de cepas provenientes de diversos ambientes sobre
placas de agar para recuento en placa (PCA).
Descripcin del crecimiento en medio lquido.
En los medios lquidos las bacterias presentan los siguientes tipos de desarrollo:
- Anillo
- Pelcula superficial
- Turbidez uniforme
- Floculoso ( formacin de cogulo)
- Sedimento en el fondo
Observacin Microscpica
El microscopio
Los microscopios se clasifican en pticos y electrnicos. El microscopio ptico
compuesto es aquel que dispone de dos o ms lentes de aumento. Este tipo de
microscopio est formado bsicamente por una parte mecnica y una parte ptica y es
capaz de conseguir aumentos considerablemente mayores que el microscopio
construido con una sola lente. Este ltimo, llamado microscopio simple, se usa
principalmente en el formato de lupa. Durante el desarrollo del trabajo prctico se
trabajara con microscopios compuestos y se abordaran los aspectos bsicos con
respecto a la utilizacin, funcin y mantenimiento del equipamiento.
Frotis
Se denomina frotis a la extensin que se realiza sobre un portaobjetos de una muestra o
cultivo con objeto de separar lo ms posible los microorganismos, ya que si aparecen
agrupados en la preparacin es muy difcil obtener una imagen clara y ntida. Este frotis
debe ser posteriormente fijado al vidrio del portaobjetos para poder aplicar los mtodos
habituales de tincin que permiten la observacin al microscopio de las bacterias sin
que la muestra sea arrastrada en los sucesivos lavados.
Realizacin del frotis
Colocar una pequea gota de agua en el centro de un portaobjetos limpio. Es
necesaria muy poca cantidad de agua, por lo que se puede usar el ansa de
siembra, ya que en el extremo curvo de su filamento queda retenida una
mnima gota de agua, que resulta suficiente.
Flamear el ansa de siembra, tomar, en condiciones aspticas, una pequea
cantidad del cultivo bacteriano en medio slido y transferirlo a la gota de
agua. Remover la mezcla con el ansa de siembra hasta formar una
suspensin homognea que quede bastante extendida para facilitar su
secado.
Si la muestra se toma de un cultivo en medio lquido, no es necesario
realizar los dos primeros pasos ya que basta con colocar y extender una gota
de la suspensin bacteriana, que se toma con el ansa de siembra,
directamente sobre el portaobjetos.
Esperar hasta que el lquido se evapore.
Fijacin
La fijacin de una extensin bacteriana hace que las bacterias queden inactivadas y
adheridas al vidrio alterando lo menos posible la morfologa y bacteriana y las posibles
agrupaciones de clulas que pudiera haber. El objetivo de la fijacin es coagular el
protoplasma celular y adherirlo al portaobjetos.
Fijacin de las bacterias al portaobjetos
Por calor: Pasar tres veces el portaobjetos con el extendido hacia arriba dos o
tres veces por la llama durante unos segundos. Dejar enfriar antes de colorear.
Con metanol (para bacterias procedentes de medio lquido). Aadir unas gotas
de metanol sobre la extensin completamente seca. Golpear el portaobjetos por
su canto con cuidado contra la mesa de trabajo para retirar de inmediato el
exceso de metanol. Esperar a que el metanol se evapore completamente.
Una vez realizado el frotis y fijadas las bacterias, las preparaciones pueden ser
observadas al microscopio, aunque carecen de contraste. Lo normal es continuar con el
proceso de tincin.
Coloraciones
Coloracin simple
La TINCIN SIMPLE es la tincin en que se utiliza un solo colorante. Como
colorantes utilizaremos el azul de metileno o la safranina, ambos de naturaleza bsica.
La tcnica es la siguiente:
1. Hacer el frotis, secarlo y fijarlo.
2. Cubrir con colorante la preparacin y dejarlo actuar durante un minuto.
3. Lavar suavemente con agua destilada para eliminar el exceso de colorante.
4. Secar al aire y observar al microscopio con el objetivo de inmersin (100x)
empleando el aceite apropiado.
Esta tcnica permite observar la morfologa y tamao de las bacterias, as como los
tipos de agrupaciones que forman.
Bacilos no esporulados: Se tien uniformemente de rosa
Bacilos esporulados: El bacilo se tie de rosa con una zona ovoide (central,
subterminal o terminal, correspondiente a la espora) sin colorear.
Coloracin de GRAM
La tincin de Gram requiere cuatro soluciones:
1. Primer colorante. Es un colorante bsico que en contacto con las clulas
cargadas negativamente, reacciona con ellas colorendolas. El ms utilizado es
el cristal violeta.
2. Solucin mordiente. Fija las tinciones y aumenta la afinidad entre el colorante
y las clulas. Los mordientes empleados suelen ser sales metlicas, cidos o
bases, como, por ejemplo, una solucin diluida de yodo.
3. Agente decolorante. Es un disolvente orgnico, por ejemplo, alcohol-acetona
4. Colorante de contraste. Es un colorante bsico de distinto color que el primer
colorante, como, por ejemplo, la safranina. Los dos grupos bacterianos a los que
anteriormente nos referamos difieren en el color con el que finalmente
aparecen. Las bacterias Gram positivas se teirn de azul por el cristal violeta y
no perdern esta coloracin durante los pasos sucesivos. Las bacterias Gram
negativas perdern la coloracin inicial del cristal violeta en los siguientes pasos
y se teirn de rosa debido a la safranina. La diferencia est determinada por la
composicin de su PARED CELULAR. Estas paredes en las Gram + son
gruesas y qumicamente simples, compuestas principalmente de protenas y
mucopptidos (peptidoglicano o murena). El alcohol causa la deshidratacin de
la pared celular Gram +, reduciendo la perdida de sustancias tales como el
cristal violeta. La pared en las Gram es fina y compleja, conteniendo
protenas, mucopptidos y lpidos. Cuando es tratada con alcohol se disuelven
los lpidos y la coloracin primaria es eliminada.
El mtodo de tincin es el siguiente:
1. Se prepara el frotis, se seca y se fija.
2. Se cubre con cristal violeta durante 30 segundos.
3. Lavar suavemente con agua destilada durante 10 segundos para eliminar el
exceso de colorante.
4. Se traza con lugol 30 segundos. El lugol acta como mordiente aumentando la
afinidad del colorante por la bacteria.
5. Lavar con agua el exceso de lugol.
6. Se gotea alcohol-acetona de forma continua hasta que la preparacin deje de
perder color (aproximadamente 30 segundos) y se lava enseguida con agua
abundante.
7. Se cubre la preparacin con un colorante de contraste, como la safranina,
durante 30 segundos.
8. Se lava con agua y se seca al aire, observndose a continuacin con el objetivo
de inmersin.
Observacin de las tinciones de bacterias al microscopio
Las bacterias Gram-positivas presentarn una coloracin violeta mientras que las Gram-
negativas la presentarn roja o rosa. La identificacin de las bacterias Gram-positivas
puede ser problemtica, solamente cuando las bacterias Gram positivas se encuentran
en crecimiento exponencial (cultivos jvenes) la reaccin es clara; en fase estacionaria
(cultivos viejos) las bacterias Gram-positivas pueden parecer Gram-negativas.
Microbiologa de los Alimentos
Trabajo Prctico N3: Microscopa de Hongos
Objetivo
Identificar macroscpica y microscpicamente las caractersticas fundamentales de
distintos gneros de hongos
Introduccin
Los hongos son pequeos organismos productores de esporas, generalmente
microscpicos, eucariticos, ramificados y a menudo filamentosos que carecen de
clorofila y que tienen paredes celulares que contienen quitina, celulosa, o ambos
componentes. Aunque algunos hongos incluyendo las levaduras son unicelulares, la
mayora de las especies estn compuestas por masas de filamentos cenocticos o
septados multicelulares (Fig.1). Un filamento se llama hifa y todas las hifas de un
organismo se denominan micelio. La parte visible de la mayora de los hongos solo
representan una porcin del individuo y generalmente corresponden a hifas fuertemente
compactadas especializadas para la produccin de esporas denominadas cuerpo de
fructificacin.
La forma ms comn de reproduccin asexual que presentan los hongos es por medio
de esporas, las cuales varan dependiendo la especie. Las esporas formadas
asexualmente pueden estar contenidas en esporangios (Fig.2) a veces apoyadas sobre
un esporangioforo; o se producen de diversos modos en extremidades de hifas y
entonces se llaman conidios. Los hongos tambin pueden reproducirse de forma sexual
de diferentes maneras.
Fig.1: A-Hifa cenoctica B-Hifa septada Fig.2: Estructuras de reproduccin asexual
Materiales
Placas de Petri con desarrollos de hongos filamentosos y levaduriformes
crecidos en medio de cultivo slido.
Preparados semipermanentes de diferentes hongos, montados para observacin
de su micromorfologa.
Procedimiento
a) Descripcin morfolgica de colonias fngicas
Observar distintas colonias fngicas ya desarrolladas en los medios de cultivo
apropiados. Describir sus caractersticas morfolgicas como color, forma, aspecto,
consistencia, etc. como parte del estudio taxonmico de un hongo.
b) Observacin microscpica de micelio y esporas.
Preparacin tradicional
A diferencia de la coloracin para bacterias donde es necesario fijar y colorear el
preparado para poder visualizar las clulas de los microorganismos, los hongos y
levaduras son lo suficientemente grandes para poder visualizarlos en fresco, es
decir, sin calentamiento y sin colorantes.
1. Colocar una gota de agua o de lactofenol en un portaobjetos y depositar una
porcin de la colonia con ayuda de un ansa
2. Cubrir el preparado con un cubreobjetos.
3. Observar microscpicamente (con objetivos de 10x y 40x) desarrollos
vegetativos de hongos levaduriformes y filamentosos.
4. Relacionar las caractersticas microscpicas con la macromorfologa que
presentan las colonias fngicas con la ayuda de las figuras anexas.
Preparacin en cinta adhesiva
1. Colocar sobre un portaobjetos una gota de solucin de lactofenol no
demasiado grande, para evitar que el cubreobjetos flote y la preparacin
quede demasiado gruesa.
2. Cortar un trozo de cinta adhesiva transparente de aproximadamente 2cm.
3. Tocar con el lado adhesivo de la cinta el borde de una colonia de hongo de
un cultivo. En la zona central de una colonia puede haber una excesiva
concentracin de esporas.
4. Pegar la cinta adhesiva sobre la gota del portaobjetos.
5. Eliminar el colorante sobrante con un papel de filtro.
CARACTERSTICAS MORFOLOGICAS DE COLONIAS FNGICAS
COLOR
ANVERSO
REVERSO produccin de pigmento difusible
SUPERFICIE
LISA
ACUMINADA
CRATERIFORME
RADIADA
UMBILICADA
CEREBRIFORME 3
BORDE
LISO
RADIADO
FESTONEADO
LOBULADO
CONSISTENCIA
BLANDA
FILANTE
ADHERENTE
LEOSA
ASPECTO
CREMOSO
YESOSO
CEREBRIFORME
ALGODONOSO
AFELPADO
ATERCIOPELADO
DESARROLLO
POBRE
REGULAR
ABUNDANTE
Bibliografa
ADAMS, M.R. y M.O. MOSS, 1995. Microbiologa de los alimentos. Ed. The royal
society of chemistry, Cambridge CB4 4WF
ALEXOPOULUS, C.J., MIMS, C. W. y M. BLACKWELL., 1996. Introductory
mycology. Ed. Jhon Wiley & Sons, Inc. U.S.A
CURTIS, H. y N. S. BARNES.1993. Biologa. Ed. Panamericana. Buenos Aires,
Argentina
PASCUAL ANDERSON, M.del R. y V. Caldern Pascual, 2000 Microbiologa
Alimentaria. Ed. Daz de Santos. Madrid, Espaa.
Microbiologa de Alimentos
Trabajo Prctico N 4: Pruebas de identificacin de organismos coliformes. IMVyC
Esta determinacin comprende cuatro pruebas bioqumicas:
i) indol,
ii) rojo de metilo,
iii) Voges - Proskauer,
iv) citrato.
i) Prueba de Indol
Se emplea para determinar la capacidad de un microorganismo de desdoblar el indol de la
molcula de triptofano.
Ayuda a la diferenciacin entre los gneros Edwardsiella (+) de Salmonella (-); Escherichia
coli (por lo general +) del grupo Klebsiella- Enterobacter (por lo general -).
Reactivos
caldo de triptofano (caldo de triptona). Se prepara como indica el prospecto. Se
distribuye en tubos conteniendo un volmen aproximado de 4 ml. Se esteriliza.
Reactivo de Erlich
Eter etlico
Variante del anterior: Reactivo de Kovacs.
Mtodo
1. Realizar un inculo liviano de un cultivo puro (colonia aislada) de 18-24 hs.
2. Incubar a 35C 24 a 48 hs.
3. Con reactivo de Erlich: agregar 1 ml de ter a un tubo de caldo y esperar a que el eter
ascienda a la superficie. Agregar suavemente 0,5 ml del reactivo por las paredes del
tubo.
4. Con reactivo de Kovacs: agregar 5 gotas del reactivo a un tubo de caldo. Agitar
suavemente.
5. Con cualquiera de los reactivos: se considera como indol (+) una coloracin
roja o rojo-cereza.
ii) Prueba de Rojo de Metilo
Se utiliza para comprobar la capacidad de un organismo de producir y mantener estables los
productos terminales cidos de la fermentacin de la glucosa, y vencer la capacidad
amortiguadora del sistema. Por otra parte es una prueba cualitativa de la produccin de cido
(determinacin del pH); algunos microorganismos producen ms cido que otros.
Ayuda a la diferenciacin de los gneros Escherichia coli (+) del Enterobacter aergenes (-),
Enterobacter cloacae (-) y Klebsiella (-).
Reactivos
Medio RM-VP (Clark y Lubs) pH 6,9. Se prepara de acuerdo al prospecto. Se
distribuye en tubos (unos 5 ml) y se esteriliza.
Solucin de rojo de mtodo.
Mtodo
1. Realizar un inculo liviano picando la misma colonia que en el caso anterior
2. Incubar 48 hs a 35C.
3. Agregar 5 gotas del indicador rojo de metilo. RM positivo: color rojo; RM
negativo: color amarillo.
iii) Reaccin de Voges - Proskauer
Se emplea para determinar la capacidad de algunos microorganismos de producir un
producto final neutro, el acetilmetilcarbinol (acetona), a partir de la fermentacin de la
glucosa.
Ayuda a la diferenciacin entre los gneros Klebisella pneumoniae (+) Enterobacter
(generalmente +) de Escherichia coli (-).
Reactivos
Medio RM-VP (Clark y Lubs) pH 6,9. Se prepara de acuerdo a prospecto. Se
distribuye en tubos (unos 5 ml) y se esteriliza.
alfa-naftol 5%
KOH 40% (o NaOH en su defecto)
Mtodo
1. Picar la misma colonia que en las pruebas anteriores y sembrarla en el caldo
2. Incubar 48 hs a 35C.
3. Agregar 0,6 ml de la solucin de alfa-naftol
4. Luego, 0,2 ml de la solucin de KOH
5. Agitar el tubo suavemente. Dejar reposar. VP (+): coloracin rosada a rojo intenso.
Nota: Otra forma de realizar las pruebas de RM y VP es partir de un tubo inoculad en la
condiciones anteriores y dividir el volmen en dos. Para ello se pasa mediante una pipeta
estril 2,5 ml de medio a un tubo tambin estril. Una de las alicuotas se emplea para RM y la
otra para VP.
iv) Prueba de Citrato
Determinar si un organismo es capaz de utilizar citrato como nica fuente de carbono
para el metabolismo, provocando alcalinidad.
Ayudar a diferenciar entre los gneros Edwardsiella (-) de Salmonella (+); grupos Klebsiella-
Enterobacter (por lo general +) de Escherichia coli (-).
Reactivos
Agar citrato de Simmons. Se prepara de acuerdo al prospecto. Se distribuye en
tubos (unos 4 ml). Se esteriliza. An caliente se los inclina para que
solidifiquen en "pico de flauta".
Mtodo
1. Se pica la misma colonia que en las pruebas anteriores.
2. Se siembra por estra en la superficie del medio.
3. Se incuba 48 hs a 35C. Citrato (+): el medio vira al azul de Prusia; Citrato (-): el
medio queda del color original (verde).
INDOL
Positivo: Rojo Negativo: Amarillento
E. coli
Edwardsiella
Proteus (puede dar negativo)
Yersinieae (puede dar negativo
Enterobacter
Klebsiella
Citrobacter (puede dar positivo)
Arizona
Salmonella
R.M.
Positivo: De anaranjado a rojo Negativo: De anaranjado a amarillo
E. coli
Citrobacter
Edwardsiella
Salmonella
Proteus
Yersinieae
Enterobacter aerogenes
Enterobacter cloacae y otros.
Klebsiella
V.P.
Positivo: rojo Negativo: permanece amarillo o salmn
E. aerogenes
E. cloacae y otros
Klebsiella
E. coli
Citrobacter
Edwardsiella
Salmonella
Proteus
Yersinieae
CITRATO
Positivo: azul Negativo: Permanece verde
Citrobacter
Enterobacter
Arizona
Klebsiella
Serratia y otros.
E. coli
Edwardsiella
Yersiniaeae
Microbiologa de Alimentos
Trabajo Prctico N5: Anlisis microbiolgico de leches y helados
Tratamiento de la muestra de leche
Agitar perfectamente la muestra antes de proceder a la apertura del envase, lo cual debe
efectuarse aspticamente y con instrumental estril.
Recoleccin, transporte y tratamiento de la muestra de helados
Si se trata de helados industriales envasados, se toma directamente la unidad de venta en su
envase original.
Para helados de venta al mostrador, si se desea tener informacin sobre las condiciones de
elaboracin, se quita la capa superficial con una esptula estril y luego con otra esptula estril se
toma una muestra de ms de 60 g que se coloca en un contenedor tambin estril. Si se desea tener
informacin del helado que se sirve al consumidor la muestra se toma de la capa superficial y con
el mismo utensilio que usa el vendedor.
Las muestras deben transportarse refrigeradas y mantenerse a temperaturas inferiores a los -
15 C hasta el momento de su anlisis.
Cuando se va a realizar el mismo, las muestras se dejan a temperatura ambiente durante un
lapso mximo de una hora para que se fundan. Tambin pueden fundirse sumergiendo el
contenedor en un bao de agua a 42 - 45 C durante no ms de 15 minutos.
Los anlisis deben realizarse sobre una base gravimtrica, ya que el peso de 10 ml de helado
puede oscilar entre 4,5 y 10,5 g.
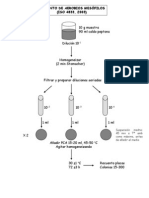
Preparacin de las diluciones
Medir 10 ml de la muestra de leche (o 10 g de la muestra de helado) con una pipeta estril
de 10 ml y verterlos en un erlenmeyer que contenga 90 ml del lquido diluyente. Se rota el
erlenmeyer para homogeneizar. Se obtiene asi una dilucin de 10
-1
Se toma 1 ml de esta dilucin (pipeta estril) y se pasa a un tubo que contiene 9 ml de diluyente
(dilucin 10
-2
). Se mezcla el contenido del tubo aspirando y dejando escurrir unas diez veces. Se
repite la operacin tomando 1 ml de este ltimo tubo y pasndolo a otro tubo con 9 ml de
diluyente, se obtiene una dilucin de 10
-3
.
Recuento de bacterias aerobias mesfilas totales
Se toma con una pipeta estril de 1 ml, 1 ml de la solucin 10
-3
y se transfiere a una cpsula
de Petri estril. Se vierte luego el medio de cultivo (agar para recuento o agar triptena soja)
previamente fundido y enfriado a 45 C. Se incuba a 32-35 C durante 48-72 hs. Se cuentan las
colonias.
Recuento de bacterias coliformes viables
Se toma 1 ml de la disolucin 10
-1
y se transfiere a una cpsula de Petri estril. Se vierte
luego el medio (agar cristal violeta-rojo neutro-bilis). Una vez solidificado se aaden otros 5 ml
de mismo medio (capa virgen). Se incuba a 32-35 C durante 24 hs. Se cuentan las colonias (entre
30 y 300 por placa)
Deteccin de coliformes fecales
Se toman 10 ml de la dilucin 10
-1
y se vierten en un tubo que contiene 10 ml de caldo
doble concentracin de lactosa-verde brillante-bilis o caldo Mac Conkey. Se incuba 32-35 C
durante 24-48 hs. Los presuntos tubos positivos deben confirmarse resembrando con ansa en el
mismo medio en simple concentracin e incubando a 44
0.5 C para coliformes fecales. Se
determina as presencia o ausencia de ellos en 1 g.
Investigacin de Staphylococcus aureus
La placa de Petri se prepara previamente colocando en ella 0.5 ml de solucin de telurito de
potasio al 0.2 % p/v, 0.5 ml de emulsin de yema de huevo y 10 ml del medio base fundido y
enfriado a unos 40 C. Se homogeiniza bien y de deja solidificar.
Se toman 0,1 ml de la dilucin 10
-1
y se transfieren a la caja de Petri ya preparada con el
medio de Baird-Parker; se extiende el inculo con una varilla de vidrio acodada estril o con una
esptula de Drigalsky. Se incuba a 37 C durante 24 - 48 hs.
Si aparecen colonias caractersticas de St. aureus (1-1,5 mm de dimetro, negras, convexas,
brillantes, rodeadas de halo claro que se extiende 2-5 mm y la aparicin de anillos opacos dentro
del halo, no visibles antes de las 48 horas) se repican en caldo cerebro-corazn. Se incuba a 37 C
durante 18-24 hs. Se realiza la prueba de la coagulasa.
Se colocan 0,5 ml de plasma (heparinizado o con EDTA) humano o de conejo en dos tubos
de ensayo pequeos. El primero se emplea de testigo y al segundo se le aaden 0,5 ml del cultivo
de 18 - 24 hs. Se incuban a 37 C durante 4 hs, observando cada hora y luego a temperatura
ambiente durante 24 hs, observando a distintos intervalos de tiempo.
La aparicin de grumos o cogulos indica que la cepa es coagulasa positiva. El testigo no
debe coagular. Observar las caractersticas del cogulo a fin de establecer si es francamente
positiva o no.
Recuento de mohos y levaduras (solo para helados)
Se toma 1 ml de la dilucin 10
-1
y se transfiere a una caja de Petri estril. Se vierte luego el
medio (YGC: agar extracto de levadura-glucosa-cloramfenicol). Se incuba a 22-25 C durante 3 a 5
das. Se cuentan las colonias.
Investigacin de la flora acidolctica
La determinacin se efecta para leche cruda, leche pasteurizada y leche esterilizada. Se
toman 2 tubos de ensayo estriles y se coloca en cada uno 10 ml de muestra. Un tubo se incuba a
37 C (flora mesfila) y otro a 42-45 C (flora ligeramente termfila), durante 24-48 hs. Se
comparan los resultados para los tres tipos de leche.
Microbiologa de Alimentos
Trabajo Prctico N 6: Identificacin de Staphylococcus aureus
El primer paso para la identificacin de una especie bacteriana es el estudio de su
morfologa microscpica y macroscpica. Luego se procede a la realizacin de pruebas
bioqumicas que permitirn llegar a la identificacin de gnero y especie bacteriana.
1. MORFOLOGA MACROSCPICA
Las colonias tpicas de Staphylococcus aureus, desarrolladas en el medio Baird Parker,
se presentan negras, brillosas, convexas, 1 a 5 mm de dimetro, rodeadas por un borde
estrecho blanquecino y un halo claro de 2-5 mm. de ancho.
2. MORFOLOGA MICROSCPICA
Para la misma se debe realizar un frotis, de preferencia a partir de un medio lquido,
realizando luego la tincin de Gram lo que nos permitir apreciar la forma, agrupacin
y comportamiento frente a la coloracin de Gram de la cepa en estudio. El gnero
Staphylococcus se caracteriza por ser cocos Gram positivos que se agrupan en forma de
racimos.
3. PRUEBA DE LA COAGULASA
Objetivo: Permite separar S.aureus, que posee coagulasa, de las otras especies de
estafilococos que genricamente se denominan coagulasa negativos.
Fundamento: S.aureus posee dos tipos de coagulasa:
a. Una endocoagulasa o coagulasa ligada o "clumping factor" que est unida a la pared
celular. Esta acta directamente sobre el fibringeno provocando la formacin de
cogulos o grumos cuando se mezcla una suspensin bacteriana con plasma citratado
(test en lmina).
b. Una exocoagulasa o coagulasa libre que liberada al medio, produce la siguiente
reaccin:
coagulasa libre + fibringeno (presente en el plasma) cogulo de fibrina ( test en
tubo)
Test en lmina
Procedimiento: Se emulsionan una o ms colonias en una gota de suero fisiolgico
hasta formar una suspensin lechosa sobre un portaobjetos. Luego se agrega una gota
de plasma obtenido con EDTA o heparina (no citratado) y se mezclan.
Interpretacin de resultados: Debe realizarse dentro de los primeros diez segundos. Un
test positivo se evidencia por la formacin de grumos. Los test negativos deben ser
confirmados por test en tubo.
Test en tubo
Procedimiento: Se emulsionan varias colonias en un tubo que contiene caldo cerebro
corazn y se cultivan entre 18-24 horas (cultivo joven, en fase exponencial de
crecimiento). Se toman 0.5 ml de cultivo y se mezclan con 0.5 ml de plasma de conejo,
obtenido con EDTA heparinizado. Se incuba a 35 0,5 C y se chequea la formacin
del cogulo a las 4 horas. Si es negativo se re-incuba toda la noche y se procede a su
lectura a las 18 horas. La lectura a las 4 horas, es fundamental porque en alguna
oportunidad puede suceder que las fibrinolisinas de S.aureus lisen el cogulo luego de
18 horas de incubacin y de esta manera se produzcan un test falso negativo.
Interpretacin de resultados
.
(- ) no se observa formacin de fibrina.
1. aparecen cogulos muy pequeos desorganizados.
2. aparece un cogulo pequeo organizado.
3. aparece un gran cogulo organizado.
4. aparece cogulo firme se mantiene an cuando se invierte el tubo
Microbiologa de Alimentos
Trabajo Prctico N7: Correlacin entre los valores qumicos y microbiolgicos para la
evaluacin de frescura en pescado
A- Anlisis Bacteriolgico
Preparacin de la muestra para el anlisis
1. Limpiar cuidadosamente la envoltura externa de la muestra con un isopo de algodn empapado
en alcohol
2. Corte la envoltura externa con un elemento esterilizado y coloque 25 g de muestra en un vaso
homogeneizador, despus de haberla dividido en pequeos trozos.
3. Adicione 225 ml de solucin diluyente estril y homogenice cuidadosamente. Esta ser la
solucin original de la muestra.
Recuento estndar en placa
1. De la solucin original de muestra prepare aspticamente una dilucin 10
-2
, dependiendo del
caso, de forma tal que las placas contengan entre 30 y 300 colonias.
2. Inocular dos placas de petri con 1 ml de la dilucin.
3. Adicionar 10 ml de agar para recuento y mezclar cuidadosamente.
4. Incubar a 25 1
C durante 24 horas y efectuar el recuento.
Recuento de Pseudomonas sp.- Aeromonas sp.
1. Agregar 10 mL de agar GSP previamente enfriado a 50-55 C (adiciondo con 100.000 UI/L
de penicilina G sdica). Dejar solidificar a temperatura ambiente.
2. Sembrar en superficie por estra de la dilucin 10
-1
.
3. Incubar la placa invertida hasta 72 hs a 25 1
C.
Recuento de Vibrio parahemolyticus
1. De la solucin original 10
-1
sembrar 0.1 ml en superficie por duplicado y esparcir utilizando
una esptula de Drigalsky.
2. Las placas son preparadas con agar TCBS (agar tiosulfato-citrato-sales biliares-sacarosa)
selectivo para Vibrio sp.
3. Incubar a 37 C durante 24 hs.
4. Cuando en ambas placas se generan colonias verde azuladas, se considera Vibrio
parahemolyticus positivo. Desarrollo de colonias en una sola de las placas o colonias
amarillas, se considera resultado negativo.
Investigacin de Clostridium sulfitorreductores (presuntivo de C. botulinum tipo E)
1. Inocular un tubo con una porcin del alimento a investigar
2. Calentar en bao mara durante 10 minutos a 80 C (para destruir las formas
vegetativas y dejar las esporuladas) y enfriar bajo canilla.
3. Agregar el agar diferencial para clostridios, el cual ha sido previamente fundido
y entibiado a 48-50 C., en barra no inferior a los 15 cm. Cubrir la superficie con
una capa de parafina estril.
4. Incubar a 25 1
C durante una semana.
B- Anlisis de Nitrgeno Bsico Voltil por Conway
Reactivos
Acido Brico
Vaselina + Parafina lquida
K
2
CO
3
soln. (K
2
CO
3
50g + agua destilada 100 ml)
Acido Sulfurico 0.02 N
Acido Tricloroactico (TCA) 7 %
Mezcla indicadora: verde de bromo cresol y rojo de metilo
Procedimiento
1. Preparacin de la muestra
a) Pesar 5g de muestra.
b) Triturar en mortero.
c) Adicionar 20 ml de TCA 7 %.
d) Filtrar despus de 30 minutos.
e) Solucin de muestra.
2. Microdifusion
a) Colocar 1 ml de c. brico (interior) + indicador
b) Colocar 1 ml de soln. de muestra (exterior)
c) Sellar con vas. + par.
d) Agregar 1 ml de soln. de CO
3
K
2
(exterior)
Ensayo en blanco
1. Repetir los pasos a,b y d. En el paso b: colocar 1 ml de TCA 7 %.
2. Permitir la difusin de muestra y blanco durante 90 min. a 35 C.
3. Titular con SO
4
H
2
0.02 N, hasta viraje del verde plido al rosa tenue
Microbiologa de Alimentos
Trabajo Prctico N 8: Anlisis microbiolgico de conservas
1. EXAMEN DE LAS LATAS
Observar si esta sucia, herrumbrada, manchadas las etiquetas, si est hinchada o
abombada o si hay alteraciones en los remaches.
2. INCUBACION PRELIMINAR DE LAS MUESTRAS
Se colocan las latas normales y las flipper (aparecen como normales pero al ser
golpeadas bruscamente sobre un extremo el otro se hincha), a 35 C durante 14 das.
Si las latas van a estar sometidas a temperaturas altas durante su almacenamiento y
transporte, o se sospecha deterioro termoflico, incubar a 55 C durante siete das.
3. APERTURA DE LOS ENVASES
Lavar con cepillo el fondo no escrito empleando agua caliente y jabn; enjuagar y secar
con toalla limpia; flamear el fondo lavado.
Cuando se trata de latas hinchadas se deben tomar precauciones especiales: enfriar las
latas en heladera, higienizar con solucin de iodo al 2 % en alcohol al 70 % y secar con
toalla esterilizada. NO FLAMEAR. Perforar con punzn estril a travs de un embudo
de vstago corto (tambin estril) para evitar proyecciones.
Las latas normales se abren con un abrelatas que se ha esterilizado por flameado.
Cuando se va a hacer la puncin el aire que reemplazar al vaco se esteriliza dirigiendo
la llama de un mechero a la punta del abrelatas.
4. EXTRACCION DEL MATERIAL PARA EL ANALISIS
Sacar porciones del centro de la lata para inocular en los medios de cultivo. Con pipeta
de punta gruesa en el caso de conservas lquidas o con esptula estril si son slidas.
Transferir el resto de la conserva a un recipiente estril y mantener en heladera para
repetir los ensayos en caso necesario.
5. EXAMEN MICROBIOLOGICO DE CONSERVAS DE BAJA ACIDEZ (pH>4,6)
Para cada lata inocular cuatro tubos de caldo para anaerobios (caldo hgado, medio de
carne cocida, caldo tioglicolato o similares) previamente purgados. Esto se logra
eliminando el oxgeno por ebullicin y enfriamiento posterior rpido. La inoculacin se
realiza con 1 o 2 ml de producto lquido o de mezclas slido-lquido; o bin 1 o 2 g si se
trata de un slido.
Realizar otra inoculacin de la misma manera con caldo para aerobios (caldo dextrosa-
prpura de bromocresol, por ejemplo). Incubar de la siguiente forma:
MEDIO N DE TUBOS TEMPERATURA TIEMPO DE
INCUBACION
Caldo para
anaerobios
2 35 C 96 - 120 horas
Caldo para
anaerobios
2 55 C 24 - 72 horas
Caldo para
aerobios
2 35 C 92 - 120 horas
Caldo para
aerobios
2 55 C 24 - 48 hs
Es conveniente sellar los tubos para anaerobios con una capa de vaselina o vas-par
estril.
Investigar la presencia de toxina botulnica.
Investigacin de Clostridium sulfitorreductores: Inocular dos tubos de agar sulfito-
hierro, en barra no inferior a los 15 cm y bin purgado, con 1 ml de una dilucin 50 %
del producto. Para esto se coloca la dilucin en un tubo estril y se la calienta en bao
mara durante 10 minutos a 80 C (para destruir las formas vegetativas y dejar las
esporuladas) y se le agrega el medio entibiado a 48 - 50 C. Se incuba un tubo 32 y el
otro a 44 C. Toda colonia negra desarrollada en profundidad y que morfolgicamente
responda a un Clostridium y sea catalasa negativa se la considera positivo. El tubo a 44
C. El tubo a 44 C se considera presuntivo de Clostridium Perfringens.
6. EXAMEN MICROBIOLOGICO DE CONSERVAS ACIDAS (pH < 4,6)
De cada lata inocular 4 tubos de caldo cido y 2 de caldo extracto de malta para hongos
y levaduras; de la misma forma en que se procede para conservas de baja acidez.
Incubar:
MEDIO
N DE TUBOS TEMPERATURA TIEMPO
Caldo cido
2 55 C 48 horas
Caldo cido
2 30 C 96 horas
Caldo E. de malta
2 30 C 96 hora
Para ambos tipos de conservas informar la presencia o ausencia de crecimiento en cada
tubo y hacer extendidos y coloracin de los positivos.
7. EXAMEN FISICO Y ORGANOLEPTICO DEL CONTENIDO
Determinar el pH de cada submuestra con un pH-metro. Examinar el color, olor,
consistencia y textura. Examinar el interior del recipiente, observar si est ennegrecido,
daado o picado. NO PROBAR EL PRODUCTO.
Microbiologa de Alimentos
SEMINARIO N 1: Factores que influyen en el crecimiento de los
microorganismos en un alimento
1. a) Qu es alteracin microbiana de un alimento?
b) Cundo ser posible la proliferacin de cualquier grupo microbiano en un
alimento?
c) Cules son los principales gneros microbianos potencialmente alterantes
que se pueden encontrar en un alimento?
d) De ejemplos de gneros patgenos incluyendo el alimento generalmente
involucrado y el tipo de patogenicidad.
2. a) Indique los lmites de pH para el crecimiento de bacterias, levaduras y
mohos; incluya las excepciones y su importancia.
b) Qu factores relacionados con el crecimiento microbiano sern afectados
por modificaciones en el pH? En lo posible diga cmo y por qu
c) Qu tipo de cidos es preferible para la conservacin de alimentos?
Justifique
3. a) Indique la clasificacin de los microorganismos en funcin del Eh necesario
para su proliferacin.
b) Respecto del crecimiento de microorganismos cules son los efectos de la
presencia de oxgeno en un alimento?
c) Sobre qu grupo de microorganismos ejerce efectos txicos el oxgeno y por
qu?
d) Por qu un microorganismo que no posee metabolismo oxidativo
convencional puede ser aerotolerante?
4. a) Qu es la a
w
? Defina.
b) Dos medios con igual aw tendrn igual receptividad para el crecimiento de
microorganismos? Justifique.
c) Indique los valores ptimos para el desarrollo de bacterias, levaduras y
mohos; incluya las excepciones y su importancia.
d) Cmo incide la HR del ambiente sobre la aw de un alimento y qu
consecuencias tendr esto en el crecimiento de microorganismos?
5. a) Indique la clasificacin de los microorganismos en funcin de su temperatura
de crecimiento. De ejemplos de cada uno
b) Qu microorganismos son ms perjudiciales para los alimentos refrigerados:
los psicrtrofos o los psicrfilos? Justifique.
c) Qu microorganismos termfilos sern ms perjudiciales para los alimentos
y porqu?
d) Cules son las causas de la menor velocidad de crecimiento de los
microorganismos a temperaturas mayores y menores que la ptima?
6. Adems de la HR qu otros componentes del ambiente inciden en el desarrollo
de microorganismos en los alimentos?
7. Mencione por lo menos dos barreras antimicrobianas de distinto tipo que se
deterioran o destruyen durante los procesos de recoleccin, molienda,
maduracin de carnes, blanqueo de harinas, etc, y las consecuencias sobre la
microflora que producir esa modificacin.
8. Describa sintticamente las interrelaciones entre los factores intrnsecos y /o
extrnsecos de seleccin de la microflora alterante de los alimentos.
9. Defina sinergismo, antagonismo y comensalismo.
10. Qu diferencias bioqumicas y fisiolgicas hay entre las familias de las
Pesudomonadaceae y Enterobacteriacceae?
11. a) Cules son las principales Pseudomonas ssp aisladas de carnes?
b) Qu otros microorganismos pueden aparecer como componentes
secundarios de la microflora alterante en carnes?
12. a) Qu efectos indeseables producen las levaduras en los alimentos?
b) Defina levadura osmfila, ejemplifique Qu factores fisicoqumicos
influyen y cmo, en el crecimiento de esas levaduras?
c) Cules son las principales caractersticas de las levaduras que toleran bajas
temperaturas? Ejemplifique
d) Qu medios son tiles para prevenir la presencia de levaduras en alimentos?
e) Qu ejemplos conoce de usos beneficiosos de las levaduras en alimentos?
13. a) Qu alimentos y como pueden alterarse por mohos? De ejemplos de los
mohos ms comunes en cada uno
b) Describa sintticamente las condiciones generales para el desarrollo de
mohos en un alimento
14. Cul es la importancia de los virus en la microbiologa alimentaria?
Ejemplifique.
15. Qu es la microbiologa predictiva?
16. a) Describa sintticamente tres mtodos para predecir el comportamiento de los
microorganismos.
b) En el caso del Clostridium botulinum indique los pasos esenciales y los
parmetros a tener en cuenta a fin de obtener modelos matemticos para predecir la
probabilidad de que sus esporas resistan un tratamiento trmico
Microbiologa de Alimentos
Seminario N 2: Epidemiologa
1. a)Definicin de salud
b) Indique los Factores que inciden sobre la salud que deben tenerse en cuenta
para el diseo de las polticas de salud
2. De ejemplos de poblaciones de Alto Riesgo
3. A) Cules son los tres niveles de Prevencin de enfermedades? Describa los
objetivos de cada uno de ellos
b) Cul es la diferencia entre Prevencin y Promocin de la Salud?
4. a)Defina Epidemiologa
b) Cules son los objetivos de la Epidemiologa y sus mtodos?
5. Defina las Tasas ms importantes utilizadas en Epidemiologa
6. Cmo pueden presentarse las enfermedades en una poblacin?
7. Respecto de las Enfermedades Infectocontagiosas indique:
a) Fuentes de contaminacin
b) Modos de transmisin
8. Cules son los Parmetros que caracterizan una Epidemia?
9. Describa las medidas de corto plazo necesarias para controlar Epidemia.
10. Describa las medidas de largo plazo necesarias para controlar Epidemias.
Microbiologa de Alimentos
Seminario N 3: Muestreo para el anlisis microbiolgico-Valores microbiolgicos
de referencia
1- Cmo se evitan las subjetividades en la obtencin de una muestra representativa?
2- Qu datos son representados en ordenadas y abscisas cuando se construye una curva
caracterstica de operacin?
3- Cmo deben ser n y c en un programa severo de muestreo?
4- De qu factores depende la rigurosidad del plan de muestreo elegido?
5- Qu determina que se elija un plan de 2 o3 categoras?
6- Cules son las consideraciones que deben hacerse a la hora de elegir un plan de
muestreo para carne fresca y para leche en polvo?
7- Si la probabilidad de encontrar Clostridium perfringens en una muestra es 0.05,
cul sera la probabilidad de aceptar el lote en un muestreo de n 20?
8- Cul es el criterio empleado para definir el valor de referencia m?
9- Qu factores determinan el rango entre los valores de referencia de m y M?
10- Deben fijarse valores de referencia para todos los microorganismos presentes en
un alimento?
11- Qu indicara un valor de muy prximo a DIM o al NMA?
12- Qu gneros de microorganismos, presentes en pescados y productos derivados,
pueden causar toxicoinfecciones alimentarias?
13- Por qu se recomienda en un anlisis bacteriolgico de muestras de pescado, efectuar
un SPC a 25C?
14- Cmo se seleccionan los valores de m y M en los programas especficos de
muestreo de pescados y alimentos desecados?
15- Por qu no es ventajoso utilizar un programa de tres clases cando se quiere
detectar la presencia de Salmonella en pescado?
16- Qu tipos de anlisis microbiolgicos se recomiendan en muestras de pescado y
alimentos desecados? Con qu tamao de muestra se trabaja habitualmente?
17- Para el caso de alimentos desecados cuando es necesario efectuar anlisis
adicionales a las muestras de stos alimentos?
18- En el caso de huevos congelados para qu es til el DCM y qu indica este tipo de
recuento? Cmo influye el valor de DCM en la eleccin de m y M?
19- Qu indica un valor bajo de SPC en el caso de huevos congelados?
20- En qu casos se aconseja realizar un anlisis de Salmonella en muestras de leche
en polvo?
21- Por qu conviene elegir un valor de M bajo cuando se selecciona un programa de
muestreo para productos lcteos?
22- En el proceso de fabricacin de quesos, qu gnero de microorganismos representa
un peligro potencial para la salud? Por qu?
23- Cmo se elijen los valores de m y M para las carnes crudas, como se relacionan
con el SPC?
24- Por qu no son efectivos los programas de muestreo para detectar la presencia
directa de Clostridium botulinim en conservas? Cmo se procede para determinar
indirectamente su presencia?
25- Qu programas de muestreo se usan en conservas?
26- Por qu no existen programas de muestreo uniformes para el anlisis
microbiolgico de mariscos?
Microbiologa de Alimentos
Seminario N 4: Clera
1. A)Defina y clasifique los desordenes diarreicos
b) De ejemplos de diarreas causadas por bacterias
2. a) Cul es el agente causal principal del Clera?
b) Cules son sus principales caractersticas biolgicas y bioqumicas?
3. Cules son los factores que inciden sobre transmisin del clera?
4. Cules son los mecanismos de patogenicidad de las bacterias causales de
ETAs?
5. Describa el sndrome del clera
6. a)Describa la accin fisiolgica del vibrio cholerae
b) Indique el tratamiento adecuado para esa infeccin
7. Respecto del enfoque epidemiolgico del clera indique:
a) Fuente de contaminacin
b) Reservorios
c) Mecanismos de transmisin
8. a) Fuente de contaminacin
b) Reservorios
c) Mecanismos de transmisin
9. Describa los factores que inciden sobre una epidemia de clera
10. Indique las medidas de corto plazo y las medidas de largo plazo que se
deben implementar en una epidemia de clera
11. Describa detalladamente el procedimiento para identificar Vibrio cholerae
en alimentos.
12. Indique cules son los alimentos que producen mayor riesgo de contagiar
Vibrio cholerae.
Microbiologa de Alimentos
Seminario N 5: Microorganismos Emergentes
1. a) Diga cules son las caractersticas generales de los Campylobacter y cules
las de los Campylobacter patgenos asociados a alimentos
b) Cul es el reservorio de los Campylobacter patgenos?
c) Qu les ocurre frente condiciones ambientales desfavorables?
2. a) Qu tipo de afecciones producen los Campylobacter y por qu? Cules son
los signos clnicos?
b) A qu grupos de la poblacin afecta principalmente?
c) Cules son los alimentos involucrados? Existe otra va de transmisin?
3. Indique las condiciones de aislamiento e identificacin de los Camplylobacter
importantes en microbiologa de alimentos
4. Respecto del riesgo de toxo-infeccin alimentaria, qu puede decir de las
distintas cepas de Yersinia enterocoltica?
5. a) Cules son las caractersticas generales de Y. enterecoltica y por qu?
b)Enqusediferencianlascepasdeintersparamicrobiologadelosalimentosde
lasotras?
6. a) Qu tipo de afecciones produce Y. enterocoltica y por qu?
b) Describa la sintomatologa de la infeccin, con que otra enfermedad se la
suele confundir y por qu
c) cules son los principales grupos de la poblacin de riesgo?
d) cules son los alimentos ms peligrosos?
e) Cules son las causas del aumento de la incidencia de la infeccin por Y.
enterocolitica a travs de los alimentos?
7. Describa las condiciones de aislamiento e identificacin de Y. enterocoltica.
8. Cules son las caractersticas morfolgicas y bioqumicas de Listeria
monocytogenes?
9. a) Describa la sintomatologa de la listeriosis materno fetal y neonatal
b)demparaniosyadultos
c)Qumodosdetransmisindelaenfermedadpuedecitar?Culeselms
importante?
10. a) Cul es la principal fuente de infeccin con L. monocytogenes?
b) Qu otras circunstancias agravan la peligrosidad de este microorganismo?
c) Dnde puede sobrevivir L. monocytogenes?
d) En qu alimentos se encontr L. monocytogenes y cules seran los ms
peligrosos?
11. a) Describa los medios para enriquecer L. monocytogenes en alimentos.
b) Cules son los medios de cultivo ms adecuados para identificar L.
monocytogenes?
c) Describa la utilizacin de ELISA, hibridacin de DNA e
inmunofluorescencia para identificar L. monocytogenes
Microbiologa de Alimentos
Seminario 6: HACCP
1. Indique los 7 principios bsicos del HACCP.
2. Cules son los principales factores de control en el procesamiento de productos de
la pesca?
3. Defina RIESGO, SEVERIDAD, PCC
1
, PCC
2
, PELIGRO.
4. El desarrollo de bacterias puede ser controlado si se mantiene la temperatura por
debajo de 3 C. Qu grado de seguridad se le asigna a este punto crtico en :
- Desarrollo de patgenos
- Produccin de histamina
- Desarrollo de bacterias alterantes
5. a) Cules son los microorganismos que constituyen principalmente la flora
alterante en:
- Productos con menos de 5 % de sal y pH mayor de 5.
- Productos con ms de 6 % de sal y pH menor de 5.
- Productos frescos y congelados.
b) Ordene los productos en orden decreciente de peligrosidad y justifquelo.
6. En el procesamiento de productos de la pesca que sern ingeridos sin coccin:
a) Adems de la temperatura, cul es el otro PCC
1
para inhibir el desarrollo de
Clostridium botulinum?
b) Por qu este microorganismo en particular necesita un PCC adicional?
7. Qu grado de seguridad se le asigna a los controles de higiene y sanidad en una
fbrica de productos pesqueros? Justifique.
8. En las especies acuticas los parsitos del gnero Anisakis marinae constituyen un
peligro. Para los productos descriptos en el problema 5:
a) Cul es el grado de riesgo y severidad (alto o bajo) que se le asigna a este
peligro?
b) En cada uno de dichos productos cual es la medida que elimina este peligro?
9. En las semiconservas de pescado (> de 6 % de sal y pH < 5) las bacterias patgenas
no son consideradas un peligro en tanto que las toxinas y las aminas bigenas
preformadas en la materia prima son un serio peligro con un alto riesgo Por qu?
10. Por qu la evaluacin sensorial de la materia prima, inmediatamente antes del
procesamiento, es tambin un PCC
1
en los productos del problema 9-, en lo que se
refiere al peligro de toxinas y aminas bigenas.
En los productos crudos y congelados
11. Por qu se considera un peligro al desarrollo " de patgenos, como Cl. botulinum
y V. parahaemolyticus, y no se considera un peligro a la "contaminacin" con
dichas bacterias?
12. Cmo califica la severidad y el riesgo (probabilidad de que provoquen la
enfermedad) del peligro que implican los siguientes patgenos :
- Cl. Botulinum
- Vibrios spp. ( V. parahaemolitycus, V. cholerae )
- Aeromonas sp.
13. a) La coccin posterior que podran recibir estos productos elimina el peligro de
histamina?
b) En qu condiciones el riesgo de este peligro se ve notoriamente incrementado?
14. La contaminacin con bacterias provenientes del habitat humano o animal, pueden
contaminar al animal vivo dependiendo del rea de pesca, y una contaminacin
adicional puede tener lugar durante el desembarque y procesamiento. Las
enfermedades que estos organismos pueden provocar son serias, pero si el nmero
de microorganismos en el producto es pequeo, la probabilidad de que se produzca
enfermedad (riesgo) es muy baja.
a) Con qu medida se elimina este peligro?
b) Cul es el peligro indirecto, de mayor severidad y riesgo, que implica este tipo de
contaminacin?
También podría gustarte
- Análisis Microbiológico A Producto TerminadoDocumento11 páginasAnálisis Microbiológico A Producto TerminadoNatalia Franco SánchezAún no hay calificaciones
- Luque-Practica 2Documento17 páginasLuque-Practica 2luqueAún no hay calificaciones
- ReflexologiaDocumento5 páginasReflexologiaLujana RomanoAún no hay calificaciones
- 2do Taller de Moldeo y FundicionDocumento3 páginas2do Taller de Moldeo y FundicionLujana RomanoAún no hay calificaciones
- Mitologia Japonesa PDFDocumento25 páginasMitologia Japonesa PDFAlcaudonsAún no hay calificaciones
- Taller M AquinasDocumento6 páginasTaller M AquinasLujana RomanoAún no hay calificaciones
- Tecnologia 1Documento52 páginasTecnologia 1Lujana RomanoAún no hay calificaciones
- General de Dibujos Animados y AnimacionDocumento3 páginasGeneral de Dibujos Animados y AnimacionLujana RomanoAún no hay calificaciones
- Vestimenta Tradicional KimonoDocumento6 páginasVestimenta Tradicional KimonoLujana RomanoAún no hay calificaciones
- Para Mirar La ImagenDocumento5 páginasPara Mirar La ImagenaggyAún no hay calificaciones
- Tutorial Basico de Corel DrawDocumento10 páginasTutorial Basico de Corel DrawLujana RomanoAún no hay calificaciones
- LA Linea2Documento28 páginasLA Linea2Alvaro Benavides AcostaAún no hay calificaciones
- KleeDocumento4 páginasKleeLujana RomanoAún no hay calificaciones
- Pensar ImaginarDocumento1 páginaPensar ImaginarLujana RomanoAún no hay calificaciones
- Efrain PortilloDocumento5 páginasEfrain PortilloLujana RomanoAún no hay calificaciones
- Artes Visuales - DC Percepcion VisualDocumento4 páginasArtes Visuales - DC Percepcion VisualLujana RomanoAún no hay calificaciones
- TEXTO Nº1 Contraste, Del Libro FUNDAMENTOS DEL DISEÑO de R. Scott Pag. 10 A 19Documento6 páginasTEXTO Nº1 Contraste, Del Libro FUNDAMENTOS DEL DISEÑO de R. Scott Pag. 10 A 19Lujana RomanoAún no hay calificaciones
- Elementos Del LenguajeDocumento38 páginasElementos Del LenguajedianikaddAún no hay calificaciones
- Plan FitDocumento34 páginasPlan FitLujana Romano100% (1)
- RECETARIO PLAN FIT Lic. Ma Azul Martin Lic. Mora BerissoDocumento24 páginasRECETARIO PLAN FIT Lic. Ma Azul Martin Lic. Mora BerissoLujana RomanoAún no hay calificaciones
- 07 - Herramientas de La Luz PDFDocumento33 páginas07 - Herramientas de La Luz PDFSebastian ChaileAún no hay calificaciones
- Exp Graf 1Documento206 páginasExp Graf 1Sergio Jimenez ZarzaAún no hay calificaciones
- TEXTO #3 Textura Del Libro FUNDAMENTOS DEL DISEÑO Wucius-Wong Pag. 119 A 126Documento9 páginasTEXTO #3 Textura Del Libro FUNDAMENTOS DEL DISEÑO Wucius-Wong Pag. 119 A 126Lujana RomanoAún no hay calificaciones
- Claves de ValorDocumento2 páginasClaves de ValorLujana RomanoAún no hay calificaciones
- TEXTO #2 Estructura Del Libro TEORIA DEL CAMPO A.MarcolliPag. 10 A 19Documento9 páginasTEXTO #2 Estructura Del Libro TEORIA DEL CAMPO A.MarcolliPag. 10 A 19Lujana RomanoAún no hay calificaciones
- Actividad Textos y Algo MasDocumento1 páginaActividad Textos y Algo MasLujana RomanoAún no hay calificaciones
- La Luz y El Volumen GraficoDocumento1 páginaLa Luz y El Volumen GraficoLujana RomanoAún no hay calificaciones
- Claves Tonales Cerámica 2020Documento2 páginasClaves Tonales Cerámica 2020Lujana RomanoAún no hay calificaciones
- Las FormasDocumento34 páginasLas FormasJack MorrisAún no hay calificaciones
- Investigación de La FORMA tp4Documento24 páginasInvestigación de La FORMA tp4Lujana RomanoAún no hay calificaciones
- Que Es El Valor en Las Artes PlasticasDocumento4 páginasQue Es El Valor en Las Artes PlasticasLujana RomanoAún no hay calificaciones
- Guía de Análisis Sintáctico y SemánticoDocumento3 páginasGuía de Análisis Sintáctico y SemánticoLujana RomanoAún no hay calificaciones
- Guía Lab. Evaluación de SuperficiesDocumento7 páginasGuía Lab. Evaluación de SuperficiesWilmer tocanchonAún no hay calificaciones
- Clasificacion EstafilococosDocumento1 páginaClasificacion EstafilococosPaula Durán SigchoAún no hay calificaciones
- Bioquimica para CocosDocumento31 páginasBioquimica para CocosLiz CabezasAún no hay calificaciones
- BacteriologiaDocumento30 páginasBacteriologiaAlvaro Israel Zapata VargasAún no hay calificaciones
- Exudado NasalDocumento4 páginasExudado NasalLizeth57% (7)
- Taller 1. Pruebas Bioquímicas en Gram Positivos VDocumento17 páginasTaller 1. Pruebas Bioquímicas en Gram Positivos VLESDY DAYANA NARVAEZ TREJOAún no hay calificaciones
- Practica Staphylococcus AureusDocumento4 páginasPractica Staphylococcus Aureusdulzura123456789Aún no hay calificaciones
- Pruebas Bioquimicas 4 SemestreDocumento20 páginasPruebas Bioquimicas 4 Semestrecristian david hurtado peñaAún no hay calificaciones
- CUESTIONARIO MicrobiologíaDocumento2 páginasCUESTIONARIO MicrobiologíaJesús Antonio Reyes MejiaAún no hay calificaciones
- StaphylococcusDocumento18 páginasStaphylococcusElizabeth Monterroza CarriazoAún no hay calificaciones
- Proyecto de InvestigacionDocumento18 páginasProyecto de InvestigacionDenis Cruz MarceloAún no hay calificaciones
- Informe 2 de MicrobiologiaDocumento9 páginasInforme 2 de MicrobiologiaestefaniAún no hay calificaciones
- 78 Pruebas Bioquímicas para La Identificación de StaphylococcuDocumento22 páginas78 Pruebas Bioquímicas para La Identificación de StaphylococcuYair Dz0% (1)
- Apéndice Normativo B de NOM-201-SSA1-2014. Método de Referencia para S AureusDocumento8 páginasApéndice Normativo B de NOM-201-SSA1-2014. Método de Referencia para S AureusPaulina Santiago de RosasAún no hay calificaciones
- Infecciones Por EstafilococosDocumento50 páginasInfecciones Por EstafilococosUriel ZaMont100% (1)
- Guiapracticademicrobiologia 120817175002 Phpapp02Documento76 páginasGuiapracticademicrobiologia 120817175002 Phpapp02nerkysdoneAún no hay calificaciones
- P-SA-78 Aislamiento y Recuento Staphylococcus Aureus V1Documento12 páginasP-SA-78 Aislamiento y Recuento Staphylococcus Aureus V1Adrian David Bermudez EstupiñanAún no hay calificaciones
- Clase 4 MicrobiologiaDocumento217 páginasClase 4 MicrobiologiaKarina Isamar Cruz SilvaAún no hay calificaciones
- Staphylococcus. ÓsmosisDocumento13 páginasStaphylococcus. ÓsmosisSarah Alvarez AndradeAún no hay calificaciones
- Manual INVIMA 1 CorregidoDocumento62 páginasManual INVIMA 1 CorregidoAdriana OrdoñezAún no hay calificaciones
- PRACTICA N°9 Staphylococcus AureusDocumento8 páginasPRACTICA N°9 Staphylococcus AureusRubi Ortiz BacaAún no hay calificaciones
- Aislamiento e IdentificaciónDocumento13 páginasAislamiento e IdentificaciónMauro Cárdenas BecerraAún no hay calificaciones
- StaphylococcusDocumento9 páginasStaphylococcusjesusAún no hay calificaciones
- Guía Microbiologia GeneralDocumento67 páginasGuía Microbiologia GeneralHans MenaresAún no hay calificaciones
- P10 Investigación y Recuento de Staphylococcus Aureus-GrupoDocumento8 páginasP10 Investigación y Recuento de Staphylococcus Aureus-GrupoErick Kleyder Quiroz LimacheAún no hay calificaciones
- Reporte 2. Aislamiento Del Género StreptoDocumento5 páginasReporte 2. Aislamiento Del Género StreptoCely RobPachAún no hay calificaciones
- Identificación Bacteriana para Diagnóstico de LaboratorioDocumento8 páginasIdentificación Bacteriana para Diagnóstico de LaboratorioAriel Molina ValenzuelaAún no hay calificaciones
- Guia Petrifilm Staph ExpressDocumento6 páginasGuia Petrifilm Staph Express7Joel1985Aún no hay calificaciones