Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Los Cuerpos Sólidos QUIMICA
Cargado por
Luis Jhonatan Moreyra MalpicaDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Los Cuerpos Sólidos QUIMICA
Cargado por
Luis Jhonatan Moreyra MalpicaCopyright:
Formatos disponibles
Los cuerpos slidos, por otra parte, son aquellos que mantienen forma y volumen constantes gracias a la gran
cohesin de sus molculas. La fase slida es uno de los cuatro estados de agregacin de la materia, junto al
lquido, el gaseoso y el plasmtico.
Entre las propiedades de los slidos, se destacan la elasticidad (un slido puede recuperar su forma original
cuando es deformado), la dureza (no puede ser rayado por otro cuerpo ms blando) y la fragilidad (los slidos
pueden romperse en muchos pedazos ya que son quebradizos).
Y atendiendo a su estructura, podemos dividir los slidos en dos grandes categoras:
SLI DOS AMORFOS :
Los slidos amorfos pueden ser considerados tambin como sustancias lquidas sobreenfriadas. En muchos
casos pueden ser preparados del estado lquido por enfriamiento, aunque esto es a menudo difcil, debido
generalmente a la inestabilidad trmica: Los slidos amorfos resultan de una malformacin de un cristal al, por
ejemplo, enfriarlos bruscamente. Los slidos amorfos carecen de una distribucin tridimensional regular de
tomos. Muchos slidos amorfos son mezclas de molculas que no se pueden apilar bien. Casi todos los dems
se componen de molculas grandes y complejas. Entre los slidos amorfos ms conocidos destaca el vidrio.
Estos slidos a altas temperaturas son capaces de transformarse en lquidos, donde sus partculas constituyentes
poseen libertad de movimiento, y al disminuir la temperatura lentamente la energa cintica de las partculas
va disminuyendo llegando a producirse un acomodamiento entre ellas. Por otro lado, si el enfriamiento se
produce rpidamente y debajo del punto de fusin (sobre enfriamiento) originndose gracias a las menores
vibraciones una contraccin trmica, no permitiendo el reordenamiento de las partculas aumentado as la
viscosidad(no permitiendo apreciar el flujo) y adquiriendo las propiedades de un slido.
Caractersticas :
Estado slido de la materia
Las partculas carecen de una estructura ordenada
Carecen de formas y caras bien definidas.
Esta clasificacin contrasta con la de slidos cristalinos: cuyos tomos estn dispuestos de manera
regular y ordenada formando redes cristalinas.
Son mezclas de molculas que no se pueden apilar bien.
Entre los slidos amorfos destaca el vidrio.
Ejemplos de slidos amorfos
Concreto, asfalto, Plsticos, jabones, cera, las parafinas, azufre, caucho, goma, alquitrn como
tambin los compuestos inorgnicos (nilon)
Concreto Vidrio Parafinas
Alquitrn Azufre J abn
Propiedades:
Las molculas estn distribuidas al azar.
Las propiedades fsicas del slido son idnticas en todas las direcciones (isotropa).
Las formas amorfas tienen una temperatura caracterstica a la cual sus propiedades experimentan
cambios importantes (temperatura de transicin vtrea (Tg)).
En cuanto a sus propiedades elsticas, se puede afirmar que los slidos
amorfos manifiestan las propiedades de los cristales.
Respecto al magnetismo, los metales amorfos presentan las propiedades magnticas ms notables,
comportndose como materiales ferro magnticos (aquellos en los que se produce un ordenamiento
magntico de todos los momentos magnticos en la misma direccin y
sentido).
Mtodos de Obtencin de Slidos Amorfos
Por mucho tiempo se pensaba que slo una pequea cantidad de materiales podan ser preparados para
formar slidos amorfos, era comn referirse a estas sustancias como "especiales", como " slidos
formadores de vidrios" (por ejemplo: xidos de vidrio y los polmeros orgnicos). Esta nocin es
errnea, y hoy se conoce como una propiedad universal de la materia, se le llama la capacidad
o tendencia a formar sustancias amorfas. El estado de slido amorfo es ubicuo.
Algunos slidos amorfos, su tipo de enlace y su temperatura crtica de formacin del amorfo.
Tipos de mtodos
Los slidos amorfos se pueden formar, en condiciones naturales, si crecen en condiciones donde no
existe suficiente movilidad de los tomos. En el ao 1969, David Turnbull escribi que "probablemente
todos los materiales pueden, si se enfran con la suficiente rapidez y lejana de la temperatura crtica, ser
trasformados en slidos amorfos".
Artificialmente, existen varios mtodos de obtencin de slidos amorfos. El mtodo ms antiguo y ms
empleado es el de la fundicin templada, del que se conocen algunas variedades:
Bloque congelado
Esta tcnica necesita de un alto rango de temperaturas para el enfriamiento y formar
una aleacin metlica. Un chorro de metal fundido es propulsado contra la superficie de
un cilindro de cobre, el cual se encuentra en rpida rotacin, lo que obliga al lquido a
enfriarse (a temperatura ambiente o menor). Dentro de la tcnica del bloque congelado,
se distingue entre splat-cooling y el templado giratorio de extraccin.
Templado con lquido
Esta tcnica puede ser utilizada para el enfriamiento de lquidos, utilizando baos de
hielo en los cuales se introducen pequeas cantidades de fundido; permite enfriar con
rangos de velocidad altas.
Templado al aire
Esta tcnica puede ser utilizada para materiales con tendencia a la formacin de slidos
amorfos. Se puede obtener la fundicin con enfriamiento lento, lo cual se consigue
apagando el horno. Slidos amorfos obtenidos mediante este mtodo son SiO
2
,
As
2
S
3
(sulfuro arsenioso) y poliestireno.
Condensacin del vapor
Esta tcnica comienza cuando el vapor formado en una cmara de vaco, por la
evaporacin del material, choca con una superficie fra, obtenindose una sustancia
amorfa.
SLI DOS CRI STALI NOS
En los slidos cristalinos, los tomos (o molculas) ocupan posiciones regularmente distribuidas en el
espacio, constituyendo una red regular llamada red cristalina. Una caracterstica notable de los slidos
cristalinos es que su fractura es regular, esto es, al partirlos siguen lneas y planos muy regulares. As, si
molemos los cristales de sal y los examinamos bajo un mayor aumento, veremos que siguen conservando
formas muy regulares cbicas. Al mencionar la palabra cristal, quiz el lector pens en los vidrios de las
ventanas. Ciertamente podemos considerarlos slidos: mantienen su forma y su volumen, pero si quebramos
un vidrio de una ventana (digamos, jugando ftbol) veremos que los cortes no son regulares. Hay muchos
bordes filosos y su fractura es muy caprichosa.
Concepto sobre materiales cristalinos
Los materiales slidos se pueden clasificar de acuerdo a la regularidad con que los tomos o iones estn
ordenados uno con respecto al otro. Un material cristalino es aquel en que los tomos se encuentran situados
en un arreglo repetitivo o peridico dentro de grandes distancias atmicas; tal como las estructuras
solidificadas, los tomos se posicionarn de una manera repetitiva tridimensional en el cual cada tomo est
enlazado al tomo vecino ms cercano. Todos los metales, muchos cermicos y algunos polmeros forman
estructuras cristalinas bajo condiciones normales de solidificacin.
Celda Unitaria o rede de Bravais.
Es el agrupamiento ms pequeo de tomos que conserva la geometra de la estructura cristalina, y
que al apilarse en unidades repetitivas forma un cristal con dicha estructura.
Estructura cristalina
La estructura cristalina es la forma slida de cmo se ordenan y empaquetan los tomos, molculas, o iones.
Estos son empaquetados de manera ordenada y con patrones de repeticin que se extienden en las tres
dimensiones del espacio
tomos o iones
son representados como esferas de dimetro fijo.
Reticulado:
Arreglo tridimensional de puntos en el que cada punto tiene los mismos vecinos.
Nmero de Coordinacin:
Es el nmero de tomos o iones que tocan a otro en particular, es decir el nmero de vecinos ms cercanos,
indica que tan estrechamente estn empaquetados los tomos.
Parmetro de Red :
El parmetro de red hace referencia a la distancia constante entre las celdas unitarias en una estructura
cristalina. Las estructuras o redes en tres dimensiones generalmente tienen tres parmetros de red, a, b y c.
Sin embargo, en el caso especial de redes cbicas, todos los parmetros son iguales, con lo cual nos
referimos a ellos como a. Del mismo modo, en las estructuras cristalinas hexagonales, los
parmetros a y b son iguales, por lo que nicamente consideraremos a y c.
Ya que los parmetros de red tienen dimensiones de longitud, su unidad en el sistema internacional es
el metro. No obstante, suelen darse en submltiplos como el nanmetro o el angstrom.
CLASIFICACIN EN FUNCIN DEL TIPO DE ENLACE
a) Slidos Inicos
En los slidos inicos, la red est formada por iones alternadamente positivos y negativos,
resultantes de la transferencia de un electrn (o ms) de un tipo de tomo para el otro.
Los slidos inicos son generalmente duros, frgiles y tiene un elevado punto de fusin debido a las
fuerzas electroestticas relativamente intensas entre los iones.
Son duros y a la vez frgiles.
Poseen altos puntos de fusin.
Son malos conductores de electricidad.
Sin embargo, llegan a ser buenos conductores cuando estn fundidos o disueltos en
agua.
Sus disoluciones presentan a su vez una conductividad elevada.
b) Slidos covalentes
Estn formados por una red tridimensional de enlaces atmicos fuertes que dan lugar a
propiedades especficas.
El enlace covalente es muy fuerte, poseen estructuras muy compactas.
Sus puntos de fusin y de ebullicin son muy altos,
Duros e insolubles en todos los disolventes (Diamante, Grafito, Cuarzo, etc.).
Malos conductores elctricos y del calor
Diamante Cuarzo
c) Slidos moleculares
Son slidos formados por molculas covalentes discretas (por ejm H
2
O, I
2
) o por tomos
(gases nobles en estado slido)
Formados por molculas
Unidos por fuerzas de Vas der Waals (1 kJ/mol) o enlaces por puentes de H
Blandos, compresibles y deformables
Puntos de fusin bajos
Malos conductores del calor y electricidad
Ejm : SO
2
, I
2,
H
2
O(
s
),argon(Ar), metano(CH
4
)
Hielo
d) Slidos metlicos
As, un slido metlico es constituido por una red ordenada de iones positivos que son
mantenidos juntos por una especie de gas de electrones libres. La movilidad de los electrones
de valencia que constituyen ese gas de electrones libres y que torna los metales buenos
conductores de electricidad.
Son buenos conductores de electricidad y calor.
Poseen un enlace metlico con un gas de electrones externos compartido.
Son dctiles y maleables.
Punto de fusin: elevado
Insolubilidad en agua y en otros disolventes comunes
Ejm : Na, Mg, Fe, Cu.
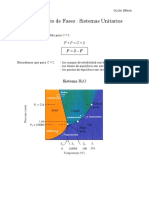
DIAGRAMAS DE FASE
En termodinmica y ciencia de materiales se denomina diagrama de fase, diagrama de equilibrio de
fases o diagrama de estados de la materia, a la representacin grfica de las fronteras entre
diferentes estados de la materia de un sistema, en funcin de variables elegidas para facilitar el estudio
del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de
agregacin diferentes se suele denominar diagrama de cambio de estado.
Los diagramas de equilibrio son grficas que representan las fases y estado en que pueden estar
diferentes concentraciones de materiales que forma una aleacin a distintas temperaturas. Dichas
temperaturas van desde la temperatura por encima de la cual un material est en fase lquida hasta la
temperatura ambiente y en que generalmente los materiales estn en estado slido.
Ejm : Diagrama de fase del H
2
O
Gas
Punto triple (T) Es aquella temperatura donde coexisten en equilibrio las 3 fases: slida, lquida y gaseosa,
para el H2O se da a una presin de alto vaci, 0.00603atm (4,6 mmHg) y temperatura de 0,01C.
Punto crtico (C). Es aqul donde se dan las condiciones mnimas para que el gas pueda ser licuado(o
pasar a la fase lquida), esto es una presin crtica(Pc) de 218atm y una temperatura crtica( Tc) de 374C.
Temperatura crtica (Tc). Es la temperatura ms alta a la cual puede licuarse (pasa del estado gaseoso
al lquido) un gas, por encima de esta temperatura ya no se puede conseguir la fase lquida por muy
alta que sea la presin ejercida sobre el gas. Establece el lmite entre vapor y gas.
Presin crtica (Pc). Es la presin mnima que debe aplicarse a una sustancia en fase gaseosa para que
pase a la fase lquida, manteniendo la temperatura crtica constante. Por lo tanto, un gas se licua o pasa
al estado lquido por debajo de la temperatura crtica(Tc) y por encima de la presin crtica(Pc).
Curva de sublimacin (o deposicin) (MT). Formada por puntos de diferente presin y temperatura a
las cuales estn en equilibrio la fase slida y la fase vapor.
También podría gustarte
- Tarea 2 SolidosDocumento14 páginasTarea 2 SolidosVictor Andres Turpo FloresAún no hay calificaciones
- Clasificación de Los SólidosDocumento19 páginasClasificación de Los SólidosYireny Avellaneda GonzalezAún no hay calificaciones
- Qué Son Los Sólidos Cristalinos y AmorfosDocumento8 páginasQué Son Los Sólidos Cristalinos y AmorfosLiliana RamirezAún no hay calificaciones
- Solidos Cristalinos y Solidos AmorfosDocumento6 páginasSolidos Cristalinos y Solidos AmorfosBEATRIZ ALEXANDRA CCASANI HUARCAAún no hay calificaciones
- Solidos CristalinosDocumento6 páginasSolidos Cristalinospruebprueba145Aún no hay calificaciones
- Seminario Solidos Cristalinos y AmorfosDocumento26 páginasSeminario Solidos Cristalinos y AmorfosAaronLopezRAún no hay calificaciones
- 1414-L Práctica 2 Estructuras CristalinasDocumento12 páginas1414-L Práctica 2 Estructuras CristalinasJonathan Saviñon de los SantosAún no hay calificaciones
- Estructura Cristalina PDFDocumento101 páginasEstructura Cristalina PDFOmarVilcaAún no hay calificaciones
- 7 EquilibriodefasesDocumento21 páginas7 EquilibriodefasesRafael Ignacio Leal QuijónAún no hay calificaciones
- CristaloquimicaDocumento58 páginasCristaloquimicaLeonardoGomez100% (1)
- Simetría MolecularDocumento8 páginasSimetría MolecularAnni CuellarAún no hay calificaciones
- NESOSILICATOSDocumento24 páginasNESOSILICATOSWiliams PongoAún no hay calificaciones
- 5 Viscosidad y Tensión SuperficialDocumento18 páginas5 Viscosidad y Tensión SuperficialWilder MamaniAún no hay calificaciones
- Sistema Cristalino MonoclinicoDocumento17 páginasSistema Cristalino MonoclinicoAder Rada ValdizanAún no hay calificaciones
- MaclasDocumento4 páginasMaclasBriceño P Marilyn Del CAún no hay calificaciones
- Practica de QuimicaDocumento9 páginasPractica de Quimicarar1018Aún no hay calificaciones
- Armadura de ClaveDocumento2 páginasArmadura de ClaveJosé de Jesús Rodríguez ÁlamoAún no hay calificaciones
- Primera Ley de NewtonDocumento8 páginasPrimera Ley de NewtonLisbeth PerezAún no hay calificaciones
- Geología y Paisaje de El Macizo de SepúlvedaDocumento7 páginasGeología y Paisaje de El Macizo de SepúlvedaGonzaloAún no hay calificaciones
- El Bosque CristalinoDocumento6 páginasEl Bosque CristalinoJHON MICHAEL PACHECO SUAREZ100% (1)
- Polímeros Orgánicos e Inorgánicos Sintéticos y NaturalesDocumento10 páginasPolímeros Orgánicos e Inorgánicos Sintéticos y NaturalesNathaly Burgos100% (1)
- Lab HidrogenoDocumento5 páginasLab HidrogenoVeroGranadosArias50% (2)
- Las 32 Formas Cristalinas de Los MineralesDocumento6 páginasLas 32 Formas Cristalinas de Los MineralesFrank CalloAún no hay calificaciones
- Trabajo de Investigación Documental Ley de Bragg y Difracción de Rayos XDocumento6 páginasTrabajo de Investigación Documental Ley de Bragg y Difracción de Rayos XMauro Octavio Sanchez NavarreteAún no hay calificaciones
- Tipos de DispersionesDocumento1 páginaTipos de DispersionesJose VenicioAún no hay calificaciones
- Cristalografia EstructuralDocumento42 páginasCristalografia EstructuralGian Carlo BurciagaAún no hay calificaciones
- Laboratorio de Plomo MIERCOLES (8-12)Documento9 páginasLaboratorio de Plomo MIERCOLES (8-12)Edson RiveraAún no hay calificaciones
- Analisis Gravimetrico y EquilibrioDocumento4 páginasAnalisis Gravimetrico y EquilibrioSergio Daniel Valdez AcostaAún no hay calificaciones
- Sistematica - Sistema TrigonalDocumento33 páginasSistematica - Sistema TrigonalLizbeth Hurtado SalazarAún no hay calificaciones
- CALCOPIRITADocumento4 páginasCALCOPIRITADoux RaAún no hay calificaciones
- Que Es Un Solido CristalinoDocumento8 páginasQue Es Un Solido CristalinoWiliams CHAún no hay calificaciones
- Presentacion Modulo 18 Propiedades ÓpticasDocumento35 páginasPresentacion Modulo 18 Propiedades Ópticasgilberto herreraAún no hay calificaciones
- Conullarias - Braqueopodos-EsponnjasDocumento4 páginasConullarias - Braqueopodos-EsponnjasSthefany MyaldyAún no hay calificaciones
- Datacion RadiometricaDocumento14 páginasDatacion RadiometricaIván Brañes VilchezAún no hay calificaciones
- Leyes Fundamentales de La CristalografiaDocumento10 páginasLeyes Fundamentales de La CristalografiaFernando Terán ToledoAún no hay calificaciones
- Historia de La Mineralogía y La CristalografíaDocumento11 páginasHistoria de La Mineralogía y La CristalografíaEdrsonGabrielPerezAún no hay calificaciones
- Propagación Del SonidoDocumento4 páginasPropagación Del SonidoJavier MorelliAún no hay calificaciones
- ,rotacion de Simetria y Clases de SimetriaDocumento21 páginas,rotacion de Simetria y Clases de SimetriaCamilo Alejandro Amigo HernandezAún no hay calificaciones
- Diapo - CristalografiaDocumento26 páginasDiapo - CristalografiaWilfredo Cusquisiban OcasAún no hay calificaciones
- Lantánidos y ActínidosDocumento44 páginasLantánidos y Actínidosjuannnnn100% (1)
- MaclasDocumento7 páginasMaclasDilan PeñaAún no hay calificaciones
- Enargita, TetraedritaDocumento3 páginasEnargita, TetraedritaJeanzhito SweetAún no hay calificaciones
- Mineralogia 1Documento33 páginasMineralogia 1Nikolay Martinez SalazarAún no hay calificaciones
- Físico-Química de Las ArcillasDocumento8 páginasFísico-Química de Las Arcillasluis87mgAún no hay calificaciones
- Unidad IV Acidos Carboxilicos y DerivadosDocumento54 páginasUnidad IV Acidos Carboxilicos y DerivadosLyn Xajil0% (1)
- Capitulo 2Documento20 páginasCapitulo 2GraceIsauraCamposVelarde100% (1)
- Halita MineralDocumento2 páginasHalita MineralGian Carlo Rojas AlbornozAún no hay calificaciones
- CristalografiaDocumento74 páginasCristalografiaJhon Salcedo OnofreAún no hay calificaciones
- 1414-L Práctica 1 Morfología y Simetría de Redes CristalinasDocumento6 páginas1414-L Práctica 1 Morfología y Simetría de Redes CristalinasJonathan Saviñon de los SantosAún no hay calificaciones
- Trabajo TerminadoDocumento6 páginasTrabajo TerminadoBraulio Silva0% (1)
- Quimica-004-Propiedades Intensivas y Extensivas de La MateriaDocumento4 páginasQuimica-004-Propiedades Intensivas y Extensivas de La MateriaRossel RossellAún no hay calificaciones
- Agregados Cristalinos y MaclasDocumento2 páginasAgregados Cristalinos y MaclasKevin PQ100% (1)
- TonalitaDocumento8 páginasTonalitaClaudia Patricia BarretoAún no hay calificaciones
- Clase 7. Cristalografía-Notación Hermann-MauguinDocumento29 páginasClase 7. Cristalografía-Notación Hermann-MauguinFranks Larry Antezana CalatayudAún no hay calificaciones
- Indices de Miller ReporteDocumento4 páginasIndices de Miller ReporteRicardo RamirezAún no hay calificaciones
- CristalografíaDocumento33 páginasCristalografíaGiovanny SalazarAún no hay calificaciones
- Características Generales de InosilicatosDocumento5 páginasCaracterísticas Generales de InosilicatosJulian ObandoAún no hay calificaciones
- Sólidos 12Documento28 páginasSólidos 12Alexis Allcca PomaAún no hay calificaciones
- Arreglos AmorfosDocumento6 páginasArreglos Amorfosluis pablo santiago moralesAún no hay calificaciones
- TraumatologiaDocumento9 páginasTraumatologiaLuis Jhonatan Moreyra Malpica100% (1)
- Mama SemDocumento14 páginasMama SemLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Neumologia TestDocumento26 páginasNeumologia TestLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- CoccidioidomicosisDocumento6 páginasCoccidioidomicosisLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Áreas de BrodmanDocumento4 páginasÁreas de BrodmanLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Apuntes Medicina Veronica)Documento116 páginasApuntes Medicina Veronica)Valeria Ivonne Muñoz VilugronAún no hay calificaciones
- Escuela CusqueñaDocumento13 páginasEscuela CusqueñaLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Quimica Lab10Documento11 páginasQuimica Lab10Luis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Comprension LectoraDocumento29 páginasComprension LectoraLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Cito PlasmaDocumento25 páginasCito PlasmaLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Quimica Lab11Documento10 páginasQuimica Lab11Luis Jhonatan Moreyra Malpica0% (1)
- Funciones de Variable Real Con Respecto A LaDocumento6 páginasFunciones de Variable Real Con Respecto A LaLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Clasificación de Ácidos GrasosDocumento17 páginasClasificación de Ácidos GrasosLuis Jhonatan Moreyra MalpicaAún no hay calificaciones
- Trabajo Grupal de La Sem 2Documento5 páginasTrabajo Grupal de La Sem 2lvilaruAún no hay calificaciones
- Informe Minerales GeologiaDocumento7 páginasInforme Minerales GeologiaFelipe Osnayo HernandezAún no hay calificaciones
- 12 Minerales 19 CHDocumento36 páginas12 Minerales 19 CHJuanJose88Aún no hay calificaciones
- Jefferson Sanchez - Actividad 1-P2 3.1. Tipos de TextosDocumento4 páginasJefferson Sanchez - Actividad 1-P2 3.1. Tipos de TextosANDREA PAULINA MENDOZA RODRIGUEZAún no hay calificaciones
- Agua de CristalDocumento305 páginasAgua de CristalClaudia PereyraAún no hay calificaciones
- Primer Examen Parcial de Ingenieria de Materiales IDocumento5 páginasPrimer Examen Parcial de Ingenieria de Materiales ILuis FloresAún no hay calificaciones
- Trabajo FiltracionDocumento14 páginasTrabajo FiltracionValeria BenalcazarAún no hay calificaciones
- Química Trabajo Investigación .Documento8 páginasQuímica Trabajo Investigación .Hillary MoránAún no hay calificaciones
- Clasificacion de SolidosDocumento7 páginasClasificacion de SolidosJennifer BriceñoAún no hay calificaciones
- Materiales CeramicosDocumento6 páginasMateriales CeramicosCarla Mishell Perez RamosAún no hay calificaciones
- Tema 1 - Estructuras CristalinasDocumento6 páginasTema 1 - Estructuras CristalinasTonyFontanaAún no hay calificaciones
- Laboratorio de Quimica.Documento11 páginasLaboratorio de Quimica.Carlos MuñozAún no hay calificaciones
- UrielTobiasMartinez PM T2P1Documento6 páginasUrielTobiasMartinez PM T2P1URIEL TOBIAS MARTINEZAún no hay calificaciones
- MineralesDocumento36 páginasMineralesebelin quispeAún no hay calificaciones
- Unidad 2 Enlaces QuimicosDocumento69 páginasUnidad 2 Enlaces QuimicosGuadalupe Calihua PerroniAún no hay calificaciones
- Apuntes de Conocimiento y Fabricacion de Materiales - Oswaldo v. Lozano 1963Documento116 páginasApuntes de Conocimiento y Fabricacion de Materiales - Oswaldo v. Lozano 1963Francisco OrtizAún no hay calificaciones
- Guia de Quimica Parcial IIDocumento6 páginasGuia de Quimica Parcial IIHugo Cesar GAún no hay calificaciones
- Imperfecciones en Los Arreglos AtómicosDocumento5 páginasImperfecciones en Los Arreglos AtómicosYordan Marcelo JacomeAún no hay calificaciones
- Seminario de CristalizaciónDocumento2 páginasSeminario de Cristalizacióndelvis mendezAún no hay calificaciones
- Flotación de Minerales (Libro) PDFDocumento127 páginasFlotación de Minerales (Libro) PDFElena Tobar Velásquez100% (1)
- Estructura Atomica y Propiedades de Los MetalesDocumento90 páginasEstructura Atomica y Propiedades de Los MetalesdanielaAún no hay calificaciones
- Clase 11 Cuarzos Maestros - Casa BerkanaDocumento65 páginasClase 11 Cuarzos Maestros - Casa BerkanaJull Antonio Casas RomeroAún no hay calificaciones
- Los Instrumentos AtlantesDocumento3 páginasLos Instrumentos AtlantesMariela Pato AlvarezAún no hay calificaciones
- Cristales de Agua PDFDocumento40 páginasCristales de Agua PDFOlga Monfort MoñinoAún no hay calificaciones
- Capítulo 11, Fuerzas Intermoleculares, Líquidos y Sólidos, Practica Resuelta.Documento9 páginasCapítulo 11, Fuerzas Intermoleculares, Líquidos y Sólidos, Practica Resuelta.Luis Jose Serracin0% (1)
- Monografia Vidrios y CeramicosDocumento29 páginasMonografia Vidrios y Ceramicoswalter samuel olivos megoAún no hay calificaciones
- Todo Sobre ArcillaDocumento30 páginasTodo Sobre ArcillaCristhian André Yumpo BrunoAún no hay calificaciones
- Manual de CristalografiaDocumento195 páginasManual de CristalografiaWalter Orlando Boñón AlcántaraAún no hay calificaciones
- Ficha de Tarea 06 (Alex Orosco Quintana)Documento2 páginasFicha de Tarea 06 (Alex Orosco Quintana)Alex Franz Orosco QuintanaAún no hay calificaciones
- Cristales en Orinas Acidas, Cristales en Orinas AlcalinasDocumento8 páginasCristales en Orinas Acidas, Cristales en Orinas AlcalinasGesús De La CruzAún no hay calificaciones