Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Teoría de Arrhenius de La Disociación Electrolítica
Cargado por
Huguiito RcDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Teoría de Arrhenius de La Disociación Electrolítica
Cargado por
Huguiito RcCopyright:
Formatos disponibles
Teora de Arrhenius de la disociacin electroltica [editar]
1. De los tomos totales que constituyen una sustancia electroltica, una parte se va
cargando de electricidad a medida que se produce la disolucin y el resto queda en
estado de neutralidad.
2. La formacin de iones es un proceso independiente del paso de la corriente
elctrica.
3. Los iones actan independientemente unos de los otros y de las molculas sin
disociar, y son diferentes en sus propiedades fsicas y qumicas.
4. La disociacin electroltica es un proceso reversible.
5. Las partculas con carga elctrica son atradas por el electrodo de signo contrario.
6. Cuando los iones se dirigen a sus respectivos electrodos, pierden sus cargas
elctricas, se transforman en tomos y adquieren propiedades qumicas ordinarias.
O en otra explicacin Para explicar que las soluciones o en estado de electrlitos conducen la
corriente elctrica, as como el caracter cido o bsico de sus soluciones, Svante Arrhenius
publico su teoria de la disociacin inica basada en los 5 postulados: 1. er postulado: Los
electrlitos en solucin acuosa o fundidas se disocian parcialmente en iones (restos de
tomos o grupos de tomos cargados) NaCl>>> Na+1 + Cl-1. 2. postulado: La disociacin de
un electrlito en agua es un proceso reversible puesto que los iones formados se unen a su
vez para formar de nuevo la sustancia original, es decir se establece un sistema en "equilibrio
dinmico". NaCl <====> Na+1 + Cl-1 (sol. acuosa). al diluir la solucin (con ms agua) los
iones incrementan su separacin hacindose ms difcil el unirse nuevamente para formar la
sustancia inicial, esto hace que el equilibrio se desplace hacia la derecha o sea en el sentido
de aumentar la cantidad de iones, hasta que se alcanza el estado de equilibrio dinmico.
3.er postulado: los iones actan independientemente unos de otros y de las molculas. 4.
postulado: Un cido es una sustancia que contiene hidrgeno (H), y al disolverse en el agua
produce iones Hidronios (H+), tambin llamados protones, segn arrhenius, la reaccin es
reversible: HCl (ac)<===> H+ + Cl- (sol.acuosa) Base es toda sustancia que contiene OH y al
disolverse en el agua produce iones hidrxidos u oxhidrilos (OH-) segn arrhenius la reaccin
es reversible: KOH(ac)<====> K+ + OH- (sol.acuosa). 5. postulado: El proceso de
neutralizacin (cido + base >>> sal + agua) se centra en la reaccin entre los iones H+ y OHpara formar agua, H+(ac) + OH- (ac) >>>> H2O (l)
También podría gustarte
- Tipos de MovimientosDocumento12 páginasTipos de MovimientosanddiemedinnaAún no hay calificaciones
- Tipos de Contracción MuscularDocumento9 páginasTipos de Contracción MuscularJulian InLack EchAún no hay calificaciones
- Tipos de DeformacionesDocumento13 páginasTipos de DeformacionesAlex Junior Rodriguez BarranzuelaAún no hay calificaciones
- Efectos Del Masaje Sobre Diferentes Sistemas - PPT LISTODocumento81 páginasEfectos Del Masaje Sobre Diferentes Sistemas - PPT LISTOPaola Ixchel Hernandez Yepez67% (3)
- AnabolismoDocumento1 páginaAnabolismoJessica Veliz AlfonzoAún no hay calificaciones
- Ejercicios Coordinacion, Marcha, Equilibrio 1Documento2 páginasEjercicios Coordinacion, Marcha, Equilibrio 1Ximena Sanchez100% (1)
- CICLO DE KREBS ENSAYO Tarea PDFDocumento3 páginasCICLO DE KREBS ENSAYO Tarea PDFEdgar EncinoAún no hay calificaciones
- 1.0. Guía Prótesis Dentales - 2023ADocumento10 páginas1.0. Guía Prótesis Dentales - 2023Amaria esperanzaAún no hay calificaciones
- Unión NeuromuscularDocumento22 páginasUnión NeuromuscularLore WorsnopAún no hay calificaciones
- Estructura AtomicaDocumento3 páginasEstructura AtomicaAnonymous IFzMDxDAún no hay calificaciones
- Enfermedad de Sever: DOCENTE: Andrés Felipe MuñozDocumento17 páginasEnfermedad de Sever: DOCENTE: Andrés Felipe MuñozTatiana Camila Ceron LinaresAún no hay calificaciones
- La Fisioterapia y Su Impacto en El Medio AmbienteDocumento10 páginasLa Fisioterapia y Su Impacto en El Medio AmbientePablo A Hernandez GonzalezAún no hay calificaciones
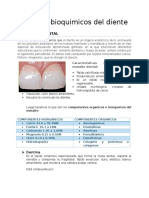
- Aspectos Bioquímicos Del DienteDocumento6 páginasAspectos Bioquímicos Del DienteJorge RamírezAún no hay calificaciones
- Ejercicios Impigment HombDocumento2 páginasEjercicios Impigment Hombabd efg100% (1)
- Homeostasis y Transporte de Membrana PDFDocumento55 páginasHomeostasis y Transporte de Membrana PDFPerla LP100% (1)
- Taller AnatomiaDocumento5 páginasTaller AnatomiaEliana Carpio100% (1)
- Programa AVNIADocumento21 páginasPrograma AVNIAJose Luis Ore NavarroAún no hay calificaciones
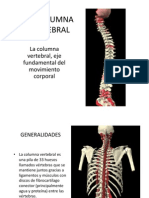
- Apuntes Columna VertebralDocumento3 páginasApuntes Columna VertebralNani Wants Rẹvenge100% (1)
- Practica OsmosisDocumento6 páginasPractica OsmosisIsaac Bermejo GamezAún no hay calificaciones
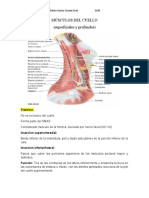
- Músculos Del CuelloDocumento4 páginasMúsculos Del CuelloYaz Chirino GarciaAún no hay calificaciones
- La Column A VertebralDocumento30 páginasLa Column A Vertebralmapat1689Aún no hay calificaciones
- Espectro ElectromagnetismoDocumento6 páginasEspectro ElectromagnetismoGianfranco MuñozAún no hay calificaciones
- Informe Elaboración EMG - BioinstrumentaciónDocumento4 páginasInforme Elaboración EMG - BioinstrumentaciónJessica CarvajalAún no hay calificaciones
- Prescripción Del Ejercicio Adulto MayorDocumento15 páginasPrescripción Del Ejercicio Adulto MayorFernanda Cordova UlloaAún no hay calificaciones
- Alteraciones Del Esqueleto AxialDocumento5 páginasAlteraciones Del Esqueleto AxialBlanca pedrazaAún no hay calificaciones
- Anomalías Congénitas y AdquiridasDocumento4 páginasAnomalías Congénitas y AdquiridasNani Jv MoralesAún no hay calificaciones
- ONDA CORTA RoyerDocumento23 páginasONDA CORTA RoyerPaola GMAún no hay calificaciones
- Evolucion Instrumentos DentistaDocumento8 páginasEvolucion Instrumentos DentistaKarla Ibarra0% (2)
- 1era Sesion PDFDocumento21 páginas1era Sesion PDFMarilyn PerezAún no hay calificaciones
- POLEOTERAPIADocumento30 páginasPOLEOTERAPIAIvanna MeneAún no hay calificaciones
- Dolor NociceptivoDocumento32 páginasDolor NociceptivoYarima MoralesAún no hay calificaciones
- Amputaciones y Prótesis de Miembros InferioresDocumento17 páginasAmputaciones y Prótesis de Miembros InferioresBelly gianella Salas trigosoAún no hay calificaciones
- Propioceptores MuscularesDocumento14 páginasPropioceptores MuscularesRodrigo Durán San MartínAún no hay calificaciones
- Generalidades de Los HuesosDocumento17 páginasGeneralidades de Los HuesosLucrecia TrujilloAún no hay calificaciones
- Biofisica II Fuerzas Masticatorias y Ortodoncicas 2017Documento2 páginasBiofisica II Fuerzas Masticatorias y Ortodoncicas 2017Vito Correa100% (1)
- Fisiología Neuromuscular. PDFDocumento62 páginasFisiología Neuromuscular. PDFMaría José CabreraAún no hay calificaciones
- Conversion de TemperaturaDocumento2 páginasConversion de Temperaturaconker360Aún no hay calificaciones
- Cinemática de La Articulación de CaderaDocumento7 páginasCinemática de La Articulación de CaderaAndy HerreraAún no hay calificaciones
- EMETROPÍADocumento3 páginasEMETROPÍACitlali Abigail Zamudio Zuñiga100% (1)
- Leyes de Camara Pulpar.Documento9 páginasLeyes de Camara Pulpar.Feri BuenoAún no hay calificaciones
- Generalidades Del Sistema OseoDocumento18 páginasGeneralidades Del Sistema OseoCristhian CH100% (1)
- Evolución Histórica de La Escoliosis PDFDocumento594 páginasEvolución Histórica de La Escoliosis PDFAnonymous 7mnMaHAún no hay calificaciones
- Goniometria de La Columna CervicalDocumento3 páginasGoniometria de La Columna CervicalPazita Fuentes JaraAún no hay calificaciones
- Articulador Tipo IVDocumento3 páginasArticulador Tipo IVjose alexander100% (1)
- 01 Guia Osteologia de Columna VertebralDocumento13 páginas01 Guia Osteologia de Columna VertebralCarlos UrquijoAún no hay calificaciones
- Apuntes de AnatomíaDocumento33 páginasApuntes de AnatomíaivanAún no hay calificaciones
- Semana 05 EyF - Guia de Práctica 05Documento9 páginasSemana 05 EyF - Guia de Práctica 05carlosbullonperuAún no hay calificaciones
- Clasificación de Las Células PDFDocumento4 páginasClasificación de Las Células PDFCindy VegaAún no hay calificaciones
- Artritis y ArtrosisDocumento14 páginasArtritis y ArtrosisFernanda Fernández Cardenas100% (1)
- OrtesisDocumento18 páginasOrtesisYamil Yasser Salim TorresAún no hay calificaciones
- Articulaciones, Clasificacion y Tipos de Ligamentos y ArticulacionesDocumento8 páginasArticulaciones, Clasificacion y Tipos de Ligamentos y ArticulacionesYesenia Tirado0% (1)
- Fisio Lab 1Documento2 páginasFisio Lab 1Justine Thibaut Delgado100% (1)
- Clasificación de Los Biomateriales DentalesDocumento11 páginasClasificación de Los Biomateriales DentalesCamila Yáñez CancinoAún no hay calificaciones
- Presentación KabatDocumento38 páginasPresentación KabatDiego TCAún no hay calificaciones
- Generalidades ElectricasDocumento20 páginasGeneralidades ElectricasAlain Joseph Berthiaume RosceroAún no hay calificaciones
- Anatomia Musculos Cadera TablaDocumento5 páginasAnatomia Musculos Cadera TablaMiriam JuàrezAún no hay calificaciones
- Quimica Organica 5to Año - Enlace QuímicoDocumento6 páginasQuimica Organica 5to Año - Enlace QuímicoAnonymous kEC3kiyAún no hay calificaciones
- Reacciones AcuosasDocumento13 páginasReacciones AcuosasLuis QuintanillaAún no hay calificaciones
- Trabajo Escrito de La Experimentación en QuimicaDocumento14 páginasTrabajo Escrito de La Experimentación en QuimicaMario HernandezAún no hay calificaciones
- Teoría de La Disociación ElectrolíticaDocumento2 páginasTeoría de La Disociación ElectrolíticaMiguel Angel Llihua CardenasAún no hay calificaciones
- SolucionarioDocumento71 páginasSolucionarioHuguiito RcAún no hay calificaciones
- Enfriamiento Del Efluente de Un Reactor Con Un Separador FlashDocumento17 páginasEnfriamiento Del Efluente de Un Reactor Con Un Separador FlashHuguiito Rc0% (2)
- Evaporador Triple EfectoDocumento3 páginasEvaporador Triple EfectoHuguiito RcAún no hay calificaciones
- Cuestionario 2 Ing ProyectosDocumento2 páginasCuestionario 2 Ing ProyectosHuguiito RcAún no hay calificaciones
- ReactoresDocumento10 páginasReactoresHuguiito RcAún no hay calificaciones
- PROFECO Estudio-Nectares PDFDocumento16 páginasPROFECO Estudio-Nectares PDFHuguiito RcAún no hay calificaciones
- Estrategia Seis SigmaDocumento14 páginasEstrategia Seis SigmaHuguiito RcAún no hay calificaciones
- OTM II Planta Combinada RMGDocumento40 páginasOTM II Planta Combinada RMGHuguiito RcAún no hay calificaciones
- Manual de Semillas FINALDocumento23 páginasManual de Semillas FINALHuguiito RcAún no hay calificaciones
- OTM II - Planta de Gas Amargo - RMGDocumento10 páginasOTM II - Planta de Gas Amargo - RMGHuguiito RcAún no hay calificaciones
- OTM II Planta Etanol RMGDocumento14 páginasOTM II Planta Etanol RMGHuguiito RcAún no hay calificaciones
- Evaporador Triple EfectoDocumento3 páginasEvaporador Triple EfectoHuguiito RcAún no hay calificaciones
- Los CarbohidratosDocumento8 páginasLos CarbohidratosHuguiito RcAún no hay calificaciones
- FiabilidadDocumento16 páginasFiabilidadHuguiito RcAún no hay calificaciones
- Evaporador Triple EfectoDocumento3 páginasEvaporador Triple EfectoHuguiito RcAún no hay calificaciones