Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Clase 12-Volumetria Complejamiento
Cargado por
EduardoLalo MamaniDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Clase 12-Volumetria Complejamiento
Cargado por
EduardoLalo MamaniCopyright:
Formatos disponibles
VOLUMETRA DE FORMACIN
DE COMPLEJOS
I. QUMICA DE DISOLUCIONES ACUOSAS
VALORACIN COMPLEXOMTRICA
Cuantificacin de un METAL mediante la adicin de un
agente complejante (LIGANDO: QUELANTE) de
concentracin conocida (viceversa).
Los quelantes tiene la
ventaja de forman
complejos 1:1. Lo que
simplifica la eleccin de
un indicador.
TIPOS DE VOLUMETRIA
VALORACIN DIRECTA: determinacin de un metal
con un ligando (en general complejo incoloro) en
presencia de un indicador metalocrmico.
Mg-In + EDTA Mg-EDTA + In Keq >> 1
meq(Mg) = meq (EDTA)
INDICADORES METALOCROMICOS: macromolculas
que adems de tener propiedades cido-base forman
complejos con algunos metales.
NET (negro de eriocromo T)
H
2
In
-
I HIn
-2
I
In
-3
pH
Rojo 6,3 azul 11,6 naranja
VALORACION COMPLEJOMETRICA
ZONA DE VIRAJE: (pM = pKc
MIn
1)
INDICADORES METALOCRMICOS
Compuesto cuyo color cambia cuando se une a
un ion metlico. Debe unirse al ion con menos
fuerza que el EDTA
In MgEDTA EDTA MgIn + +
Poseen valores de pKa, por lo que
generalmente estos indicadores se utilizan en
ciertos intervalos de pH (color depende del
medio de valoracin).
Negro de eriocromo T
) ( ) ( vino rojo M NET azul NET
n
LIBRE
+
NET
complejado
NET libre
In
4
H
2
3
In H
3
2
In H
2 , 9 9 , 10
violeta
rojo
violeta azul
Murexida
) (
) (
Ca Rosa
Cu Ni Co Amarillo
Murexida
complejado
Murexida
libre
Reaccin del indicador
MIn In M +
| || |
| | MIn
In M
Kc
MIn
=
| |
| | MIn
In
pKc pM
MIn
log + =
| |
| |
1 10 + = > pKc pM
MIn
In
Si
| |
| |
1 10 = s pKc pM
MIn
In
Si
indicador viraje pKc pM 1 =
EVALUEMOS LA
CONDICIONALIDAD
LIGANDO E INDICADOR CON PROPIEDADES
ACIDO BASE
+
+
4 2 2
Y Mg MgY
1 , 9
10
2
=
MgY
Kc
+
+
3 2
In Mg MgIn
1 , 9
10
MgIn
Kc
II
Mg
NO FORMA COMPLEJOS HIDROXILADOS
1 =
II
Mg
o
EVALUAR Kc a pH : 10
LIGANDO E INDICADOR CON PROPIEDADES
ACIDO BASE
4 3 2 1
4
3 2 1
3
2 1
2
1
1
Ka Ka Ka Ka
H
Ka Ka Ka
H
Ka Ka
H
Ka
H
Y
+
+
+ + =
+ + + +
o
Y H Y H Y H HY Y Y
Total 4 3
2
2
3 4
+ + + + =
3 10 1
10
1
3 , 0
3 , 10
10
= + = + =
+
=
H
pH
Y
o
) (EDTA Y
LIGANDO E INDICADOR CON PROPIEDADES
ACIDO BASE
5 , 1
5 , 11
10
8 , 17
2
5 , 11
10
10
10
1
10 10
1 ~ + ~ + + =
+
H H
In
o
+ + = In H HIn In In
2
2 3
In In In
Y
Ka Ka
H
Ka
H
2 1
2
1
1
+ + =
+ +
o
5 , 11
1
=
In
pKa
3 , 6
2
=
In
pKa
Indicador
VALORACION
Bureta con EDTA
Erlenmeyer con Mg
2+
+Indicador
+ 2
Mg
6 , 8 1 , 9
10 3 10
2
= =
MgY
Kc
6 , 7 5 , 1 1 , 9
10 10 10
= =
MgIn
Kc
10 pH
SIGAMOS LA VALORACION
0 = X MgII
0
logC pMg =
ADO INDETERMIN pY =
| | 1 0 = X EDTA Mg EDTA Mg +
+ 2
0
C
x
) 1 ( *
0
x C
x C *
0
EN SOLUCION TENEMOS
+ 2 2
/ MgY Mg
) 1 ( log log
0
2
x C Mg pMg dil = =
+
MgY
Mg
pKc Y pY log log + = =
x
x
pKc pY
+ =
1
log
SIGAMOS LA VALORACION
1 > X
EDTA Mg EDTA Mg +
+ 2
0
C
x
) 1 ( *
0
x C
*
0
C
EN SOLUCION TENEMOS
2 4
/ MgY Y
*
) 1 ( *
log log
0
0 2
C
x C
pKc Mg pMg
+ = =
+
) 1 ( * log log
0
= = x C Y pY
) 1 log( + = x pKc pMg
1 = X
EN SOLUCION TENEMOS EDTA Mg
* log
0
2
1
2
1
C pKc pY pMg = =
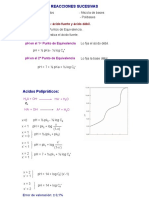
PUNTO EQUIVALENCIA
* log
0
2
1
2
1
C pKc pY pMg
MgY
= =
VALORACION DE UNA MUESTRA
M Mg 01 , 0
2
~
+
M Y 01 , 0
4
=
+
=
4 2
Y Mg
V V
005 , 0
2
01 , 0
*
0
= =
M
C
45 , 5 005 , 0 log 6 , 8
2
1
2
1
= = = pY pMg
6 , 8
10
2
=
MgY
Kc
CON UN MARGEN DE ERROR DE UN 1%
) 1 ( * log
0
x C pMg =
ERROR(+)
X
1
5 , 5
pMg
ERROR(-)
01 , 0 1= X
01 , 0 1 = X
1 = X
2
MgY
3 , 4 ) 01 , 0 ( 005 , 0 log = = pMg
) 1 log( + = x pKc pMg
6 , 6 ) 01 , 0 log( 6 , 8 = + = pMg
6 , 6
3 , 4
% ERROR CON INDICADOR UTILIZADO
PUNTO FINAL
= =
MgIn
pKc pY pMg
6 , 7 = pMg
QUE TIPO DE ERROR TENEMOS?
ERROR POR EXCESO
2 4
/ MgY Y
|
.
|
\
|
+ =
1
1
log 6 , 8
X
pMg
1
10 1
= X
( ) % 10 100 1 % = = x
( ) 1 log 6 , 8 6 , 7 + = X
1 > X
I) Para realizar la cuantificacin de Zn(II) en una muestra se sugiere realizar una
volumetra de complejamiento a pH 9.0 utilizando cido dietilentriaminopentaactico
(DTPA) como reactivo valorante, el cual simbolizaremos como H
5
L y Negro-azul de
Eriocromo B como indicador (H
2
In). Sabiendo que:
pkc ZnL
-3
= 18 pK HZnL
-2
= 5,6 pKc ZnOH
+
= 4,4
DTPA H
5
L: pK
5
=1,9 pK
4
=2,9 pK
3
=4,4 pK
2
=8,7 pK
1
=10,6
pkc ZnIn (pKIn)= 12,3 H
2
In : pK
2
=6,2 pK
1
=12,5
1)Justifique la posibilidad de realizar la valoracin antes mencionada, para ello calcule
la constante condicional del complejo ZnL
-3
.
2) Se valoran 20 mL de Zn(II) 0,01 M con DTPA (H
5
L) 0,02 M a pH 9. Calcule:
A) pZn inicial
B) pZn en el punto de equivalencia.
C) pZn en el punto final.
D) el error que se comete en la valoracin cuando se utiliza el indicador antes
mencionado.
Ejercicios
II) El Bi(III) puede ser valorado a pH 5.0 con cido diamino 1-2 ciclohexano tetraactico
(DCTA) que simbolizaremos como H
4
L y utilizando violeta de pirocatecol como indicador
(H
3
In).
Se valoran 25 mL de Bi(III) 0,01 M con H
4
L 0,01 M a pH 5,0. Calcule:
a) La constante condicional del complejo BiL
-
a pH 5,0
b) pBi cuando se han agregado: 0- 10- 25 y 30 mL de H
4
L 0,01 M.
c) El porcentaje de error que se cometera al utilizar el indicador violeta de
pirocatecol.
pkc BiL
-
= 24,1 pKc BiOH
+2
= 12,4
DCTA (H
4
L): pK
4
=2,5 pK
3
=3,6 pK
2
=6,2 pK
1
=11,8
pkc BiIn = 27,1 H
3
In: pK
3
=7,8 pK
2
=9,8 pK
1
=11,7
Ejercicios
También podría gustarte
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- I.-Volumetría ComplexométricaDocumento16 páginasI.-Volumetría Complexométricajaviera.munoz.oAún no hay calificaciones
- Volumetria de Complejamiento (2008)Documento2 páginasVolumetria de Complejamiento (2008)Andrea SarmientoAún no hay calificaciones
- Guía de Volumetria de ComplejamientoDocumento2 páginasGuía de Volumetria de ComplejamientoIris Barra SassoAún no hay calificaciones
- Clase 10-Equilibrio de ComplejosDocumento34 páginasClase 10-Equilibrio de ComplejosEduardoLalo MamaniAún no hay calificaciones
- Reacciones de Formación de Complejos A PH ControladoDocumento9 páginasReacciones de Formación de Complejos A PH ControladoAlejandro CruzAún no hay calificaciones
- Tarea 3 Serie ComplejosDocumento3 páginasTarea 3 Serie ComplejosRogelio Hernandez MoralesAún no hay calificaciones
- Art. Lab Oratorio Comparacion Gravimetria y Complejometria 2Documento7 páginasArt. Lab Oratorio Comparacion Gravimetria y Complejometria 2Jessica Lorena Izquierdo MerchanAún no hay calificaciones
- 7GUIA Equilibrio de Complejos 2011Documento2 páginas7GUIA Equilibrio de Complejos 2011EduardoLalo MamaniAún no hay calificaciones
- Consipvt (Manual)Documento21 páginasConsipvt (Manual)Franck IparraguirreAún no hay calificaciones
- Valoración de Poliácidos y PolibasesDocumento6 páginasValoración de Poliácidos y PolibasesCristhián BustosAún no hay calificaciones
- QA PROB 2doCUAT2016 2da ParteDocumento27 páginasQA PROB 2doCUAT2016 2da ParteYoselin GomezAún no hay calificaciones
- Volumetria de ComplejosDocumento29 páginasVolumetria de ComplejosEsthefany Aguilar GomezAún no hay calificaciones
- RedoxycomplejosDocumento11 páginasRedoxycomplejosRojas GustavoAún no hay calificaciones
- APUNTeS de BalanceDocumento18 páginasAPUNTeS de BalanceAlberto de la PuenteAún no hay calificaciones
- 2018 OPQ Fase 1 Intermedio FinalDocumento17 páginas2018 OPQ Fase 1 Intermedio FinalJoseAún no hay calificaciones
- Valoraciones Con EDTADocumento12 páginasValoraciones Con EDTAFercho Rojas RamosAún no hay calificaciones
- Ejercicios Complejos 2009 (Con Respuestas)Documento3 páginasEjercicios Complejos 2009 (Con Respuestas)Silvana Belén Romo GallardoAún no hay calificaciones
- G3 - SG3 - Informe Determinación Del KPS Del Bitartrato de PotasioDocumento12 páginasG3 - SG3 - Informe Determinación Del KPS Del Bitartrato de PotasioLEONARDO ALCIDES ROMERO ZAPANAAún no hay calificaciones
- TP 2 Volumetria de Complejos y PrecipitacionDocumento8 páginasTP 2 Volumetria de Complejos y PrecipitacionrosaAún no hay calificaciones
- Volumetria PDFDocumento30 páginasVolumetria PDFElias Sulca QuispeAún no hay calificaciones
- Propiedades Gas PDFDocumento51 páginasPropiedades Gas PDFJesus Jesus UrreaAún no hay calificaciones
- Formulario Curso QIM100EDocumento7 páginasFormulario Curso QIM100ERODRIGO VILLENAAún no hay calificaciones
- Cuanti II-p.3 Informe CompletoDocumento7 páginasCuanti II-p.3 Informe CompletoJoha AlcocerAún no hay calificaciones
- Reactores ParteIII Individual, EtilenglicolDocumento12 páginasReactores ParteIII Individual, EtilenglicolJulio Daniel Mancilla RendonAún no hay calificaciones
- Quimica A 2401Documento4 páginasQuimica A 2401Fernanda Dávila MorenoAún no hay calificaciones
- Guia de Complejos Con Efect de PFDocumento2 páginasGuia de Complejos Con Efect de PFaesthetic origamiAún no hay calificaciones
- Tarea Sesión3 - Grupo 01Documento11 páginasTarea Sesión3 - Grupo 01ROBERTO CARLOS CHINGA FLORES100% (1)
- Clase 5 Unidad 4 Volumetria de PrecipitacionDocumento33 páginasClase 5 Unidad 4 Volumetria de PrecipitacionAlejandra RuizAún no hay calificaciones
- Ejercicios de Equilibrios de Formación de Complejos y Valoraciones ComplejométricasDocumento6 páginasEjercicios de Equilibrios de Formación de Complejos y Valoraciones ComplejométricasEstefania VelascoAún no hay calificaciones
- Informe - Titulación de Peróxido de HidrogenoDocumento8 páginasInforme - Titulación de Peróxido de HidrogenoKarla CabreraAún no hay calificaciones
- Tema 8 PotenciometriaDocumento40 páginasTema 8 PotenciometriaLina_Daza_5396Aún no hay calificaciones
- Q.a.2 Reporte Practica Tradicional 1aDocumento8 páginasQ.a.2 Reporte Practica Tradicional 1aDiego CarñoAún no hay calificaciones
- PotenciometriaDocumento6 páginasPotenciometriaJean Pierre Paredes TocasAún no hay calificaciones
- Sol Ex P Cq312 19-2Documento3 páginasSol Ex P Cq312 19-2Elvis RenzoAún no hay calificaciones
- Examen 2 SEMANA Junio 2020 BloquesDocumento4 páginasExamen 2 SEMANA Junio 2020 BloquesMarisol SueroAún no hay calificaciones
- QA I Titulacion de ComplejosDocumento16 páginasQA I Titulacion de ComplejosMagda Andrea FigueroaAún no hay calificaciones
- Informe N°6 Q. AnalíticaDocumento12 páginasInforme N°6 Q. AnalíticaGiancarla A. Lipe LuqueAún no hay calificaciones
- Exf cq312-19-1Documento3 páginasExf cq312-19-1jeavibuAún no hay calificaciones
- I02N Material S10.s1Documento11 páginasI02N Material S10.s1kevin segoviaAún no hay calificaciones
- Grado 10 Estequiometria y Gases Instituto Tecnico Comercial Villa Del SurDocumento12 páginasGrado 10 Estequiometria y Gases Instituto Tecnico Comercial Villa Del SurLina Maria Santos MillanAún no hay calificaciones
- Informe 05Documento7 páginasInforme 05Camila Figueroa AbarcaAún no hay calificaciones
- Indicadores MetalocromicosDocumento18 páginasIndicadores MetalocromicosBelen Fernandez75% (4)
- Quimica Analitica Instrumental 6°1 - 6°4 Tema: Volumetría Por Formación de ComplejosDocumento5 páginasQuimica Analitica Instrumental 6°1 - 6°4 Tema: Volumetría Por Formación de ComplejosHelver GalargaAún no hay calificaciones
- Clase 15 - Volumetria RedoxDocumento25 páginasClase 15 - Volumetria RedoxEduardoLalo MamaniAún no hay calificaciones
- Psa QMC 22011 PDFDocumento4 páginasPsa QMC 22011 PDFRichard Frank Choque100% (1)
- Tarea 2. Unidad 2 (Ejercicios Cap. 6)Documento11 páginasTarea 2. Unidad 2 (Ejercicios Cap. 6)Gabo Alejo AguirreAún no hay calificaciones
- Volumetria de ComplejosDocumento27 páginasVolumetria de ComplejosFrine Ruiz Coronel100% (3)
- Ejercicios Complejos 2008Documento3 páginasEjercicios Complejos 2008Andrea SarmientoAún no hay calificaciones
- Analis de Agua Labo Aq Informe Labo 6Documento17 páginasAnalis de Agua Labo Aq Informe Labo 6EDITH CAROL SUCAPUCA ESPIRITUAún no hay calificaciones
- Lab 2 Practica 3 - Equipo 1Documento16 páginasLab 2 Practica 3 - Equipo 1Santiago GonzálezAún no hay calificaciones
- Previo Practica 8Documento7 páginasPrevio Practica 8DANIEL SANCHEZ BRAVOAún no hay calificaciones
- Guas de Trabajos PracticosDocumento104 páginasGuas de Trabajos PracticosLeonardo Fabian LamasAún no hay calificaciones
- Propiedades Fisicas Del Gas NaturalDocumento23 páginasPropiedades Fisicas Del Gas NaturalLorena Castillo83% (6)
- Examen Primera Conv 2014-15Documento2 páginasExamen Primera Conv 2014-15NoeliaAún no hay calificaciones
- Fórmula Empírica y MolecularDocumento6 páginasFórmula Empírica y MolecularIvan Flores AlmarazAún no hay calificaciones
- Resolucion Regularizador 10-08-2022Documento3 páginasResolucion Regularizador 10-08-2022Cami TurdoAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Ejemplos de Energia Limpia PDFDocumento10 páginasEjemplos de Energia Limpia PDFEduardoLalo MamaniAún no hay calificaciones
- Informe San Lorenzo PDFDocumento39 páginasInforme San Lorenzo PDFEduardoLalo MamaniAún no hay calificaciones
- Manual de Propaganda-1Documento19 páginasManual de Propaganda-1EduardoLalo MamaniAún no hay calificaciones
- Ejemplos de Energia Limpia PDFDocumento10 páginasEjemplos de Energia Limpia PDFEduardoLalo MamaniAún no hay calificaciones
- Tomo 1 Curso Consultor Sap UdemyDocumento44 páginasTomo 1 Curso Consultor Sap UdemyJuan HernandezAún no hay calificaciones
- Tierras Raras FinalDocumento8 páginasTierras Raras FinalEduardoLalo MamaniAún no hay calificaciones
- Relleno SanitarioDocumento151 páginasRelleno Sanitarioanon-95997380% (5)
- Compositacion v5Documento41 páginasCompositacion v5EduardoLalo MamaniAún no hay calificaciones
- Marco de Cualificaciones para La MineriaDocumento234 páginasMarco de Cualificaciones para La MineriaAtenas EduardoAún no hay calificaciones
- Arcillas RT PDFDocumento153 páginasArcillas RT PDFEduardoLalo MamaniAún no hay calificaciones
- La Industria Del YODO en TarapacaDocumento25 páginasLa Industria Del YODO en TarapacaEduardoLalo MamaniAún no hay calificaciones
- Publicacion Mallas de Extraccion RIM USACHDocumento21 páginasPublicacion Mallas de Extraccion RIM USACHJuan Pablo Sanchez MelgarejoAún no hay calificaciones
- Eia DomingaDocumento39 páginasEia DomingaEduardoLalo MamaniAún no hay calificaciones
- Sesión 9.2 PetrologíaDocumento10 páginasSesión 9.2 PetrologíaEduardoLalo MamaniAún no hay calificaciones
- TronaduraDocumento9 páginasTronaduraFelipe Javier Arias CubillosAún no hay calificaciones
- Guía Selección de Protección RespiratoriaDocumento2 páginasGuía Selección de Protección RespiratoriaEduardoLalo MamaniAún no hay calificaciones
- Guía de Ejercicios Agentes QuímicosDocumento3 páginasGuía de Ejercicios Agentes QuímicosEduardoLalo MamaniAún no hay calificaciones
- 1 PBDocumento10 páginas1 PBRenzo MurilloAún no hay calificaciones
- Guía Selección de Protección RespiratoriaDocumento2 páginasGuía Selección de Protección RespiratoriaEduardoLalo MamaniAún no hay calificaciones
- 1 Informe Resistividad de SueloDocumento22 páginas1 Informe Resistividad de SueloAndrés Molina100% (2)
- Dise o de TaludesDocumento7 páginasDise o de TaludeskichysAún no hay calificaciones
- Cuestionario 6Documento1 páginaCuestionario 6EduardoLalo MamaniAún no hay calificaciones
- Medida de La Resistividad Electrica Del SubsueloDocumento24 páginasMedida de La Resistividad Electrica Del SubsueloZacarias BlancoAún no hay calificaciones
- Diseno de Tunels 2Documento26 páginasDiseno de Tunels 2Milenko BarreraAún no hay calificaciones
- Guia 60 IC para La VarianzaDocumento3 páginasGuia 60 IC para La VarianzaEduardoLalo MamaniAún no hay calificaciones
- 13-Esfuerzos in SituDocumento25 páginas13-Esfuerzos in SituDaniela Montes100% (2)
- Resistencia ResistividadDocumento39 páginasResistencia ResistividadEduardoLalo MamaniAún no hay calificaciones
- Malla Ingeniería Civil en MinasDocumento1 páginaMalla Ingeniería Civil en MinasEduardoLalo MamaniAún no hay calificaciones
- Ejercicios Circulo de MohrDocumento10 páginasEjercicios Circulo de MohrJorge Riaño AriasAún no hay calificaciones
- Apunte Variables Aleatorias PDFDocumento10 páginasApunte Variables Aleatorias PDFEduardoLalo Mamani100% (1)